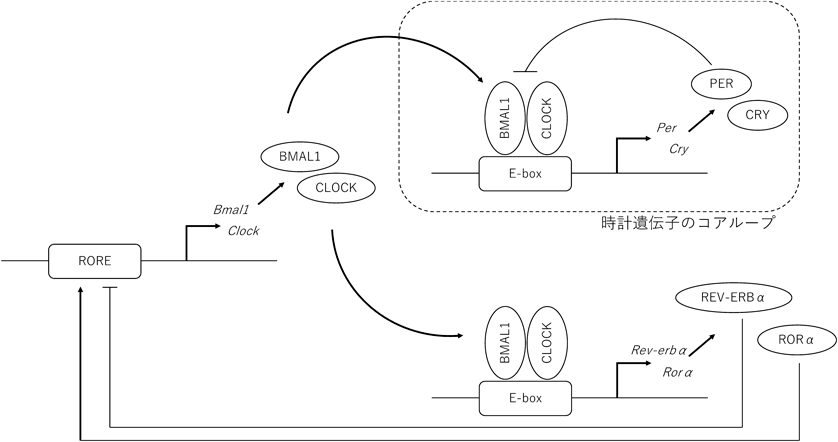
1)体内時計の分子機構
我々ヒトを含めた哺乳類は睡眠・覚醒リズムや体温などに,1日約24時間周期の概日リズムを持っている.この概日リズムはPeriod(Per), Cryptochrome(Cry), Bain and muscle ARNT-like 1(Bmal1),Circadian locomotor output cycles kaput(Clock)といった時計遺伝子によって制御されている.時計遺伝子は一つ一つの細胞で働いており,これらの時計遺伝子の転写・翻訳によってmRNAおよびタンパク質が増減することで,約24時間周期のリズムを形成している1–3).
その詳細な機構を以下に記載する.まず時計遺伝子産物のCLOCKとBMAL1タンパク質は二量体を形成し,時計遺伝子PerやCryのプロモーター領域であるE-boxに結合し,Per, Cryの転写を促進する.さらに翻訳されたPERとCRYはリン酸化やユビキチン化などの修飾を受け,二量体を形成し,核内でCLOCK:BMAL1の転写促進を抑制する.そして,PER, CRYの発現量が低下すると,CLOCK, BMAL1による転写が再び促進される.このネガティブ・フィードバックループを約1日かけて行うことで,約24時間周期の概日リズムが形成される(図1).このコアループを形成する時計遺伝子以外にもBMAL1, CLOCKはReverbやRor, Dbp, DecのE-box配列に結合し,これらの時計遺伝子の転写を促進する.そして,REVERBやRORはBmal1やClockの転写領域ROREを介して転写を調節し,概日リズムの形成に関与する1–3)(図1).
2)中枢時計と末梢時計
先述したこのシステムは脳や心臓,肝臓,脂肪,筋肉など全身に幅広く存在し,各組織の生理機能の概日リズムを調整している.また,各組織の体内時計はそれぞれの組織でバラバラに時を刻んでいるわけではない.脳の視交叉上核(suprachiasmatic nucleus:SCN)によって全身の統制がとられている.このSCNの体内時計を中枢時計と呼び,それ以外の臓器の時計を末梢時計と呼ぶ.中枢時計からの信号はホルモンや神経因子によって伝達され,末梢組織の時刻が統制される4, 5).
時計遺伝子の発現周期は“約”24時間である.そのため,外界の“ちょうど”24時間周期に合わせる必要がある.つまり,体内時計を微調整し,細胞間や臓器間で時刻合わせ(同調)を行わなければならない.その調整を行うための最も強力な刺激が「光」である.朝に太陽光を浴びると,その刺激は目から視神経を通ってSCNへと伝達され,体内時計の時刻合わせが行われる4, 5).
1)食事による体内時計の調節
SCNに存在する中枢時計は光が主な同調刺激であることを述べたが,肝臓などの末梢時計は中枢時計からの制御以外に,外界因子によっても同調を受けることがある.その主な例が食事である.マウスは活動期である暗期に食餌を多くとるが,食餌をほとんどとらない時刻である明期に摂食させると,肝臓の時計遺伝子のリズムが食餌時刻に同調する.このとき,中枢時計であるSCNの時計遺伝子は影響を受けず,リズムは変化しない.そして,このような末梢臓器の時計遺伝子発現リズムは,SCNを破壊したマウスにおいても形成することができる3, 6).つまり,食事はSCN非依存的にリズムを形成することができる.
2)インスリンシグナルによる体内時計の調節(表1)
表1 糖以外の栄養物質による体内時計調節作用| インスリンシグナル | 摂取物質 | 概日時計への作用経路 |
|---|
| インスリンを介した経路 | 水溶性食物繊維 | 短鎖脂肪酸増加およびGLP-1分泌によるインスリン分泌促進 |
| DHA | GPR120を介したGLP-1分泌によるインスリン分泌促進 |
| EPA |
| L-オルニチン | GLP-1分泌によるインスリン分泌促進 |
| インスリンを介さない経路 | タンパク質 | グルカゴン・IGF-1分泌促進 |
| 水溶性食物繊維 | 短鎖脂肪酸産生増加および交感神経活性 |
| カフェイン | cAMP/Ca2+シグナル活性 |
| ノビレチン | RORα/γの転写活性調節 |
| EGCG | Sirt1-PGC1αループ制御 |
| プロアントシアニジン | Nampt/NAD+を介した時計遺伝子調節 |
| 生薬(猪苓・柴胡) | — |
それでは,なぜ食事によってリズム同調が起こるのだろうか.その要因の一つとしてインスリンがあげられる.絶食させたマウスに食餌を与えることでインスリンが分泌され,それに応じて,一時的に肝臓の時計遺伝子Per2の発現量が増加する.この作用は直接インスリンを投与することでもみられ,さらに,ストレプトゾトシン投与によりインスリン分泌不全を引き起こしたマウスではPer2発現量の増加が弱まることから,インスリンが時計遺伝子調節の重要なトリガーであることが示されている6).このインスリンシグナルによる同調効果の作用経路は以下のとおりである.インスリンシグナルの下流に位置するAKTがBMAL1をリン酸化することでBMAL1の核内への蓄積を抑制する.その結果,CLOCKとの二量体の形成を抑制する.これらの抑制は時計遺伝子群のネガティブ・フィードバックループのリセットとして働き,新たな食餌時刻への同調が始まると考えられている7).また,mTORを介したPERの翻訳促進もインスリンシグナルによる同調に関わっていると考えられている.この翻訳促進は,インスリン刺激によるPerの転写促進よりも早い段階で起こっており,インスリン刺激時に存在していたPerのmRNAの翻訳を促進している8).以上より,インスリンが末梢組織における時計遺伝子の転写・翻訳を調整することで,末梢組織の時計遺伝子の同調が行われていると考えられる.
それではインスリンシグナルが同調刺激のトリガーとなるのであれば,インスリン分泌を促す炭水化物(糖)が末梢時計の位相調節に重要な栄養素になることが考えられる.実際にグルコースやデンプンの投与により肝臓のPer2の位相がシフトすることが示されている6, 9).その一方,インスリンの急激な上昇を抑制するレジスタントスターチ(難消化性デンプン)では,他のデンプンに比べてPer2の位相調節作用は弱くなることも示されている.そのため,たとえば,トウモロコシのデンプンとジャガイモのデンプンを比較すると,インスリン分泌量の多いジャガイモのデンプンの方が,末梢時計の位相調節作用が大きい9).また,食物繊維も幅広く炭水化物に分類されるが,小腸で吸収されることなく,大腸にまで到達する.大腸まで到達した水溶性食物繊維は腸内細菌によって発酵・分解を受け,その代謝物として短鎖脂肪酸(short-chain fatty acid:SCFA)が産生される10).この腸管で産生されたSCFAが末梢時計の位相調節に働くことが知られている.つまり,SCFAが大腸L細胞中のGタンパク質共役受容体41(G protein-coupled receptor 41:GPR41)に結合することで,グルカゴン様ペプチド-1(glucagon-like peptide-1:GLP-1)の血中への分泌を促進する11).GLP-1は脾臓のβ細胞に存在するGLP-1受容体に結合し,インスリン分泌を促進し,時計遺伝子を同調させる12).
また,魚油に含まれているドコサヘキサエン酸(docosahexaenoic acid:DHA)やエイコサペンタエン酸(eicosapentaenoic acid:EPA)といった脂肪酸も体内時計の位相調節作用を持つ.これは,Gタンパク質共役受容体120(G-protein coupled receptor 120:GPR120)からGLP-1の分泌を介してインスリン分泌を促す経路が関与している13).
さらに,L-オルニチンもマウスに投与することで,血中のGLP-1の上昇およびインスリン濃度上昇がみられ,肝臓のPer2の位相シフトを引き起こすことが報告されている14).
3)インスリンシグナル以外による体内時計の調節(表1)
ここまで,インスリン分泌による位相調節作用を述べてきたが,それ以外にも末梢時計の位相調節作用を持つものが報告されている.実際に,タンパク質を与えた場合が報告されている.食餌時間を固定させたマウスに異なるタイミングで糖質のみまたはタンパク質のみの餌を与えたところ,どちらの摂食でもPER2の位相がシフトした.このとき,糖質のみの餌を与えたマウスはインスリン分泌の上昇が確認されたが,タンパク質のみの餌を与えたマウスでは確認されなかった.一方,タンパク質のみの餌を与えたマウスでは血中のインスリン様成長因子-1(Insulin-like growth factor-1:IGF-1)の増加が確認された.IGF-1を投与することによってもPER2の位相前進作用がみられ,その阻害剤の投与でタンパク質摂取によるPER2の位相前進作用が抑制されたことから,IGF-1にも位相調節作用があることを示している.タンパク質に関して,より詳細にアミノ酸での検討を行ったところ,L-システインが強い位相調節作用を持つことが報告されている15).
先述した食物繊維については,インスリン分泌促進を介した経路以外にも,時計遺伝子を同調させるための経路が考えられている.つまり,大腸での発酵・分解を受けて産生されたSCFAが,GPR41を介して交感神経系を活性化させる経路である16, 17).交感神経系の活性化により分泌されるアドレナリン・ノルアドレナリンはPer遺伝子のプロモーターのCREサイトの転写活性を介して時計遺伝子を同調させる18, 19).
また,三大栄養素以外のものとして,カフェインや抗酸化物質としても知られているポリフェノールにも体内時計調節作用があることが報告されている.カフェインはcAMPとCa2+が関与し,Per2の周期延長作用と振幅増強作用を有することが明らかとなっている20).シークワーサーなどの柑橘系植物に含まれているノビレチンは時計遺伝子産物のRORα/γに結合し,その転写活性を調節することで,Per2の振幅増強作用をもたらす21).さらに,ノビレチンの摂取は高脂肪食摂食によって乱れた概日リズムを改善して,肥満を抑制することも報告されている22).緑茶に多く含まれているカテキンの一種であるエピガロカテキンガレート(epigallocatechin gallate:EGCG)は概日時計を制御するSirt1-PGC1αループに作用し,結果的に体内時計を調節することが知られている23).また,カテキンが重合した構造を持ち,赤ワインに豊富に含まれているプロアントシアニジンにも,肝臓や腸のPer2やRev-erbα, Rorαの時計遺伝子発現を調節する作用を有する24).
さらに,一般医薬品や処方薬,健康食品としても販売されている漢方の成分となっている生薬にも概日時計の調整作用を持つものが明らかとなっている.筆者らは114種の生薬から40種を選択し,in vitroとin vivoでスクリーニングを行った.その結果,猪苓(チョレイ)と柴胡(サイコ)に位相調節作用がみられることがわかった25).これらの生薬は,利尿作用や慢性肝炎の治療に使用される生薬であることから,腎臓や肝臓の概日時計調節に役立つ可能性があることを示唆している.
1)中枢時計と末梢時計のずれ
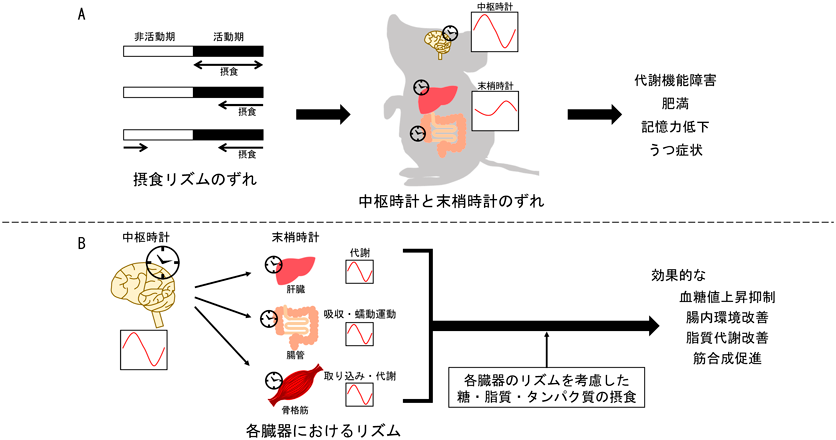
前述したように,食事は肝臓などの末梢時計に対する主要な非光依存的な刺激の一つで,SCNに影響を及ぼさない.そのため,摂取時刻を普段活動しない時間帯にシフトさせると,中枢時計と末梢時計がずれる可能性が考えられる.このずれをマウスおよびヒトで検証した研究がある.マウスの摂食可能時間を12時間に制限し,マウスの活動期である暗期12時間に摂食させた群とその群よりも摂食開始時刻を4時間遅らせた摂食遅延群を用意したところ,SCN依存性である体温リズムには影響を及ぼさなかったが,肝臓の時計遺伝子のピーク時刻が摂食遅延群で後退したことが示された26).また,ヒトにおいて,光のある環境を7時~23時に固定し,食事時刻を7時・12時・17時とした条件と,食事のみを5時間遅らせ,12時・17時・22時とした遅延条件を用意した.すると,SCN依存性のメラトニンとコルチゾールの分泌リズムの位相は変化しなかったが,皮下脂肪の時計遺伝子発現リズムは1~1.5時間ほど後退していることが示されている27).以上より,明暗環境の時刻と食事時刻がずれることで,中枢時計の位相と末梢時計の位相がずれるといえるだろう(図2A).
2)摂食リズムの乱れによる影響
それでは,このように中枢時計と末梢時計がずれると,どのようなことが引き起こされるのだろうか.先述の摂食遅延をさせたマウスの実験では,糖・脂質代謝関連遺伝子の発現リズムが乱れ,体重増加が引き起こされる26).また,ヒトにおいては,朝食欠食によって摂食開始時刻が遅れると,体重増加やインスリン感受性の低下を引き起こす可能性が高くなることが報告されている28–31).つまり,中枢時計と末梢時計のずれは代謝機能障害を引き起こすことが考えられる(図2A).
さらに,マウスやラットにおいて,活動期始め・真ん中・終わりに1日3回の食餌を与え,それぞれ朝食・昼食・夕食と定義した,ヒトの食生活を模した実験が行われている.ラットにおいて1日3食モデルで,1日3食をしっかりと摂食する群をコントロールとし,朝食欠食群と夕食欠食群を用意した.なお,総摂取カロリー量はいずれの群でも等しく,各摂食のカロリー量も均等である.この条件下で肝臓の時計遺伝子発現量を測定すると,コントロールと比較して朝食欠食群においてのみ有意な位相後退が確認され,末梢時計のずれがみられた.このとき,朝食欠食群においてのみ有意な体重増加も確認された32).
摂食リズムが乱れたことによって生じる,中枢時計と末梢時計のずれは代謝機能だけでなく,記憶力やうつ症状などの脳機能にも影響することが報告されている(図2A).たとえば,制限給餌を活動期に行ったマウスと非活動期に行ったマウスを用いて,活動期中の長期記憶機能を調べると,非活動期に制限給餌を行ったマウスでは,長期記憶能力が低くなることが報告されている33).これは記憶をつかさどる海馬の時計遺伝子発現のリズムが非活動期の制限給餌によって乱れるためだと考えられている.また,小学生を対象とした研究では,朝食を学校でとる子供・朝食を家でとる子供・朝食をとらない子供で学業成績を比較したところ,朝食を学校でとる子供が最も成績がよかったことが知られている34).このことからも,中枢時計と末梢時計がずれないように,朝食を生体リズムに合わせて摂取することが脳機能を保つ上で重要であることが示唆されている.さらに,うつ症状に関しては,マウスの非活動期に高脂肪食を摂食させ,末梢時計のリズムを乱して,強制水泳試験を行わせると,無動時間が増え,うつ様行動が亢進することが示されている35).実際に,夜間に摂食を伴う夜食症候群や睡眠関連摂食障害の患者の多くが,うつ症状を示すことや,1週間のうちの朝食欠食の割合が高くなるほど,うつ症状を示す割合も高くなることからも,中枢時計と末梢時計のずれがうつ症状を亢進する可能性を示唆している36, 37).
規則正しい摂食リズムによって,腸内細菌叢の構成にも概日リズムが生まれることが近年報告されている.複数の細菌種が日内変動を示しており,マウスに活動期のみの制限給餌または非活動期のみの制限給餌を行うと,腸内細菌叢の動態はそれぞれ逆のリズムを示すことが報告されている38–40).マウスを用いて,明期開始時刻:暗期開始時刻=6時:18時の明暗条件から,明期開始時刻:暗期開始時刻=22時:10時の明暗条件へと8時間ずらし,3日おきのサイクルで切り替え続け時差ボケモデルを作製し,腸内細菌叢への影響を見た報告がされている.このような時差ボケモデルマウスでは中枢時計も乱れ,摂食リズムも乱れる.その結果,腸内細菌叢の日内変動が消失し,抗肥満と関連するChristensenellaceaeが減少し,大腸がんと関連するFusobacteriaが増加していた.さらに,この時差ボケモデルマウスに高脂肪食を与えると,通常マウスと比較して,体重が増加しやすくなり,血糖値の増加もみられた38).つまり,時差ボケにより日内変動が乱れた腸内細菌叢は,メタボリックシンドロームを引き起こす原因となる可能性が示唆されている.時差ボケと腸内細菌叢の日内変動の乱れに関する報告はヒトでもなされている.8時間以上のフライトをした2人から,フライト1日前,フライト1日後,フライト2週間後と糞便を3回採取し,腸内細菌叢を調べた.すると2人とも,フライト1日前と比較して,フライト1日後では肥満と関連するといわれているFirmicutesが増加していた.しかし,フライト2週間後には元のレベルにまで減少した.また,各ヒト糞便を無菌マウスに移植させると,同様の餌を食べていても,フライト1日後の糞便を移植されたマウスのみ,他の糞便を移植されたマウスと比較して,体重が増加することがわかった38).
以上より,中枢時計と末梢時計がずれるような,摂食リズムの乱れによって代謝機能障害・脳機能障害が引き起こされる可能性が考えられる.そして,近年ではこれらの摂食リズムの乱れによる代謝機能障害は腸内細菌叢が一部関与していることが明らかになりつつある(図2A).
3)制限給餌による代謝改善効果
マウスに通常食を与えると,活動期に主に摂食するリズムがみられるが,高脂肪食を与えると,非活動期にも摂食するようになり,摂食リズムの乱れがみられる.この状態でマウスの末梢時計を調べると,リズムの振幅(メリハリ)が小さくなり,リズムが乱れる41).ここで,高脂肪食の摂食可能な時間帯を活動期に制限すると,上記のリズムの乱れを抑えることが知られている.さらに,高脂肪食摂食による体重増加も,摂食可能な時間を活動期に制限すると,自由摂食と摂取カロリー量に差がないにもかかわらず,体重増加を抑え,脂質代謝異常を改善することも報告されている42).なお,この制限給餌による代謝機能改善効果は時計遺伝子に変異が入ったマウス(Cry1/2ダブルノックアウトマウス,肝臓特異的Bmal1ノックアウトマウスなど)においても確認される42).
この制限給餌による効果はヒトにおいても報告されている.糖尿病患者に対して,摂食可能な時間帯を6時間に制限し,夕食を遅くとも15時までにとるようなスケジュールを5週間続けてもらうと,インスリン感受性・血圧・酸化ストレスを改善することが報告されている43).また,高強度な運動をしている男性に対して,1日3食を12時間で摂食するグループ(8時,13時,20時)と7時間で摂食する制限給餌グループ(13時,16時,20時)を比較すると,7時間で摂食した制限給餌グループにおいて脂肪量減少,血中グルコース濃度,血中インスリン濃度の低下が確認されている44).
一方で,これらの制限給餌による効果については体重減少などに影響しないという報告もあげられている.たとえば,先述と同様にラットに明期12時間の制限給餌と暗期12時間の制限給餌をさせ,自由摂食と体重増加を比較したところ,体重に影響を及ぼさないことが報告された45, 46).この異なる結果が得られた詳細な理由はわからないが,制限給餌の給餌時間,摂食期間,餌の組成などさまざまな要因が考えられる.特に,高脂肪食の制限給餌を8時間以内にすることで,体重増加抑制に効果的であることも報告されている44).いずれにせよ,制限給餌による効果は,今後もさらに検討される必要があるだろう.
1)摂取タイミングをなぜ考えるべきか
体内時計によってさまざまな生理機能に1周期約24時間の概日リズムを形成することを踏まえると,食物の消化・吸収・代謝機能にも概日リズムが存在することが考えられるだろう.実際にトランスクリプトーム解析やメタボローム解析によって,これらの機能に概日リズムが存在することが報告されている47, 48).近年ではヒトにおいても,血液や組織サンプルを用いて同様の検討がなされている.これらの食物の消化・吸収・代謝機能に概日リズムが存在するのなら,食事内容のみならず,食事を摂取する時間も重要な要因となり,「“何”を“いつ”食べるか」という,時間軸に対する議論が必要になる.たとえば,等量の糖質を朝に摂取した場合と夕に摂取した場合で,血糖値の変動が異なるかどうかなどである.
2)朝食と夕食
我々はマウスを用いて,高脂肪食を1日の総摂食量が等しくなるように,朝食のみ摂食させる群,夕食のみ摂食させる群,朝食:夕食=3:1の割合で摂食させる群,朝食:夕食=1:3の割合で摂食させる群を用意し,体重増加を比較した.すると,朝食にウェイトをおいた群の方が体重増加の抑制がみられた49).さらに,ヒトを対象とした研究でも,肥満女性に対して,朝食にウェイトをおいた食事を摂取することで,肥満が解消されるという報告がある50).これらの朝食摂食と夕食摂食の差も,消化・吸収・代謝機能に日内変動があるためだろう.それでは,以下から食物の中でも三大栄養素である炭水化物・タンパク質・脂質を中心として,それぞれの消化・吸収・代謝機能の日内リズムや時計遺伝子との関わり,また,それらを踏まえて“いつ”食べるべきかについて述べていく.
3)糖代謝の日内リズムと糖の摂取タイミング
糖の吸収に関わる腸管のトランスポーターSglt1, Glut2, Glut5の発現量や糖代謝関連遺伝子が,非活動期の終わりから活動期の始めにかけて高くなる日内リズムを示すことが知られている51).そのため,インスリンの分泌能も活動期の始めに高くなることが示されている.これを実際にヒトでも検証したところ,夜よりも朝において耐糖能が高いことが報告されている52).つまり,同じ食事を朝と夜にとると,食後の血糖値は夜の方が高くなる.先述した腸管のトランスポーター遺伝子のプロモーター領域にはBMAL1が結合するため,これらのトランスポーターの発現変動は時計遺伝子の制御下にあるといえる53).実際に,食餌時間を非活動期に制限することで,腸管トランスポーターの発現リズムは通常とは逆のリズムを示す.
また,骨格筋は血糖を利用する最大の末梢臓器といえるが,この骨格筋における糖の取り込み・代謝にも日内リズムが知られている54).時計遺伝子欠損マウスやSCNを破壊したラットでは,この日内リズムが消失することからも,骨格筋の糖取り込み・代謝は体内時計を介した作用であると考えられる.さらに,骨格筋特異的なBmal1欠損マウスにおいて,骨格筋の糖取り込みやインスリン分泌に日内変動がみられなくなることから,各組織の時計遺伝子が糖代謝の日内リズムを制御することも考えられる55, 56).また,マウス骨格筋における糖代謝関連遺伝子をトランスクリプトーム解析で調べたところ,活動期が始まる前に遺伝子発現が高まることが示されている57).
4)食物繊維の摂取タイミングとSCFA作用の日内リズム
糖とは分類が異なるが,食物繊維は幅広く炭水化物に分類され,腸内環境を整えることが知られている.食物繊維は小腸において消化・吸収されにくいため,先述した腸管のトランスポーターの遺伝子発現リズムによる影響を受けにくい.しかしながら,腸管の特に上皮層において時計遺伝子が多く発現しており,蠕動運動の日内リズムを制御すると考えられている58).実際にヒトにおいて,蠕動運動が覚醒時に亢進し,睡眠前に低下することが報告されている59).そのため,食物繊維も摂取タイミングにより腸内環境に与える影響が異なることが考えられる.実際に筆者らは,マウスを用いて,1日2食モデル(朝食と夕食)を用意し,朝食に水溶性食物繊維を摂食させる群と夕食に摂食させる群で,腸内細菌叢の構成を調べた.すると,夕食よりも朝食に水溶性食物繊維を摂食させることで,腸内細菌叢の構成が大きく変化することを示した60).しかし,この研究の摂食モデルでは,朝食摂食までの絶食時間と夕食摂食までの絶食時間が異なっていた.蠕動運動は食物が胃に入り,胃壁が刺激されることで発生し,この反応は絶食時間が長いほど大きくなることが知られている61).つまり,朝食摂食までの絶食時間が長かったために,朝食摂食による腸内細菌叢の構成変化が大きいと考えられた.このように摂食タイミングを議論する際には,日内リズムのみならず絶食時間も考慮に入れる必要があるだろう.
食物繊維が腸内細菌叢によって発酵・分解されると,SCFAが産生される.このSCFAは腸管上皮細胞中のモノカルボン酸トランスポーター1(monocarboxylate transporter 1:MCT1)によって血中へと輸送され,肝臓や脂肪組織に作用し,エネルギー代謝を調節する.ここで腸管におけるMCT1にも発現リズムが存在することが知られている.ラットの空腸粘膜を3時間おきに24時間採取し,遺伝子発現を測定すると,非活動期始めに発現量が高くなるリズムが示された62).また,ヒトにおいて,朝食後,昼食後,夕食後,それぞれの血中の短鎖脂肪酸濃度を測定すると,昼食後に濃度が高くなることが報告されている63).
5)脂質代謝の日内リズムと脂質の摂取タイミング
ヒトにおいてもマウスにおいても,肝臓でのコレステロール合成や血中のトリグリセリド濃度,遊離脂肪酸濃度には日内リズムが存在することが確認されている51, 52).そして,各脂質代謝関連の遺伝子が肝臓・骨格筋・脂肪組織において日内リズムを示し,時計遺伝子欠損マウスでは消失することから,これらの日内リズムは時計遺伝子を介した発現制御が行われていると考えられる51, 52).
マウスの肝臓・腎臓において,脂質代謝調節因子であるペルオキシソーム増殖剤活性化受容体(peroxisome proliferator activated receptor:PPAR)は日内変動を示すことが知られているが,これは時計遺伝子によって直接的に制御されている.つまり,Pparα遺伝子上流のE-box配列にはCLOCK:BMAL1の二量体が結合し,発現調節を行っている.そのため,Bmal1ノックアウトマウスやClock変異マウスではPparαの発現変動は観察されなくなる64).一方で,PPARαはペルオキシソーム増殖因子応答配列(peroxisome proliferator response element:PPRE)を介してBmal1の発現制御を行うことが知られている65, 66).つまり,PPARα自身も時計遺伝子発現を制御するのである.
ヒトにおいても脂質代謝の日内リズムが報告されており,健康な男性を対象に1日5回の筋生検を行った研究では,ミトコンドリアにおける脂質代謝は23時前にピークを示すことが報告されている67).また,肥満女性を対象にした研究では骨格筋における脂肪酸酸化関連遺伝子は夕方に低下し,脂肪酸合成関連遺伝子は夕方に増加することが知られている68).
脂質の摂取タイミングに関しては,魚油についてマウスを用いた研究が報告されている.魚油に含まれているDHA, EPAには心血管障害の抑制効果や抗アレルギー効果,脳機能向上効果,脂質代謝改善効果などの機能性が知られているが,このうち,脂質代謝改善効果に対して摂取タイミングによる効果の違いが検証されている.高フルクトース食を負荷させ脂質代謝異常にさせたマウスに対して,朝食と夕食の1日2食の条件下で飼育させ,朝食にのみ魚油を摂取させる群と夕食にのみ魚油を摂取させる群を用意した.すると,朝食に魚油を摂取した群においてのみ,肝臓中性脂肪やコレステロールの改善がみられた.また,血中のDHAやEPA濃度は夕食に魚油を摂取した群よりも朝食に摂取した群の方が高いことから,朝食の魚油摂取による脂質異常改善効果は,朝食において脂溶性物質のDHA・EPAをより吸収したためであると考えられている69).
さらに近年では,ゴマに含まれている希少な脂溶性のセサミンが持つ抗コレステロール作用は夕方摂取よりも朝食摂取において効果的であることが報告されている70).
6)タンパク質の摂取タイミング
摂取したタンパク質は消化管内でペプチド,アミノ酸へと分解を受けるが,この分解されたペプチドやアミノ酸のトランスポーターに日内リズムが存在する51).ペプチドトランスポーター1(peptide transporter 1:PEPT1)は,ラットにおいて活動期開始時に発現レベルのピークが来るような日内リズムを示す.さらに,時間制限給餌により,非活動期のみの摂食を行わせると,PEPT1の発現レベルは逆位相になる.これは,摂食前にPEPT1の発現量を上げることによって,ペプチドの吸収能を高めていることを示唆している71).このPEPT1の発現リズムは時計遺伝子産物DBPの制御によるものであると考えられている.つまり,Pept1のプロモーター領域にDBPが結合することでPept1の発現リズムが調節されていると考えられている72).
一方で,アミノ酸代謝について,ヒトを対象として,朝食と夕食に同様の食事をとってもらい,食後の血液を採取し,メタボローム解析を行うと,同様の食事内容であるにもかかわらず,アミノ酸やその代謝物のプロファイルが朝食摂食と夕食摂食で異なることが報告されている73).以上のようにペプチド吸収,アミノ酸代謝に日内変動があることから,タンパク質やアミノ酸の摂取タイミングによって生理応答が異なる可能性が考えられる.
実際に,タンパク質の摂取タイミングによって骨格筋の持つ機能性が異なることが知られている.ラットにおいて,1日3食の摂食モデルを用意し,1日の総タンパク質摂取量は等しくした上で,3食均等にタンパク質を摂食させる群と,夕食に多くタンパク質を摂食させるように偏りを持たせた群で筋合成能を比較すると,3食均等にタンパク質を摂食することで,筋合成能が高くなり,骨格筋重量も増加することが報告されている74).このようなタンパク質の比率を各食事で変化させた検証はヒトでもなされている.健常男性を対象に,タンパク質を1日3食均等に摂食させるグループと,朝食に少なく,夕食に多くタンパク質を摂食させるように偏らせたグループで筋合成を比較したところ,均等に摂食させたグループで,筋合成が高まることが示されている75).日本人やアメリカ人を対象にした調査研究では,どちらの国においても,1日のタンパク質摂取量は朝食に少なく,夕食にかけて多くなる傾向があることが報告されている76, 77).そのため,骨格筋機能維持のためには,朝食に多くタンパク質を摂取することが重要であると考えられる.近年では,タンパク質源がカゼインタンパク質であるか,ホエイタンパク質であるか,大豆タンパク質であるかによって筋肥大効果が異なることが知られている78).この肥大効果が異なる詳細な理由は不明だが,ペプチドトランスポーターやアミノ酸トランスポーターが関与しているなら,各タンパク質の摂取タイミングを検討し,“どの”タンパク質を“いつ”とることが筋肥大・筋萎縮予防に効果的であるかを探索することができるかもしれない.