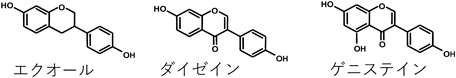
大豆に含まれるフラボノイドの一種であるイソフラボン(図1)は,構造の類似性からエストロゲン様の作用(活性としては1000分の1以下)を有することがその大きな特徴の一つで,がんや心疾患の予防,脂質代謝改善,骨代謝などの効果が報告されている1).一般に,女性ホルモンのエストロゲン(17β-estradiol:17β-E2)の作用は,細胞の核内に分布するエストロゲン受容体(estrogen receptor α:ERαおよびERβ)に結合し,その複合体が標的遺伝子のプロモーター領域に結合してその遺伝子の発現調節を行う.しかしながら,核内以外に細胞膜にもその受容体が存在し,17β-E2の即時的応答(数秒から数分)に対応した,従来とは異なる経路の存在が明らかにされている2).その細胞膜受容体として,ERαやERβの他に,別の細胞膜エストロゲン受容体が存在することが示唆されている.植物性エストロゲンとして知られているレスベラトロールの,カテコールアミン(catecholamine:CA)生合成・分泌に対する効果にも細胞膜エストロゲン受容体が関与することが示されている3, 4).ダイゼイン,17β-E2はそれぞれ副腎髄質細胞においてチロシンからのCA生合成を促進するが,これらの作用は核内エストロゲン受容体阻害剤によって抑制されなかった.一方,高濃度のダイゼインはアセチルコリンによるCA分泌や生合成促進作用を抑制した.副腎髄質より分離した細胞膜には17β-E2に対して少なくとも二つの結合部位(高親和性と低親和性)が存在することが示され,高親和性の17β-E2結合はダイゼインにより抑制された5).以上の結果から,ダイゼインは細胞膜エストロゲン受容体を介してCA生合成を促進し,高濃度では逆にアセチルコリン刺激によるCA分泌や生合成を抑制することが明らかとなった.
大豆イソフラボンの生体調節作用に,ダイゼインの腸内細菌代謝物であるエクオール(図1)が関与していることが知られている.マウスやラットではほとんどの個体でエクオールは産生されるが,ヒトにおいては日本人の50%程度,欧米人では20%程度しか産生できず,エクオール産生者は非産生者との比較において,前立腺がんや乳がんの罹患率が低いこと6)や骨量減少抑制作用が強いことが報告されている7).エクオールはダイゼインよりもエストロゲン活性が強く,その生理作用の発現機序はダイゼインと同様にエストロゲン受容体に対するアゴニストやアンタゴニストとしての作用と考えられている.
一方,ダイゼインの好塩基球における高親和性IgE受容体発現低下作用8)や胸腺萎縮作用9)においては,エストロゲン受容体を介さない作用経路の存在が示されている.
緑茶(Camellia sinensis)は紀元前の中国で発見されたとされ,唐時代には薬として利用されていたとする文献が存在する.鎌倉時代の栄西禅師は「喫茶養生記」において,“茶は養生の仙薬なり.延齢の妙術なり”,と記している.このように茶は古くから薬として活用されていたが,現代では,体脂肪低減作用,コレステロール低下作用,血圧降下作用,脳卒中予防作用,抗アレルギー作用などの生理作用が緑茶にあることが明らかにされた.また,こうした緑茶の生体調節作用を担う成分を詳らかにするための研究が盛んに行われ,緑茶の主要な成分である緑茶ポリフェノールが注目されることとなった.
EGCG, (−)-エピカテキンガレート,(−)-エピガロカテキン,(−)-エピカテキンなどのカテキン類が主要な緑茶ポリフェノールである.特にEGCGは乾燥茶葉重量の5~15%を占め,緑茶に特有な成分であるのに加え,前立腺がんの予防作用14)やメチル化EGCGを多く含む緑茶の抗アレルギー作用15)が明らかとなるなど,緑茶の生理作用にEGCGが深く関係していると考えられている.ストリクチニンは乾燥茶葉に0.2~0.7%程度含まれるポリフェノールであるが,IL-4Rα鎖に結合してIL-4の作用を阻害することでIgE産生を阻害する16).
1)EGCGセンサーとしての67-kDaラミニン受容体
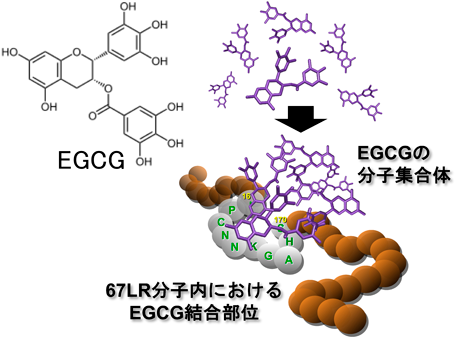
EGCGの機能性発現メカニズムを理解する上で,EGCGが生体内で直接相互作用(結合)する分子を知ることはきわめて重要である.(−)-エピカテキンおよび(−)-エピガロカテキンは血中では主に包合体化されているが,EGCGは70%以上が遊離体の形で存在する.EGCG摂取後の血中濃度は1.5~2.5時間後にピークに達し,その後24時間後には消失するが,血中濃度の最大は1 μM程度である.これまでEGCGの生体内における標的分子として,多数の細胞内タンパク質が報告されているが17),多くの場合,血中最大濃度から大きくかけ離れた量(10~100 μM)のEGCGを使用して得られた結果であった.筆者らはこうした点をふまえ,生理的濃度のEGCGの活性発現に関与する標的分子を探索した結果,EGCGのがん細胞増殖抑制作用を仲介する細胞膜受容体として67-kDaラミニン受容体(67LR)を見いだした18).これまでに,EGCGの抗アレルギー作用19, 20),抗炎症作用21–24),動脈硬化予防作用25),抗がん作用26–31)などに67LRが関与していることが報告されている.67LRは基底膜の主要な構成成分であるラミニンに結合する細胞膜タンパク質として同定されていた分子であり,悪性度の高いがん細胞に高発現し,その増殖,浸潤,転移などに関与することが知られている.その他にも病原性プリオンタンパク質の受容体としての機能や,シンドビスウイルス,デングウイルスといったウイルスの受容体として機能することが報告されている32).アシル化された37 kDaの前駆体が67 kDaの二量体を形成し,67LR分子として細胞膜上の脂質ラフトに局在している33).血管内皮細胞,T細胞,マクロファージなどさまざまな細胞において発現しているが,その機能についてはいまだ不明な点が多い.
緑茶にはカテキン以外にもカフェインなどの生理活性物質が含まれているが,67LRはEGCG以外の緑茶成分[(−)-エピカテキン,(−)-エピガロカテキン,カフェイン,ケルセチン]とは結合せず,それらの機能性にも関与していない18).筆者らは,細胞表面に発現する67LR分子上におけるEGCGの集合体形成がEGCGの機能性発現に重要なファーストステップであることを見いだした(図3)34).EGCGが67LRに結合した後の細胞内に生じるイベントは以下に述べるように細胞ごとに異なる.
2)EGCGの67LR依存的な抗がん作用
EGCGを主成分とするカテキン製剤ポリフェノンEのヒト前立腺がん予防作用が報告されるなど14),EGCGの抗がん予防作用は特に注目されている.メラノーマを移植したマウスにおけるEGCGの腫瘍成長抑制作用が67LRの発現を抑制した腫瘍では観察されないなど,67LRは生体内におけるEGCGの抗がん作用を仲介するセンサーとして機能する27).ポリフェノンEの作用に67LRを介した免疫増強作用が関与35)することや,がん細胞表面に高発現する67LRにEGCGが特異的に結合する性質を利用することでがん細胞にEGCG–抗がん剤複合体を集積させて殺傷するドラッグデリバリーシステムも考案されている36).
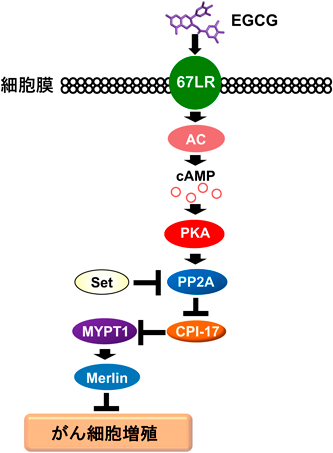
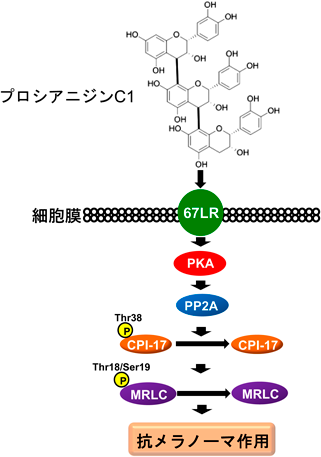
EGCGはメラノーマ細胞に対して67LR/アデニル酸シクラーゼ(adenylate cyclase:AC)/cAMP/プロテインキナーゼA(protein kinase A:PKA)/プロテインホスファターゼ2A(protein phosphatase 2A:PP2A)/C-kinase potentiated protein phosphatase-1 inhibitor protein of 17 kDa(CPI17)経路を介してミオシンホスファターゼを活性化することで増殖を抑制する29).活性化されたミオシンホスファターゼは,がん抑制因子として知られるMerlinを活性化する(図4).メラノーマ細胞ではPP2Aの阻害因子であるSu(var)3–9 enhancer-of-zeste trithorax(SET)が高発現しており,SETの発現抑制はEGCGの抗メラノーマ作用を増強する30).また,EGCGによって誘導されるPP2A/Merlin活性化経路はp70S6Kを阻害し,BRAF阻害剤との併用はBRAF耐性メラノーマに対して顕著な腫瘍抑制作用を示す29).
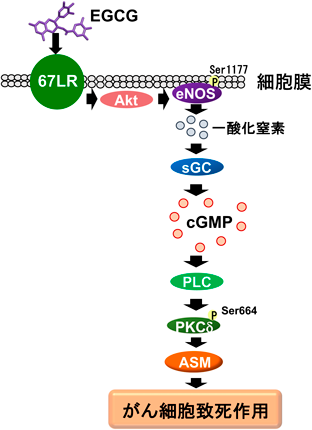
多発性骨髄腫細胞には67LRが正常リンパ球と比較して高発現しており,EGCGは多発性骨髄腫細胞選択的にアポトーシスを誘導する26, 28).この多発性骨髄腫に対するEGCGのアポトーシス誘導作用において,67LR/Akt/内皮型一酸化窒素合成酵素(endothelial nitric oxide synthase:eNOS)/NO産生/可溶性グアニル酸シクラーゼ(soluble guanylate cyclase:sGC)/cGMP/ホスホリパーゼC(phospholipase C:PLC)/プロテインキナーゼCδ(protein kinase Cδ:PKCδ)/酸性スフィンゴミエリナーゼ(acidic sphingomyelinase:ASM)経路の活性化が重要な役割を果たしている(図5)28–31, 37).EGCGによる本経路の活性化後の細胞内イベントとして注目すべき点は,細胞膜におけるセラミド量の増加と脂質ラフトの撹乱である30).ASMによって産生されるセラミド量を下方制御するスフィンゴシンキナーゼ(sphingosine kinase 1:SphK1)が多発性骨髄腫や慢性リンパ性白血病において高発現しており,SphK1の阻害はこれらのがん細胞に対するEGCGの致死作用を増強する30).一方,多くのがん細胞においてcGMP分解酵素の一種であるホスホジエステラーゼ5(phosphodiesterase 5:PDE5)が高発現しており,PDE5阻害薬剤はEGCGのがん細胞致死活性を顕著に増強する28).また,cGMP分解酵素の一種であるPDE3の阻害剤とEGCGの併用は,膵臓がん幹細胞形質の発現を強力に阻害するとともに,その肝転移を抑制する31).
3)EGCGの67LR依存的な抗アレルギー作用
EGCGのメチル化体であるEGCG3″Meを含有するべにふうき緑茶の花粉症患者に対する介入試験では,やぶきた緑茶(メチル化カテキンを含まない)をコントロールとして飲用している群に比べ症状スコアの改善が認められている15).こうした結果をふまえ,メチル化カテキンを機能性関与成分としたべにふうき緑茶飲料やリーフティーが免疫機能調節作用を訴求した機能性表示食品として上市されている.EGCGやメチル化カテキンは,好塩基球の細胞表面に存在する67LRへの結合を介してアレルギー発症因子であるヒスタミンの放出阻害作用19)を示すとともに高親和性IgE受容体FcεRIの発現を低下させる20).
4)EGCGの67LR依存的な抗炎症作用
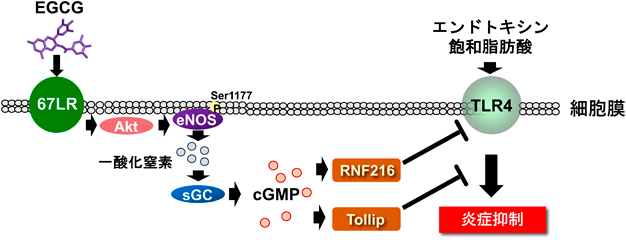
EGCGはマクロファージのリポポリサッカライドやペプチドグリカンに対する炎症反応を抑制する.この抑制作用にはTLR2やTLR4に依存した炎症応答を阻害するTollip21–23)ならびにTLR4を標的とするユビキチンリガーゼRNF216の発現誘導作用24)が関与している.EGCGによるこれら遺伝子の発現誘導も67LR依存的な作用である(図6).こうした抗炎症作用はEGCGの脂質代謝異常抑制作用に寄与していることが示唆されている24).脂肪組織における慢性炎症が関与する肥満の抑制作用はEGCGの注目されている機能性の一つである.筆者らは最近,マクロファージを含む骨髄細胞特異的67LRノックアウトマウスを作製し,EGCGの抗肥満作用における67LRの関与を検討した.その結果,高脂肪高ショ糖食によって誘導される肥満やマクロファージの脂肪組織への浸潤に対するEGCGの抑制作用が67LR依存的であることを明らかにした.動脈硬化発症要因の一つである血管内皮における炎症の抑制作用にも67LRの関与が示唆されている25).
5)EGCGの67LR依存的なマイクロRNA発現調節作用
マイクロRNAは標的遺伝子の発現を制御することで多岐にわたる生命現象に関与している.EGCGはメラノーマ細胞において67LR依存的に多くのマイクロRNAの発現量を調節している38).EGCGによって発現量が増加するマイクロRNAの一つであるlet-7bは,メラノーマにおいて発現が異常に低下していることや,強制発現させるとメラノーマ細胞の転移が抑制されることが報告されている.メラノーマを肺転移させたマウスにEGCGを投与すると転移腫瘍におけるlet-7bの発現量が増加した38).let-7bはがん遺伝子として知られているHMGA2の発現を低下させるが,EGCGを作用させたメラノーマ細胞ではHMGA2のタンパク質発現量が減少し,let-7b阻害剤はこうした発現低下作用を消失させた.Let-7bはHMGA2の他にもMycやRasなどがん細胞の細胞増殖に関わる遺伝子を標的としているため,EGCGはlet-7bの発現調節を介してがん細胞の増殖シグナル経路に影響を与えることが考えられる.前述したように,EGCGはメラノーマに対して67LRを介してPKAを活性化させ,その下流のPP2Aを活性化させるが,EGCGのlet-7b発現増加作用にも67LR/PKA/PP2A経路が関与している(図4)38).