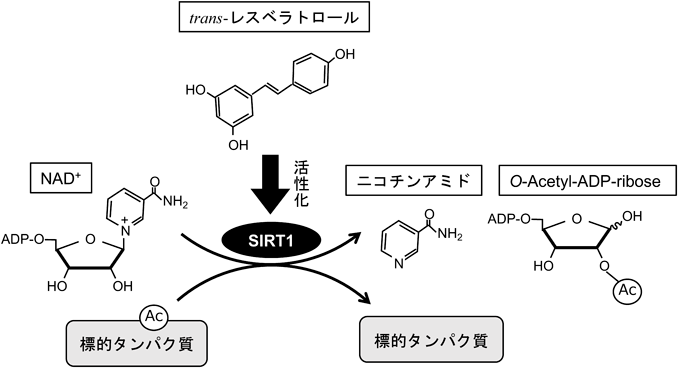
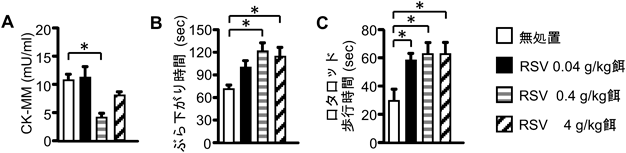
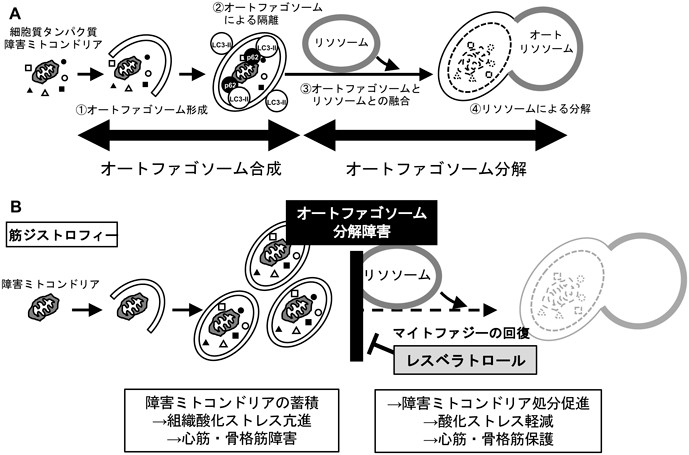
レスベラトロールの生体作用とその標的SIRT1Cellular effects of resveratrol in health and disease: Roles of SIRT1
札幌医科大学医学部薬理学講座Department of Pharmacology, Sapporo Medical University, School of Medicine ◇ 〒060–8556 北海道札幌市中央区南1条西17丁目 ◇ S-1, W-17, Chuo-ku, Sapporo, Hokkaido 060–8556, Japan