ウサギ白血球を用いた不飽和脂肪酸の代謝実験において,アラキドン酸(all-cis-5,8,11,14-eicosatetraenoic acid)の5位炭素が酸化されることが見いだされた.非ステロイド性消炎鎮痛薬(NSAID)であるインドメタシンがこの代謝を抑制しなかったため,プロスタグランジン(PG)とは異なるアラキドン酸の新しい代謝経路として1976年に報告された3)のが,LTに関する世界で最初の報告である.その後,5(S), 12(R)-dihydroxy-6,14-cis-8,10-trans-eicosatetraenoic acid(LTB4),5(S), 12(S)-diHETEなどの構造4, 5)や,不安定な中間体であるLTA4の構造6)が決定された.また,白血球をカルシウムイオノフォアであるA23187で刺激するとこれらの反応が促進されることも報告され7),翌1980年にはLTB4が強力な好中球の走化性因子であることが報告された8).さらに同年,モルモット腸管を収縮させるslow-reacting substance(SRS)の構造が決定され,システインを含有するロイコトリエン(LTC4)であることがわかった9).これらの研究は主としてスウェーデンのカロリンスカ研究所で行われ,研究の中心となったBengt Samuelssonは,師のSune Bergström,アスピリンの作用機序を解明したイギリスのJohn Vaneとともに,1982年にノーベル生理学・医学賞を受賞した.
LTの産生は,リン脂質の2位にエステル結合しているアラキドン酸がホスホリパーゼA2(PLA2)によって切り出されることから始まる.PLA2にはさまざまな分子種が存在するが,多くの細胞でLT産生の引き金になるアラキドン酸遊離に重要なのは細胞質型のcPLA2α(Pla2g4a)と考えられている.事実,cPLA2α欠損マスト細胞ではマスト細胞のFcεRI受容体の架橋によるLT産生が完全に消失する10).しかしながら近年,村上誠(東大医学部)らの研究により,cPLA2αに加えてsPLA2と呼ばれる細胞外型のPLA2もまた,アラキドン酸をはじめとした高度不飽和脂肪酸の遊離と下流のメディエーター産生に重要な役割を果たしていることが明らかになりつつある11).切り出されたアラキドン酸にシクロオキシゲナーゼ(COX)が作用すると,プロスタグランジンの前駆体であるPGH2が産生されるが,5-LOXの作用で5位炭素が酸化されると,5-HPETEを経てLTの前駆体LTA4が産生される12, 13).Zileutonは5-LOXを阻害しLT産生を抑制するため,北米で気管支喘息の治療薬として使用されている.5-LOXによるアラキドン酸の酸化には,5-LOX活性化タンパク質(FLAP)と呼ばれる膜タンパク質14)が必要であり,FLAPの阻害剤もまたロイコトリエン産生を完全に阻害する.FLAPはアラキドン酸を5-LOXに提示する役割を持つと考えられているが,実態は不明である.LTA4は生物活性を有さない不安定なLT前駆体であると考えられており,LTA4水解酵素(LTA4 hydrolase)によって水分子が付加されるとLTB4が,グルタチオン転移酵素であるLTC4合成酵素によってグルタチオンが付加されるとLTC4が生じる.こうした酵素が存在しない状況では,LTA4は短時間の間に非酵素的な加水反応を受け,6-trans-LTB4や6-trans-12-epi-LTB4が生じるが,これらのLTB4類似物質のLTB4受容体への結合能はきわめて低く,生物学的な活性はほとんどない.LTB4の6番目の炭素間二重結合はcisであり,これがtransになると分子の構造が大きく変化してしまい,LTB4受容体BLT1に認識されなくなるものと考えられる.5-LOXやFLAPの発現が,好中球,好酸球をはじめとした白血球系の細胞に限局している一方で,LTA4水解酵素は白血球以外の細胞にも広く発現している.LTB4産生酵素をすべて発現している細胞でLTB4が産生されるのは当然であるが,多数の白血球が浸潤している炎症部位では,白血球で産生されたLTA4が,隣接するLTA4水解酵素を発現する非白血球細胞に取り込まれることで,白血球以外の細胞でも大量のLTB4が産生されるとする説(transcellular LTB4 biosynthesis)15)が提唱され,現在では広く受け入れられている.LTA4水解酵素には,LTB4産生活性に加えてアミノペプチダーゼ活性が存在する.このアミノペプチダーゼ活性の生物学的意義の解明は始まったばかりであるが,1)炎症性ペプチドPGPを加水分解することで抗炎症作用を発揮する16),2)ノルアドレナリンや甲状腺ホルモンの分泌を抑えることで,脂肪燃焼を抑制する17),という二つの報告がある.LTB4はMRP4(ABCC4)18)を含めたいくつかの輸送体,LTC4はグルタチオンを認識するMRP1(ABCC1)輸送体19)を介して細胞外に放出され,標的臓器に到達してそれぞれの特異的受容体に結合し,生理作用を発揮する.LTC4はさらに,細胞外のペプチダーゼによってグルタチオンのアミノ酸を一つずつ失い,LTD4やLTE4に変換される.本稿では詳細な解説は行わないが,LTC4やLTD4の受容体としてCysLT1, CysLT2が,LTE4の受容体としてP2Y1220, 21),GPR9922, 23),GPR1724–26)が報告されている.これらの受容体に関しては,別の総説27–29)を参照されたい.
LTB4はnMという低濃度で強力な生理活性を発揮するため,その不活性化経路も重要な研究対象とされてきた.LTB4は脂肪酸であり,ω酸化の基質となる.好中球や肝細胞に発現するチトクロームP450酵素CYP4F3Aによって,LTB4はω酸化を受けて20-hydroxy-LTB4に変換され30–32),さらにアルデヒド脱水素酵素によって20-carboxy-LTB4に変換され不活性化される33).また,私は大学院時代の研究テーマとしてω酸化とは異なるLTB4の不活性化経路の探索を行い,12位の水酸基がケト基に変換されることでLTB4の生物活性が大きく減弱することを見いだした34).本酵素を精製・クローニング34, 35)し,LTB4 12-水酸基脱水素酵素と命名したが,その後,本酵素はPGや他のアラキドン酸由来の不飽和脂肪酸の13位の二重結合を還元して不活性化する酵素である36, 37)こともわかり,現在ではエイコサノイド還元酵素とも呼ばれている.
5. 高親和性LTB4受容体BLT1の構造とシグナル伝達
1)BLT1の構造と共役するGタンパク質
過去の薬理学的な報告どおり,BLT1は細胞膜を7回貫通すると推定されるGPCRで,ロドプシンタイプ(class-A)のGPCRで保存されているアミノ酸モチーフ45)をほぼすべて有していた.ヒトBLT1は352個のアミノ酸からなる比較的小型のGPCRで,PG受容体との相同性は低く,ソマトスタチン受容体(SSTR3, 5),IL-8受容体(CXCR8),ホルミルペプチド受容体(FPR, FPR2=ALX)などと弱い相同性を有していた.アミノ酸配列を元に進化系統樹を作成すると,BLT1は補体C3やC5,あるいはケモカインなどの走化性受容体とともに進化してきた受容体であることが推定された46).ヒト臓器のノザンブロット解析では,白血球で高い発現,脾臓で弱い発現を認めた.BLT1を一過性に発現させたCos-7細胞やHEK293細胞の細胞膜画分は,LTB4に対してKd値0.15~1 nMの高い親和性を示し,これは好中球分化させたHL-60やヒト好中球の細胞膜のLTB4結合特性と同等であった.CHO細胞に過剰発現してシグナル伝達を観察すると,百日咳毒素(PTX)感受性のGiタンパク質を介したアデニル酸シクラーゼの抑制と,強力な細胞走化性が観察された.一方,LTB4依存性のカルシウム上昇作用はPTXによって部分的にしか抑制されなかったことから,GqファミリーのGタンパク質にも共役しうることが推定された43).のちに行った詳細な解析によって,BLT1は細胞内ループ1~3を介してGαiとGα16タンパク質に共役することが明らかとなった47).
2)BLT1のシグナル伝達:貪食,内在化,リン酸化とヘリックス8
細胞走化性とともに古くから知られているLTB4の機能として,好中球やマクロファージの貪食の亢進が上げられる.我々は,マクロファージがFcγ受容体を介して,オプソニン化された異物を貪食するシグナル伝達経路におけるBLT1シグナルの解析を行った.その結果,BLT1がGiタンパク質の活性化を介して,Fcγ受容体の架橋で生じる小分子量Gタンパク質Racと,PI3-OHキナーゼの活性化を増強することで異物貪食を促進すること,BLT1拮抗薬がマクロファージの貪食を抑制することを明らかにした48).多くのGPCRは,活性化に伴いC末端にリン酸化を受け,アレスチン依存性にインターナリゼーション(内在化)する.刺激が弱い場合,GPCRはリサイクルされ細胞膜に戻るが,強い刺激が長時間持続するとGPCRはリソソームでタンパク質分解を受け,恒常的に不活性化されると考えられている.BLT1はLTB4刺激によってリン酸化されるものの,他の受容体と比較して弱いインターナリゼーションしか示さないという特徴がある49, 50)が,その理由は不明であった.2000年に光感受性GPCRであるロドプシンの結晶構造が解明され,膜貫通ドメインを構成する七つのαヘリックスに加え,細胞膜に平行する形で存在する八つ目のαヘリックス(ヘリックス8)の存在が明らかとなった51).ヘリックス8が細胞膜に接する部分には疎水性のアミノ酸が配置しており,この部分を介して細胞膜に接していることが推定された.我々は機能が不明であったヘリックス8の役割を,BLT1をモデル受容体として解明しようと考えた.GPCRはリガンド刺激を細胞内に伝達し,共役するGタンパク質αサブユニットに結合していたGDPをGTPに交換する.GDP結合αサブユニットはGPCRを高親和性に保つが,GTP結合αサブユニットはGPCRを低親和性に変化させる.BLT1のヘリックス8が細胞膜に接する部分に存在する疎水性アミノ酸である二つのロイシンをアラニンに変化させた変異型BLT1(BLT1LLAA)では,LTB4結合による低親和性受容体への変化が生じないことがわかり,BLT1のヘリックス8が過剰なBLT1の活性化を抑えていることがわかった52, 53).さらに,このBLT1LLAA受容体では,LTB4によるインターナリゼーションが観察されたことから,BLT1のヘリックス8は受容体の内在化を抑制していることもわかった54).
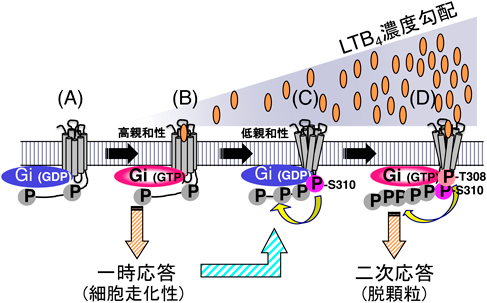
BLT1のC末端領域には他のGPCRと比較してセリン・トレオニン残基が多く存在し,そのほとんどがリン酸化されると考えられたが,それぞれのアミノ酸残基のリン酸化の意義は不明であった.我々はBLT1のリン酸化にいくつかの段階があることを見いだし,各々のリン酸化の意義を検討した(図2).その結果,1)BLT1はリガンドが存在していない段階でもわずかにリン酸化されているが,リン酸化を受けるアミノ酸残基は決まっていないこと,2)低濃度のLTB4で刺激されると高親和性を保ったまま細胞走化性などの一次反応をもたらすこと,3)セリン310がリン酸化されることがきっかけとなって受容体が低親和性に変化すること,4)高濃度のLTB4刺激によってトレオニン308がリン酸化されると,脱顆粒反応などの二次反応が生じること,を見いだし,BLT1受容体C末端の段階的なリン酸化の生物学的意義を明らかにした55).
6. LTB4受容体BLT1の生理・病態における役割
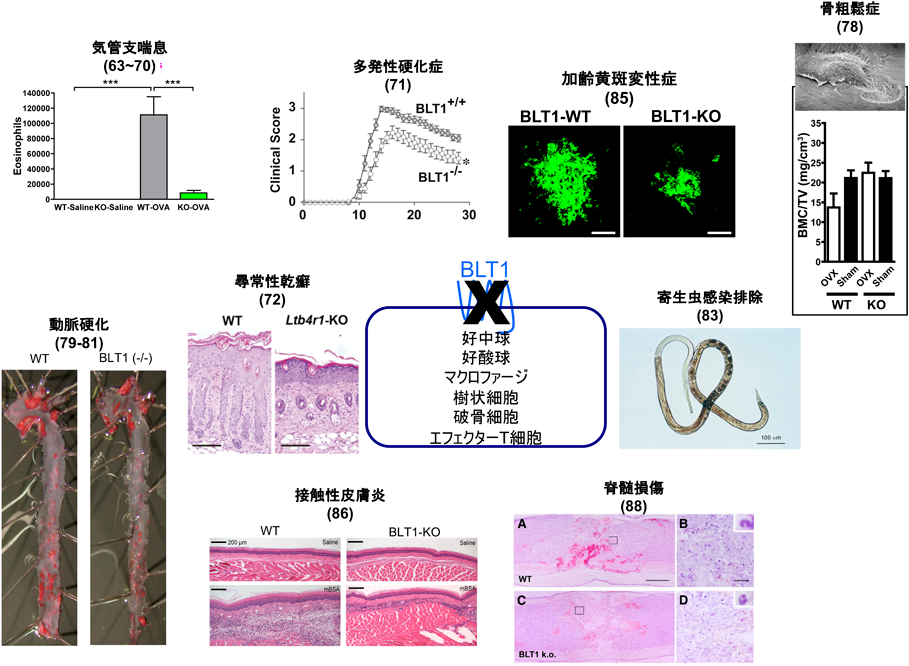
発見当時から,LTB4は好中球の強力な走化性因子として知られ8),細菌感染の排除に重要だと考えられる一方で,その過剰な産生が炎症性疾患の発症や増悪に関わると考えられてきた56).そのため,BLT1の分子同定以前から,主としてヒト好中球を用いたLTB4受容体拮抗薬の開発と臨床応用を目指した研究が行われていた.Phase2まで進んだ研究の対象疾患は,炎症性腸疾患,慢性関節リウマチ,乾癬,ベーチェット病,重症のニキビ,気管支喘息,慢性閉塞性肺疾患(COPD)などであったが,いずれもPhase2止まりとなり,Phase3まで進んだ薬剤は存在しない57).臨床医学での使用が断念されたいくつかのLTB4受容体拮抗薬(LY223982, LY293111, U75302)は実験用試薬として販売されており,5-LOXを阻害して全LT産生を抑制するZileutonやLTA4水解酵素阻害剤Bestatinとともに実験に使用することが可能である.本稿では主に,BLT1の遺伝子同定以降に作製・表現型解析が行われたBLT1欠損マウスの研究成果を紹介する(図3)29).
1)マウス腹膜炎モデル
最初に報告されたBLT1欠損マウスの表現型は,アメリカの二つのグループによる無菌性腹膜炎モデルである58, 59).マウス腹腔にザイモザンやチオグリコレートを注入して惹起した無菌性腹膜炎モデルにおいて,BLT1欠損マウスでは好中球,好酸球,マクロファージの浸潤が低下した.特に好酸球浸潤が大きく低下したことが予想外の発見であり,これが後のヘルパーT細胞2型(Th2)におけるBLT1の役割の解明へとつながった.また,BLT1欠損マウスは血小板活性化因子(PAF)によるアナフィラキシーショックに対して耐性を示した58).なお,この二つの論文が掲載されたJ. Exp. Med.誌には,我々のBLT1の発現調節機構論文60),BLT2の分子同定論文61)も同時に掲載された.四つのLTB4関連の原著論文とコメンタリー論文62)からなるこの号は,さながらLTB4特集号の体を呈した.
2)マウス気管支喘息モデルとT細胞におけるBLT1の役割
次いで,オボアルブミン感作・惹起によるマウス気管支喘息モデルにおけるBLT1の役割が報告された.古くからBLT1の発現が知られていた好中球,好酸球に加えて,BLT1はTh1, Th2細胞,CD8陽性のエフェクター細胞傷害性T細胞(CTL)にも発現しており,気管支喘息モデルにおける気道過敏性亢進と組織障害にBLT1が促進的に作用することが示された63–66).また,好酸球やT細胞に加えて,樹状細胞にもBLT1が発現し,マウス気管支喘息モデルを増悪させることが我々を含めた複数のグループから報告された67–70).BLT1はナイーブT細胞には発現していないため,T細胞の分化に伴う発現上昇機構の存在が示唆されるが,その詳細は現在でも不明である.我々はヒトBLT1の発現調節機構に関して研究を行い,好中球では,BLT1のプロモーター領域に存在するCpGアイランドのメチル化が解除されることでBLT1の転写が促進するという,エピジェネティックな発現調節機構が存在することを報告した60)が,これがT細胞分化に伴って生じているかどうかは現時点では不明である.Th17細胞が病態の進行に関わるとされる多発性硬化症のマウスモデルにおいて,BLT1欠損マウスではT細胞をはじめとした炎症細胞の脊髄への浸潤が低下し,四肢麻痺のスコアも低下した71).同様にTh17細胞の関与が示されている皮膚疾患に尋常性乾癬がある.イミキモドクリームをマウス皮膚に塗布することで尋常乾癬様の症状を引き起こすことができるが,このモデルにおいてBLT1欠損マウスでは好中球浸潤が低下し乾癬様病態が抑えられた72).以上より,BLT1は好中球が関わるTh17関連疾患の増悪を引き起こすと考えられる.
3)マウス関節リウマチと骨粗鬆症モデル
BLT1は分子同定以前から慢性関節リウマチや骨破壊性関節リウマチの創薬標的として注目されていたため,マウス関節リウマチモデルを用いてBLT1欠損の影響が調べられた.いくつかの関節リウマチモデルにおいて,BLT1欠損マウスでは関節腔への好中球浸潤が減少し,骨破壊も軽減した73–75)ことから,BLT1が関節リウマチの重要な創薬標的であることが再確認された.BLT1欠損に加え,5-LOX欠損76)やBLT1/BLT2ダブル欠損マウス77)でも関節炎が軽くなることが示された.しかしながら上述したように,ヒト関節リウマチ患者を対象にしたBLT1拮抗薬CP-195543の治験(COX-2選択的阻害薬との併用療法)は,高い副作用発現率のため中止された(Clinical Trial ID:NCT00424294).予想外の発見だったのは,BLT1が骨粗鬆症の進行を促進するという実験結果であった.マウス卵巣摘除によって引き起こされるエストロゲン欠乏下での骨量の減少がBLT1欠損マウスでは抑制された.LTB4が,破骨細胞に発現するBLT1を活性化することで骨破壊を促進するという実験結果78)は,BLT1拮抗薬が閉経後の骨粗鬆症の予防薬になる可能性を示唆している.
4)マウス動脈硬化モデル
複数のグループから,マウス動脈硬化モデルにおけるLTB4/BLT1の促進効果が報告されている.ApoE欠損と高脂肪食により高脂血症を誘導したマウスにBLT1拮抗薬を投与したところ,動脈硬化巣の形成が顕著に抑制された79).さらに,ApoE欠損背景にBLT1を欠損させたマウスにおいて動脈硬化巣の形成が約半分に抑えられるという報告が二つのグループからなされたが,その原因としてマクロファージ80)と血管平滑筋81)の動脈硬化巣への浸潤の抑制が示されている.我々もApoE欠損下にBLT1欠損マウスを作製し,ほぼ同様の結果を得ている(未発表).
5)感染排除とBLT1
古くから好中球に発現し,細菌感染の排除の役割を有していると考えられてきたBLT1であるが,BLT1欠損が細菌による易感染につながるとの報告はない.我々が行った大腸菌の感染実験でも,BLT1欠損マウスは易感染性を示さなかった(未発表).しかしながら,ライム病を引き起こすことで知られるスピロヘータ属Borrelia burgdorferiのマクロファージによる貪食がBLT1欠損によって低下するとの報告がある82).また,寄生虫感染排除に重要な好酸球の集積に,LTB4産生やBLT1の存在が必要であるとの報告もある83).想像の域を出ないが,哺乳動物は細菌感染に対しては何重もの防御システムを有しているため,BLT1単独の欠損では表現型が得られないのに対し,寄生虫感染に対するシステムにおけるBLT1の役割が大きいのではないだろうか.将来,BLT1拮抗薬が開発された場合,副作用として寄生虫に対する防御能の低下が懸念される.
6)BLT1発現サブセットの発見と機能解析
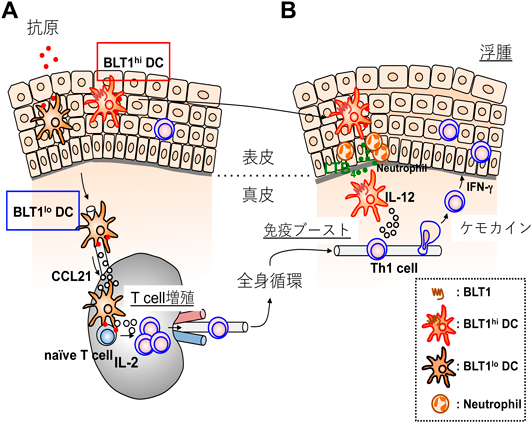
一般論として,GPCRに対する抗体を樹立することは容易ではない.疎水性領域の占める割合が高い,抗原性を有する親水性のアミノ酸の割合が少ない,受容体は効率よくシグナルを増幅するためタンパク質としての発現量は必ずしも高くない,などがその原因として考えられる.我々は長年にわたって,マウスBLT1を細胞外から認識する抗体の樹立を試みてきたが,失敗の連続であった.最終的には,BLT1欠損マウスを抗体産生能の高いBalb/cマウスに戻し交配した後に,マウスBLT1過剰発現細胞で免疫することで,抗マウスBLT1単クローン抗体7A8の樹立に成功した(図4)84).この7A8抗体はきわめて高感度で,好中球に内在性に発現するBLT1を認識し,FACSで展開することが可能である.この抗体を樹立した佐々木博士は,まずマクロファージにおけるBLT1発現を検討した.BLT1は炎症性メディエーターであるLTB4の受容体であるが,マクロファージでは炎症消退性と考えられているM2タイプのマクロファージに発現し,炎症誘導性のM1マクロファージには発現していなかった.M2マクロファージの関与が知られる病的血管新生モデルである加齢黄斑変性症のマウスモデルを用いた解析の結果,BLT1を発現するM2型のマクロファージがレーザーで障害された網膜に集積し,LTB4刺激依存性にVEGF(vascular endothelial growth factor)を産生分泌して病的血管新生を促進していることがわかった.また,LTB4産生酵素阻害剤や,BLT1拮抗薬の前投与によって,病的血管新生を抑制できることも明らかとなり,BLT1拮抗薬の新しい標的疾患として,世界的に大きな社会問題になっている加齢黄斑変性症が加わった85).また,この抗体を用いて樹状細胞の解析を行ったところ,脾臓や骨髄由来の樹状細胞の約30%にBLT1が発現していること,BLT1を発現する樹状細胞は,抗原感作後も所属リンパ節に移動せず,炎症局所にとどまってIL-12を産生しTh1型の免疫反応を促進することが明らかになった(図5)86).また,共同研究者である國澤らは,BLT1がマウス腸管のIgA産生B細胞に発現すること,BLT1欠損マウスでは抗原依存性のIgA産生が減弱することを報告した87).このように,マクロファージ,樹状細胞,T細胞,B細胞では一部のサブセットだけにBLT1が発現しているが,好中球ではほぼすべての細胞がBLT1陽性である.好中球浸潤が病態を悪化させることが知られている脊髄損傷モデルにおいて,BLT1欠損は好中球浸潤の低下をもたらし麻痺を軽減させた88).
7. LTB4/12-HHT受容体BLT2の同定,構造,シグナル伝達
1)BLT2の発見と命名
BLT2の研究ではいくつかのセレンディピティに恵まれた.BLT2の発見につながったのは,白血球特異的なBLT1の転写機構の解明を目指してBLT1プロモーターを探索した実験であった.当時はヒトゲノムプロジェクトが終了しておらず,BLT1遺伝子が存在する13番染色体の全長の配列は公開されていなかった.そのため,私はヒトゲノムライブラリーからヒトBLT1遺伝子を含むファージクローンを単離し,約20 kbにわたる塩基配列を決定した.同時に,BLT1欠損マウスを作製するためにマウスのBLT1遺伝子を含むゲノムクローンも単離し,マウスBLT1遺伝子周辺の塩基配列を決定した.BLT1のタンパク質翻訳領域の先頭から5´側に5 kbほど離れた領域にBLT1プロモーターと思われるGCに富んだ配列を見いだし,白血球以外の細胞ではこのGC領域がメチル化されることでBLT1の発現が抑制されていることを証明した60).しかも,このGCに富む配列は新規のGPCRをコードしており,時に細菌のゲノムで観察される「promoter in ORF(open reading frame)」の構造をとっていた.この新規受容体とさまざまなGPCRとの相同性検索を行ったところ,BLT1と最も相同性が高く,アミノ酸レベルで45%の同一性を有していた.構造が類似した二つのGPCRの遺伝子が染色体上に隣接して存在することから,BLT1とこの新規GPCRが遺伝子重複で生まれたことは容易に想像できた.当初,この受容体は,まだ同定されていなかったCysLT(LTD4受容体)であるに違いないと考えてさまざまな実験を行ったが,LTC4やLTD4に対する応答は観察されず,がっかりする毎日が続いた.しかしながら,この新規受容体のリガンド探索の実験でBLT1をポジティブコントロールにおいていたことが幸いした.BLT1活性化の確認には通常10 nMのLTB4を使用していたが,ある日,LTB4の濃度調整を間違えて10倍濃度の100 nMのLTB4を作ってしまい,これをそのまま新規受容体発現細胞に添加したところ,明瞭な受容体活性化が観察されたのである.これがきっかけとなって,この新規受容体が低親和性LTB4受容体として機能することを証明し,BLT2と命名した61).我々の発表に加えて他の研究者からも同様の報告がなされ89, 90),BLT2が低親和性LTB4受容体であることがいったんは確定したように思われた.論文発表から3年後の国際薬理学会でBLT1, BLT2の名称が正式に認められた44).
2)BLT2リガンド12-HHTの発見
白血球以外の細胞ではほとんど発現が観察されないBLT1に対して,BLT2は広範な組織に発現していた.ヒトやマウスのBLT2は確かに高濃度のLTB4で活性化されるが,BLT2依存性のカルシウム上昇作用におけるLTB4のEC50値は300 nMを超え,しかもBLT1発現細胞と比較すると,BLT2発現細胞のカルシウム応答は弱々しかった61).さらに,BLT2発現細胞がµM濃度の12-HETE(hydroxyeicosatetraenoic acid)や15-HETEでも活性化されたことから,BLT2はリガンド認識の甘い受容体であることもわかった91).この論文を発表した2001年ごろから,BLT2にはLTB4やHETEとは異なる,真のリガンドが存在するのではないかとの思いが強くなった.そこで,市販されている脂質ライブラリーを購入して数百種の脂質リガンド候補をスクリーニングしたりしたが,LTB4よりも強いBLT2リガンドを見つけることはできなかった.清水孝雄研究室で学位を取得し,田口良教授の研究室の特任助教になった奥野利明博士(現在,私の研究室の准教授)が,生体材料からの抽出物を材料にして,リガンド不明のオーファンGPCRの脂質リガンド探索を行うことになったため,BLT2もその対象に加えてもらうことにした.奥野博士はラットのさまざまな臓器から脂質を抽出し,BLT2を含むGPCRに対するアゴニスト活性を評価する過程で,ラット小腸の極性脂質画分がBLT2を活性化することを見いだした.この画分がBLT1発現細胞をまったく活性化しなかったことから,LTB4以外の脂質,おそらくは酸化脂肪酸がBLT2を活性化することが想定された.逆相のHPLCで分画を行ったところ,このBLT2作働活性はLTB4,12-HETE, 15-HETEとは異なるフラクションに回収された.HPLCと質量分析計を用いたフラグメンテーションの解析から,このBLT2作働活性分子は炭素数17の酸化脂肪酸である12-HHT(hydroxyheptadecatrienoid acid)であると推定され,事実,合成12-HHTはLTB4よりも1桁以上低い濃度でヒトBLT2を強く活性化した92).マウスやゼブラフィッシュ93)のBLT2もまた,ヒトBLT2と同様に12-HHTで強く活性化されたことから,12-HHT/BLT2軸は魚類から哺乳動物まで保存された系であることがわかった.12-HHTは,活性化血小板において,トロンボキサンA2(TxA2)がPGH2から産生される際に,TxA2と等モル産生されることが知られていた酸化脂質94)であり,血小板活性化のよい指標として用いられていたが,生物学的な活性はそれまでまったく知られていなかった.
3)12-HHT産生経路の再検証
12-HHTは,COX依存性に産生された炭素数20のPGH2から炭素数3のMDA(malondialdehyde)が切り出される結果生じる,炭素数17の脂肪酸である(図1).我々はCOX-1欠損マウス,TxA2合成酵素欠損マウス,とNSAIDを用いて12-HHT産生経路の再検証を行った.過去の報告どおり,12-HHT産生は血液凝固や血小板活性化に伴って亢進し,ヒト血清中の12-HHT濃度は700 nMにも達した.COX-1欠損マウスや,NSAID存在下で12-HHT産生は完全に消失したが,TxA2合成酵素欠損マウスやTxA2合成酵素阻害剤(オザグレル)処理では20%程度の12-HHT産生が残存したことから,TxA2合成酵素に依存しない12-HHT産生経路が存在することがわかった.さらに,TxA2合成酵素の阻害や欠損によってPGE2やPGD2の産生が大きく亢進し,これは蓄積したPGH2が非酵素的(おそらくはヘム依存的)にPGE2やD2に変換されるためだと考えられた95).以上の結果,血液凝固時や活性化された血小板からはBLT2を活性化するのに十分な濃度の12-HHTが産生されることが明らかとなった.また,NSAIDによって12-HHT産生が抑制されることは,以降のBLT2の機能解析の重要な出発点となった.
8. 12-HHT/LTB4受容体BLT2の生理・病態における役割
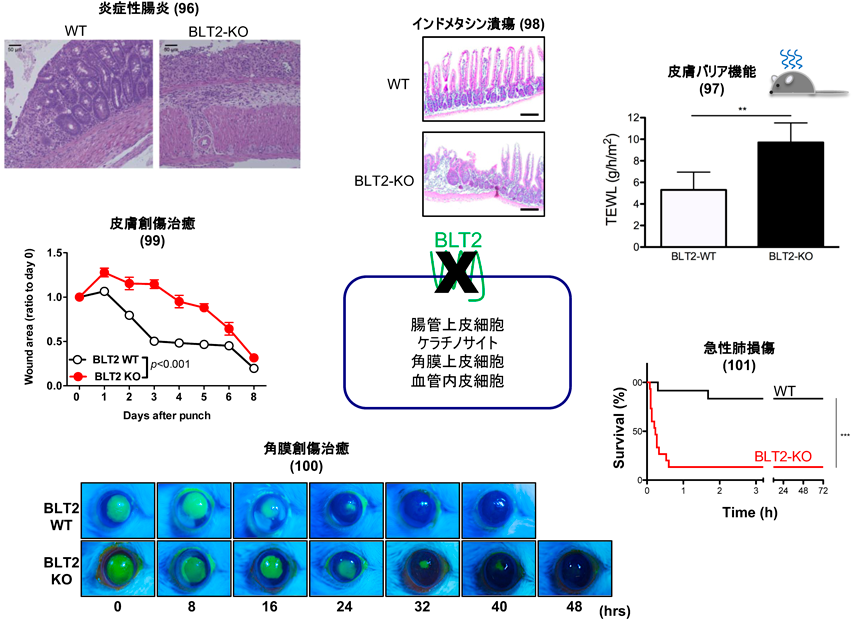
内在性に発現するBLT2を確実に検出できる抗BLT2抗体は現在でも樹立できていないが,RT-PCRやin situハイブリダイゼーション解析の結果,BLT2はマウスの腸管上皮,皮膚ケラチノサイト,目の角膜といった,外界と接する細胞に発現していることがわかったため,こうした細胞におけるBLT2の役割の解明を目指してBLT2欠損マウスを作製して研究を行った(図6).
1)BLT2の腸管保護作用
BLT2欠損マウスで最初に観察された表現型は,炎症性腸炎モデルの重症化であった.デキストラン硫酸(DSS)は腸管上皮を障害し,腸内細菌の腸上皮への侵入を許す結果,炎症性の腸炎を引き起こす薬剤である.我々の飼育環境では1%という低濃度のDSSの投与は野生型マウスで腸炎を引き起こさないが,BLT2欠損マウスでは重篤な腸炎を引き起こし,12日間で20%の体重減少を来すとともに,組織学的にも多数の炎症細胞の腸管への浸潤が観察された.上皮系の細胞であるMDCK細胞にBLT2を発現させると,細胞単層培養シート上下間での電気抵抗が上昇すると同時に,蛍光ラベルしたデキストランの漏れ込みが減少したことから,BLT2は細胞間のバリア機能を亢進させることで細菌の上皮内への浸潤を抑制している可能性が示唆された96).我々はこのMDCK-BLT2細胞を用いて,BLT2からバリア機能亢進に至るシグナル伝達系路を詳細に解析した.その結果,12-HHTがBLT2-Gαi-p38MAPキナーゼ経路を介して細胞間接着因子であるクローディン4の発現を上昇させる結果,皮膚や腸管上皮のバリア機能を亢進させることを見いだした97).共同研究者である京都薬科大学の加藤らは,NSAIDであるインドメタシンで誘導した小腸潰瘍モデルを用いて,12-HHT/BLT2が腸管上皮の増殖を促進すること98)を見いだし,12-HHT/BLT2が上皮の移動,増殖,バリア維持のいずれにも促進的に働きうることがわかった.
2)BLT2は12-HHT依存的に上皮修復を促進する
12-HHT産生が,NSAIDによって抑制されることをヒントに,我々は12-HHT産生抑制を介した新しいNSAIDの副作用発現機序を探索した.12-HHT産生が亢進する出血を伴う上皮障害として,皮膚の全層欠損後の修復過程におけるBLT2欠損とNSAIDの効果を検証した.BLT2欠損とNSAIDであるアスピリンの投与は,それぞれ皮膚創傷治癒を遅延させたが,BLT2欠損マウスではアスピリンによる創傷治癒の遅延が観察されなかった.組織学的にはBLT2欠損とNSAID投与では共通して,再上皮化の抑制が観察された.初代培養ケラチノサイトや,BLT2過剰発現HaCaT細胞を用いたin vitroのスクラッチアッセイでも,BLT2発現や12-HHT投与は創傷治癒を促進した.さらに,合成BLT2作働薬(CAY10583)がB6マウスやdb/dbマウス(糖尿病マウスで創傷治癒が遅延する)における皮膚創傷治癒を促進したことから,BLT2作働薬が難治性の皮膚潰瘍や褥瘡の治療薬となる可能性が示された99).また,NSAIDがプロスタグランジンではなく,12-HHT産生を抑制することで,創傷治癒遅延の副作用を引き起こす発見は驚きをもって迎えられた.我々はさらに,BLT2を高発現するマウス角膜の創傷治癒過程にも同様のメカニズムが存在することを報告した100).
3)急性肺障害におけるBLT2の保護作用
肺炎球菌が発現する毒素(ニューモライシン,PLY)は,宿主細胞の細胞膜を穿孔するpore forming toxinとして知られている.PLYの気道内投与による急性肺障害モデルを作製したところ,野生型マウスがほとんど影響を受けない低容量のPLY投与によって,BLT2欠損マウスは数分以内に死亡した.BLT2欠損マウスでは顕著な血管透過性の亢進と気管支平滑筋の収縮が観察され,気管支喘息の重積発作様の組織像を示したため,肺胞洗浄液中の生理活性脂質の一斉定量解析を行った.PLY投与によって大量のペプチドLT(LTC4,LTD4)の産生が観察された.そこで,ペプチドLTの受容体であるCysLT1拮抗薬を投与したところ,PLYによるBLT2欠損マウスの致死性がレスキューされた101).このBLT2による急性肺障害抑制の分子メカニズムは現在も解析中であるが,何らかのメカニズムでBLT2はペプチドLTのシグナル伝達を強力に抑制しているようである.
引用文献References
1) Dahlén, S.E., Björk, J., Hedqvist, P., Arfors, K.E., Hammarström, S., Lindgren, J.A., & Samuelsson, B. (1981) Leukotrienes promote plasma leakage and leukocyte adhesion in postcapillary venules: in vivo effects with relevance to the acute inflammatory response. Proc. Natl. Acad. Sci. USA, 78, 3887–3891.
2) Samuelsson, B. (1983) Leukotrienes: mediators of immediate hypersensitivity reactions and inflammation. Science, 220, 568–575.
3) Borgeat, P., Hamberg, M., & Samuelsson, B. (1976) Transformation of arachidonic acid and homo-gamma-linolenic acid by rabbit polymorphonuclear leukocytes. Monohydroxy acids from novel lipoxygenases. J. Biol. Chem., 251, 7816–7820.
4) Borgeat, P. & Samuelsson, B. (1979) Metabolism of arachidonic acid in polymorphonuclear leukocytes. Structural analysis of novel hydroxylated compounds. J. Biol. Chem., 254, 7865–7869.
5) Borgeat, P. & Samuelsson, B. (1979) Transformation of arachidonic acid by rabbit polymorphonuclear leukocytes. Formation of a novel dihydroxyeicosatetraenoic acid. J. Biol. Chem., 254, 2643–2646.
6) Borgeat, P. & Samuelsson, B. (1979) Arachidonic acid metabolism in polymorphonuclear leukocytes: Unstable intermediate in formation of dihydroxy acids. Proc. Natl. Acad. Sci. USA, 76, 3213–3217.
7) Borgeat, P. & Samuelsson, B. (1979) Arachidonic acid metabolism in polymorphonuclear leukocytes: Effects of ionophore A23187. Proc. Natl. Acad. Sci. USA, 76, 2148–2152.
8) Ford-Hutchinson, A.W., Bray, M.A., Doig, M.V., Shipley, M.E., & Smith, M.J. (1980) Leukotriene B, a potent chemokinetic and aggregating substance released from polymorphonuclear leukocytes. Nature, 286, 264–265.
9) Murphy, R.C., Hammarstrom, S., & Samuelsson, B. (1979) Leukotriene C: A slow-reacting substance from murine mastocytoma cells. Proc. Natl. Acad. Sci. USA, 76, 4275–4279.
10) Uozumi, N., Kume, K., Nagase, T., Nakatani, N., Ishii, S., Tashiro, F., Komagata, Y., Maki, K., Ikuta, K., Ouchi, Y., et al. (1997) Role of cytosolic phospholipase A2 in allergic response and parturition. Nature, 390, 618–622.
11) Murakami, M., Yamamoto, K., Miki, Y., Murase, R., Sato, H., & Taketomi, Y. (2016) The Roles of the Secreted Phospholipase A2 Gene Family in Immunology. Adv. Immunol., 132, 91–134.
12) Shimizu, T., Radmark, O., & Samuelsson, B. (1984) Enzyme with dual lipoxygenase activities catalyzes leukotriene A4 synthesis from arachidonic acid. Proc. Natl. Acad. Sci. USA, 81, 689–693.
13) Rouzer, C.A., Shimizu, T., & Samuelsson, B. (1985) On the nature of the 5-lipoxygenase reaction in human leukocytes: Characterization of a membrane-associated stimulatory factor. Proc. Natl. Acad. Sci. USA, 82, 7505–7509.
14) Dixon, R.A., Diehl, R.E., Opas, E., Rands, E., Vickers, P.J., Evans, J.F., Gillard, J.W., & Miller, D.K. (1990) Requirement of a 5-lipoxygenase-activating protein for leukotriene synthesis. Nature, 343, 282–284.
15) Gijón, M.A., Zarini, S., & Murphy, R.C. (2007) Biosynthesis of eicosanoids and transcellular metabolism of leukotrienes in murine bone marrow cells. J. Lipid Res., 48, 716–725.
16) Snelgrove, R.J., Jackson, P.L., Hardison, M.T., Noerager, B.D., Kinloch, A., Gaggar, A., Shastry, S., Rowe, S.M., Shim, Y.M., Hussell, T., et al. (2010) A critical role for LTA4H in limiting chronic pulmonary neutrophilic inflammation. Science, 330, 90–94.
17) Uzawa, H., Kohno, D., Koga, T., Sasaki, T., Fukunaka, A., Okuno, T., Jo-Watanabe, A., Kazuno, S., Miyatsuka, T., Kitamura, T., et al. (2020) Leukotriene A4 hydrolase deficiency protects mice from diet-induced obesity by increasing energy expenditure through neuroendocrine axis. FASEB J., 34, 13949–13958.
18) Rius, M., Hummel-Eisenbeiss, J., & Keppler, D. (2008) ATP-dependent transport of leukotrienes B4 and C4 by the multidrug resistance protein ABCC4 (MRP4). J. Pharmacol. Exp. Ther., 324, 86–94.
19) Leier, I., Jedlitschky, G., Buchholz, U., Cole, S.P., Deeley, R.G., & Keppler, D. (1994) The MRP gene encodes an ATP-dependent export pump for leukotriene C4 and structurally related conjugates. J. Biol. Chem., 269, 27807–27810.
20) Paruchuri, S., Jiang, Y., Feng, C., Francis, S.A., Plutzky, J., & Boyce, J.A. (2008) Leukotriene E4 activates peroxisome proliferator-activated receptor gamma and induces prostaglandin D2 generation by human mast cells. J. Biol. Chem., 283, 16477–16487.
21) Paruchuri, S., Tashimo, H., Feng, C., Maekawa, A., Xing, W., Jiang, Y., Kanaoka, Y., Conley, P., & Boyce, J.A. (2009) Leukotriene E4-induced pulmonary inflammation is mediated by the P2Y12 receptor. J. Exp. Med., 206, 2543–2555.
22) Kanaoka, Y., Maekawa, A., & Austen, K.F. (2013) Identification of GPR99 protein as a potential third cysteinyl leukotriene receptor with a preference for leukotriene E4 ligand. J. Biol. Chem., 288, 10967–10972.
23) Bankova, L.G., Lai, J., Yoshimoto, E., Boyce, J.A., Austen, K.F., Kanaoka, Y., & Barrett, N.A. (2016) Leukotriene E4 elicits respiratory epithelial cell mucin release through the G-protein-coupled receptor, GPR99. Proc. Natl. Acad. Sci. USA, 113, 6242–6247.
24) Ciana, P., Fumagalli, M., Trincavelli, M.L., Verderio, C., Rosa, P., Lecca, D., Ferrario, S., Parravicini, C., Capra, V., Gelosa, P., et al. (2006) The orphan receptor GPR17 identified as a new dual uracil nucleotides/cysteinyl-leukotrienes receptor. EMBO J., 25, 4615–4627.
25) Maekawa, A., Balestrieri, B., Austen, K.F., & Kanaoka, Y. (2009) GPR17 is a negative regulator of the cysteinyl leukotriene 1 receptor response to leukotriene D4. Proc. Natl. Acad. Sci. USA, 106, 11685–11690.
26) Maekawa, A., Xing, W., Austen, K.F., & Kanaoka, Y. (2010) GPR17 regulates immune pulmonary inflammation induced by house dust mites. J. Immunol., 185, 1846–1854.
27) Nakamura, M. & Shimizu, T. (2011) Leukotriene receptors. Chem. Rev., 111, 6231–6298.
28) Bäck, M., Powell, W.S., Dahlen, S.E., Drazen, J.M., Evans, J.F., Serhan, C.N., Shimizu, T., Yokomizo, T., & Rovati, G.E. (2014) Update on leukotriene, lipoxin and oxoeicosanoid receptors: IUPHAR Review 7. Br. J. Pharmacol., 171, 3551–3574.
29) Yokomizo, T., Nakamura, M., & Shimizu, T. (2018) Leukotriene receptors as potential therapeutic targets. J. Clin. Invest., 128, 2691–2701.
30) Soberman, R.J., Harper, T.W., Murphy, R.C., & Austen, K.F. (1985) Identification and functional characterization of leukotriene B4 20-hydroxylase of human polymorphonuclear leukocytes. Proc. Natl. Acad. Sci. USA, 82, 2292–2295.
31) Kikuta, Y., Kusunose, E., Kondo, T., Yamamoto, S., Kinoshita, H., & Kusunose, M. (1994) Cloning and expression of a novel form of leukotriene B4 omega-hydroxylase from human liver. FEBS Lett., 348, 70–74.
32) Gotoh, Y., Sumimoto, H., Takeshige, K., & Minakami, S. (1988) NAD+-dependent oxidation of 20-hydroxyleukotriene B4 to 20-carboxyleukotriene B4 by rat liver cytosol. Biochim. Biophys. Acta, 960, 342–350.
33) Sumimoto, H. & Minakami, S. (1990) Oxidation of 20-hydroxyleukotriene B4 to 20-carboxyleukotriene B4 by human neutrophil microsomes. Role of aldehyde dehydrogenase and leukotriene B4 omega-hydroxylase (cytochrome P-450LTB omega) in leukotriene B4 omega-oxidation. J. Biol. Chem., 265, 4348–4353.
34) Yokomizo, T., Izumi, T., Takahashi, T., Kasama, T., Kobayashi, Y., Sato, F., Taketani, Y., & Shimizu, T. (1993) Enzymatic inactivation of leukotriene B4 by a novel enzyme found in the porcine kidney. Purification and properties of leukotriene B4 12-hydroxydehydrogenase. J. Biol. Chem., 268, 18128–18135.
35) Yokomizo, T., Ogawa, Y., Uozumi, N., Kume, K., Izumi, T., & Shimizu, T. (1996) cDNA cloning, expression, and mutagenesis study of leukotriene B4 12-hydroxydehydrogenase. J. Biol. Chem., 271, 2844–2850.
36) Tai, H.H. (2011) Prostaglandin catabolic enzymes as tumor suppressors. Cancer Metastasis Rev., 30, 409–417.
37) Clish, C.B., Levy, B.D., Chiang, N., Tai, H.H., & Serhan, C.N. (2000) Oxidoreductases in lipoxin A4 metabolic inactivation: A novel role for 15-onoprostaglandin 13-reductase/leukotriene B4 12-hydroxydehydrogenase in inflammation. J. Biol. Chem., 275, 25372–25380.
38) Igarashi, T., Yokomizo, T., Tsutsumi, O., Taketani, Y., Shimizu, T., & Izumi, T. (1999) Characterization of the leukotriene B4 receptor in porcine leukocytes. Separation and reconstitution with heterotrimeric GTP-binding proteins. Eur. J. Biochem., 259, 419–425.
39) Sherman, J.W., Mendelson, M.A., Boggs, J.M., Koo, C.H., & Goetzl, E.J. (1992) Ligand-induced formation of the leukotriene B4 receptor-G protein complex of human polymorphonuclear leukocytes. J. Cell. Biochem., 48, 367–372.
40) Honda, Z., Nakamura, M., Miki, I., Minami, M., Watanabe, T., Seyama, Y., Okado, H., Toh, H., Ito, K., Miyamoto, T., et al. (1991) Cloning by functional expression of platelet-activating factor receptor from guinea-pig lung. Nature, 349, 342–346.
41) Hirata, M., Hayashi, Y., Ushikubi, F., Yokota, Y., Kageyama, R., Nakanishi, S., & Narumiya, S. (1991) Cloning and expression of cDNA for a human thromboxane A2 receptor. Nature, 349, 617–620.
42) Woodward, D.F., Jones, R.L., & Narumiya, S. (2011) International Union of Basic and Clinical Pharmacology. LXXXIII: Classification of prostanoid receptors, updating 15 years of progress. Pharmacol. Rev., 63, 471–538.
43) Yokomizo, T., Izumi, T., Chang, K., Takuwa, Y., & Shimizu, T. (1997) A G-protein-coupled receptor for leukotriene B4 that mediates chemotaxis. Nature, 387, 620–624.
44) Brink, C., Dahlen, S.E., Drazen, J., Evans, J.F., Hay, D.W., Nicosia, S., Serhan, C.N., Shimizu, T., & Yokomizo, T. (2003) International Union of Pharmacology XXXVII. Nomenclature for leukotriene and lipoxin receptors. Pharmacol. Rev., 55, 195–227.
45) Gether, U. & Kobilka, B.K. (1998) G protein-coupled receptors. II. Mechanism of agonist activation. J. Biol. Chem., 273, 17979–17982.
46) Saeki, K. & Yokomizo, T. (2017) Identification, signaling, and functions of LTB4 receptors. Semin. Immunol., 33, 30–36.
47) Kuniyeda, K., Okuno, T., Terawaki, K., Miyano, M., Yokomizo, T., & Shimizu, T. (2007) Identification of the intracellular region of the leukotriene B4 receptor type 1 that is specifically involved in Gi activation. J. Biol. Chem., 282, 3998–4006.
48) Okamoto, F., Saeki, K., Sumimoto, H., Yamasaki, S., & Yokomizo, T. (2010) Leukotriene B4 augments and restores Fc gammaRs-dependent phagocytosis in macrophages. J. Biol. Chem., 285, 41113–41121.
49) Chen, Z., Gaudreau, R., Le Gouill, C., Rola-Pleszczynski, M., & Stankova, J. (2004) Agonist-induced internalization of leukotriene B(4) receptor 1 requires G-protein-coupled receptor kinase 2 but not arrestins. Mol. Pharmacol., 66, 377–386.
50) Jala, V.R., Shao, W.H., & Haribabu, B. (2005) Phosphorylation-independent beta-arrestin translocation and internalization of leukotriene B4 receptors. J. Biol. Chem., 280, 4880–4887.
51) Palczewski, K., Kumasaka, T., Hori, T., Behnke, C.A., Motoshima, H., Fox, B.A., Le Trong, I., Teller, D.C., Okada, T., Stenkamp, R.E., et al. (2000) Crystal structure of rhodopsin: A G protein-coupled receptor. Science, 289, 739–745.
52) Okuno, T., Ago, H., Terawaki, K., Miyano, M., Shimizu, T., & Yokomizo, T. (2003) Helix 8 of the leukotriene B4 receptor is required for the conformational change to the low affinity state after G-protein activation. J. Biol. Chem., 278, 41500–41509.
53) Okuno, T., Yokomizo, T., Hori, T., Miyano, M., & Shimizu, T. (2005) Leukotriene B4 receptor and the function of its helix 8. J. Biol. Chem., 280, 32049–32052.
54) Aratake, Y., Okuno, T., Matsunobu, T., Saeki, K., Takayanagi, R., Furuya, S., & Yokomizo, T. (2012) Helix 8 of leukotriene B4 receptor 1 inhibits ligand-induced internalization. FASEB J., 26, 4068–4078.
55) Nakanishi, Y., Tan, M., Ichiki, T., Inoue, A., Yoshihara, J.I., Maekawa, N., Takenoshita, I., Yanagida, K., Yamahira, S., Yamaguchi, S., et al. (2018) Stepwise phosphorylation of leukotriene B4 receptor 1 defines cellular responses to leukotriene B4. Sci. Signal., 11, eaao5390.
56) Samuelsson, B., Dahlen, S.E., Lindgren, J.A., Rouzer, C.A., & Serhan, C.N. (1987) Leukotrienes and lipoxins: Structures, biosynthesis, and biological effects. Science, 237, 1171–1176.
57) Bhatt, L., Roinestad, K., Van, T., & Springman, E.B. (2017) Recent advances in clinical development of leukotriene B4 pathway drugs. Semin. Immunol., 33, 65–73.
58) Haribabu, B., Verghese, M.W., Steeber, D.A., Sellars, D.D., Bock, C.B., & Snyderman, R. (2000) Targeted disruption of the leukotriene B(4) receptor in mice reveals its role in inflammation and platelet-activating factor-induced anaphylaxis. J. Exp. Med., 192, 433–438.
59) Tager, A.M., Dufour, J.H., Goodarzi, K., Bercury, S.D., von Andrian, U.H., & Luster, A.D. (2000) BLTR mediates leukotriene B(4)-induced chemotaxis and adhesion and plays a dominant role in eosinophil accumulation in a murine model of peritonitis. J. Exp. Med., 192, 439–446.
60) Kato, K., Yokomizo, T., Izumi, T., & Shimizu, T. (2000) Cell-specific transcriptional regulation of human leukotriene B(4) receptor gene. J. Exp. Med., 192, 413–420.
61) Yokomizo, T., Kato, K., Terawaki, K., Izumi, T., & Shimizu, T. (2000) A second leukotriene B(4) receptor, BLT2. A new therapeutic target in inflammation and immunological disorders. J. Exp. Med., 192, 421–432.
62) Serhan, C.N. & Prescott, S.M. (2000) The scent of a phagocyte: Advances on leukotriene b(4) receptors. J. Exp. Med., 192, F5–F8.
63) Goodarzi, K., Goodarzi, M., Tager, A.M., Luster, A.D., & von Andrian, U.H. (2003) Leukotriene B4 and BLT1 control cytotoxic effector T cell recruitment to inflamed tissues. Nat. Immunol., 4, 965–973.
64) Ott, V.L., Cambier, J.C., Kappler, J., Marrack, P., & Swanson, B.J. (2003) Mast cell-dependent migration of effector CD8+ T cells through production of leukotriene B4. Nat. Immunol., 4, 974–981.
65) Schoenberger, S.P. (2003) BLT for speed. Nat. Immunol., 4, 937–939.
66) Tager, A.M., Bromley, S.K., Medoff, B.D., Islam, S.A., Bercury, S.D., Friedrich, E.B., Carafone, A.D., Gerszten, R.E., & Luster, A.D. (2003) Leukotriene B4 receptor BLT1 mediates early effector T cell recruitment. Nat. Immunol., 4, 982–990.
67) Miyahara, N., Takeda, K., Miyahara, S., Matsubara, S., Koya, T., Joetham, A., Krishnan, E., Dakhama, A., Haribabu, B., & Gelfand, E.W. (2005) Requirement for leukotriene B4 receptor 1 in allergen-induced airway hyperresponsiveness. Am. J. Respir. Crit. Care Med., 172, 161–167.
68) Miyahara, N., Takeda, K., Miyahara, S., Taube, C., Joetham, A., Koya, T., Matsubara, S., Dakhama, A., Tager, A.M., Luster, A.D., et al. (2005) Leukotriene B4 receptor-1 is essential for allergen-mediated recruitment of CD8+ T cells and airway hyperresponsiveness. J. Immunol., 174, 4979–4984.
69) Terawaki, K., Yokomizo, T., Nagase, T., Toda, A., Taniguchi, M., Hashizume, K., Yagi, T., & Shimizu, T. (2005) Absence of leukotriene B4 receptor 1 confers resistance to airway hyperresponsiveness and Th2-type immune responses. J. Immunol., 175, 4217–4225.
70) Miyahara, N., Ohnishi, H., Matsuda, H., Miyahara, S., Takeda, K., Koya, T., Matsubara, S., Okamoto, M., Dakhama, A., Haribabu, B., et al. (2008) Leukotriene B4 receptor 1 expression on dendritic cells is required for the development of Th2 responses and allergen-induced airway hyperresponsiveness. J. Immunol., 181, 1170–1178.
71) Kihara, Y., Yokomizo, T., Kunita, A., Morishita, Y., Fukayama, M., Ishii, S., & Shimizu, T. (2010) The leukotriene B4 receptor, BLT1, is required for the induction of experimental autoimmune encephalomyelitis. Biochem. Biophys. Res. Commun., 394, 673–678.
72) Sumida, H., Yanagida, K., Kita, Y., Abe, J., Matsushima, K., Nakamura, M., Ishii, S., Sato, S., & Shimizu, T. (2014) Interplay between CXCR2 and BLT1 facilitates neutrophil infiltration and resultant keratinocyte activation in a murine model of imiquimod-induced psoriasis. J. Immunol., 192, 4361–4369.
73) Kim, N.D., Chou, R.C., Seung, E., Tager, A.M., & Luster, A.D. (2006) A unique requirement for the leukotriene B4 receptor BLT1 for neutrophil recruitment in inflammatory arthritis. J. Exp. Med., 203, 829–835.
74) Chen, M., Lam, B.K., Kanaoka, Y., Nigrovic, P.A., Audoly, L.P., Austen, K.F., & Lee, D.M. (2006) Neutrophil-derived leukotriene B4 is required for inflammatory arthritis. J. Exp. Med., 203, 837–842.
75) Miyabe, Y., Miyabe, C., Murooka, T.T., Kim, E.Y., Newton, G.A., Kim, N.D., Haribabu, B., Luscinskas, F.W., Mempel, T.R., & Luster, A.D. (2017) Complement C5a receptor is the key initiator of neutrophil adhesion igniting immune complex-induced arthritis. Sci. Immunol., 2, eaaj2195.
76) Griffiths, R.J., Pettipher, E.R., Koch, K., Farrell, C.A., Breslow, R., Conklyn, M.J., Smith, M.A., Hackman, B.C., Wimberly, D.J., & Milici, A.J. (1995) Leukotriene B4 plays a critical role in the progression of collagen-induced arthritis. Proc. Natl. Acad. Sci. USA, 92, 517–521.
77) Shao, W.H., Del Prete, A., Bock, C.B., & Haribabu, B. (2006) Targeted disruption of leukotriene B4 receptors BLT1 and BLT2: a critical role for BLT1 in collagen-induced arthritis in mice. J. Immunol., 176, 6254–6261.
78) Hikiji, H., Ishii, S., Yokomizo, T., Takato, T., & Shimizu, T. (2009) A distinctive role of the leukotriene B4 receptor BLT1 in osteoclastic activity during bone loss. Proc. Natl. Acad. Sci. USA, 106, 21294–21299.
79) Bäck, M., Bu, D.X., Branstrom, R., Sheikine, Y., Yan, Z.Q., & Hansson, G.K. (2005) Leukotriene B4 signaling through NF-kappaB-dependent BLT1 receptors on vascular smooth muscle cells in atherosclerosis and intimal hyperplasia. Proc. Natl. Acad. Sci. USA, 102, 17501–17506.
80) Subbarao, K., Jala, V.R., Mathis, S., Suttles, J., Zacharias, W., Ahamed, J., Ali, H., Tseng, M.T., & Haribabu, B. (2004) Role of leukotriene B4 receptors in the development of atherosclerosis: potential mechanisms. Arterioscler. Thromb. Vasc. Biol., 24, 369–375.
81) Heller, E.A., Liu, E., Tager, A.M., Sinha, S., Roberts, J.D., Koehn, S.L., Libby, P., Aikawa, E.R., Chen, J.Q., Huang, P., et al. (2005) Inhibition of atherogenesis in BLT1-deficient mice reveals a role for LTB4 and BLT1 in smooth muscle cell recruitment. Circulation, 112, 578–586.
82) Zhang, Y., Olson, R.M., & Brown, C.R. (2017) Macrophage LTB4 drives efficient phagocytosis of Borrelia burgdorferi via BLT1 or BLT2. J. Lipid Res., 58, 494–503.
83) Patnode, M.L., Bando, J.K., Krummel, M.F., Locksley, R.M., & Rosen, S.D. (2014) Leukotriene B4 amplifies eosinophil accumulation in response to nematodes. J. Exp. Med., 211, 1281–1288.
84) Sasaki, F., Koga, T., Saeki, K., Okuno, T., Kazuno, S., Fujimura, T., Ohkawa, Y., & Yokomizo, T. (2017) Biochemical and immunological characterization of a novel monoclonal antibody against mouse leukotriene B4 receptor 1. PLoS One, 12, e0185133.
85) Sasaki, F., Koga, T., Ohba, M., Saeki, K., Okuno, T., Ishikawa, K., Nakama, T., Nakao, S., Yoshida, S., Ishibashi, T., et al. (2018) Leukotriene B4 promotes neovascularization and macrophage recruitment in murine wet-type AMD models. JCI Insight, 3, 96902.
86) Koga, T., Sasaki, F., Saeki, K., Tsuchiya, S., Okuno, T., Ohba, M., Ichiki, T., Iwamoto, S., Uzawa, H., Kitajima, K., et al. (2020) Expression of leukotriene B4 receptor 1 defines functionally distinct DCs that control allergic skin inflammation. Cell. Mol. Immunol., in press.
87) Nagatake, T., Hirata, S.I., Koga, T., Kuroda, E., Kobari, S., Suzuki, H., Hosomi, K., Matsumoto, N., Yanrismet, Y., Shimojou, M., et al. (2019) BLT1 mediates commensal bacteria-dependent innate immune signals to enhance antigen-specific intestinal IgA responses. Mucosal Immunol., 12, 1082–1091.
88) Saiwai, H., Ohkawa, Y., Yamada, H., Kumamaru, H., Harada, A., Okano, H., Yokomizo, T., Iwamoto, Y., & Okada, S. (2010) The LTB4-BLT1 axis mediates neutrophil infiltration and secondary injury in experimental spinal cord injury. Am. J. Pathol., 176, 2352–2366.
89) Kamohara, M., Takasaki, J., Matsumoto, M., Saito, T., Ohishi, T., Ishii, H., & Furuichi, K. (2000) Molecular cloning and characterization of another leukotriene B4 receptor. J. Biol. Chem., 275, 27000–27004.
90) Wang, S., Gustafson, E., Pang, L., Qiao, X., Behan, J., Maguire, M., Bayne, M., & Laz, T. (2000) A novel hepatointestinal leukotriene B4 receptor. Cloning and functional characterization. J. Biol. Chem., 275, 40686–40694.
91) Yokomizo, T., Kato, K., Hagiya, H., Izumi, T., & Shimizu, T. (2001) Hydroxyeicosanoids bind to and activate the low affinity leukotriene B4 receptor, BLT2. J. Biol. Chem., 276, 12454–12459.
92) Okuno, T., Iizuka, Y., Okazaki, H., Yokomizo, T., Taguchi, R., & Shimizu, T. (2008) 12(S)-Hydroxyheptadeca-5Z, 8E, 10E-trienoic acid is a natural ligand for leukotriene B4 receptor 2. J. Exp. Med., 205, 759–766.
93) Okuno, T., Ishitani, T., & Yokomizo, T. (2015) Biochemical Characterization of Three BLT Receptors in Zebrafish. PLoS One, 10, e0117888.
94) Hamberg, M., Svensson, J., & Samuelsson, B. (1974) Prostaglandin endoperoxides. A new concept concerning the mode of action and release of prostaglandins. Proc. Natl. Acad. Sci. USA, 71, 3824–3828.
95) Matsunobu, T., Okuno, T., Yokoyama, C., & Yokomizo, T. (2013) Thromboxane A synthase-independent production of 12-hydroxyheptadecatrienoic acid, a BLT2 ligand. J. Lipid Res., 54, 2979–2987.
96) Iizuka, Y., Okuno, T., Saeki, K., Uozaki, H., Okada, S., Misaka, T., Sato, T., Toh, H., Fukayama, M., Takeda, N., et al. (2010) Protective role of the leukotriene B4 receptor BLT2 in murine inflammatory colitis. FASEB J., 24, 4678–4690.
97) Ishii, Y., Saeki, K., Liu, M., Sasaki, F., Koga, T., Kitajima, K., Meno, C., Okuno, T., & Yokomizo, T. (2016) Leukotriene B4 receptor type 2 (BLT2) enhances skin barrier function by regulating tight junction proteins. FASEB J., 30, 933–947.
98) Matsumoto, Y., Matsuya, Y., Nagai, K., Amagase, K., Saeki, K., Matsumoto, K., Yokomizo, T., & Kato, S. (2020) Leukotriene B4 receptor Type 2 accelerates the healing of intestinal lesions by promoting epithelial cell proliferation. J. Pharmacol. Exp. Ther., 373, 1–9.
99) Liu, M., Saeki, K., Matsunobu, T., Okuno, T., Koga, T., Sugimoto, Y., Yokoyama, C., Nakamizo, S., Kabashima, K., Narumiya, S., et al. (2014) 12-hydroxyheptadecatrienoic acid promotes epidermal wound healing by accelerating keratinocyte migration via the BLT2 receptor. J. Exp. Med., 211, 1063–1078.
100) Iwamoto, S., Koga, T., Ohba, M., Okuno, T., Koike, M., Murakami, A., Matsuda, A., & Yokomizo, T. (2017) Non-steroidal anti-inflammatory drug delays corneal wound healing by reducing production of 12-hydroxyheptadecatrienoic acid, a ligand for leukotriene B4 receptor 2. Sci. Rep., 7, 13267.
101) Shigematsu, M., Koga, T., Ishimori, A., Saeki, K., Ishii, Y., Taketomi, Y., Ohba, M., Jo-Watanabe, A., Okuno, T., Harada, N., et al. (2016) Leukotriene B4 receptor type 2 protects against pneumolysin-dependent acute lung injury. Sci. Rep., 6, 34560.
102) Hori, T., Okuno, T., Hirata, K., Yamashita, K., Kawano, Y., Yamamoto, M., Hato, M., Nakamura, M., Shimizu, T., Yokomizo, T., et al. (2018) Na(+)-mimicking ligands stabilize the inactive state of leukotriene B4 receptor BLT1. Nat. Chem. Biol., 14, 262–269.
103) 堀哲哉,横山茂之(2019)ロイコトリエンB4受容体(BLT1)の結晶構造解析から明らかになった,ナトリウムイオン–水分子クラスターの機能を模倣する低分子化合物による不活性状態のGPCRの立体構造の安定化機構.生化学,91, 418–423.