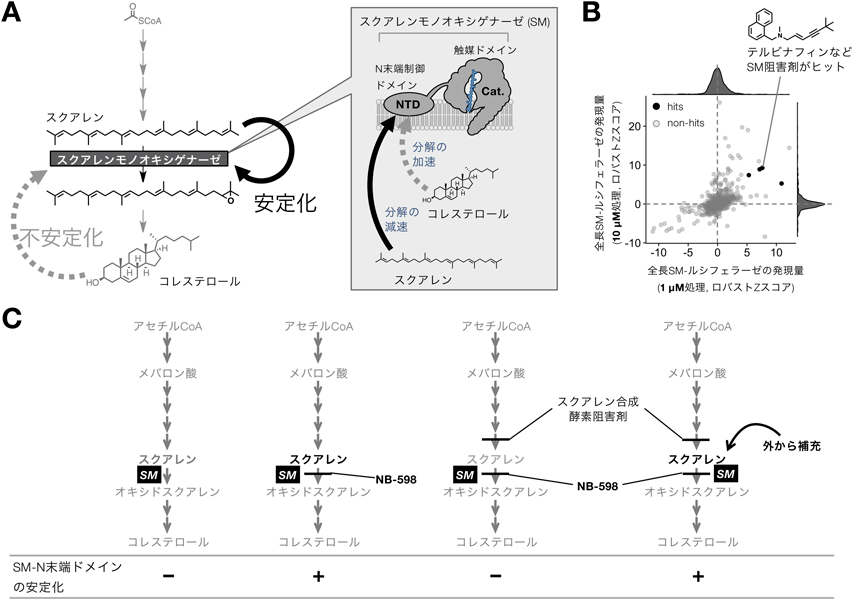
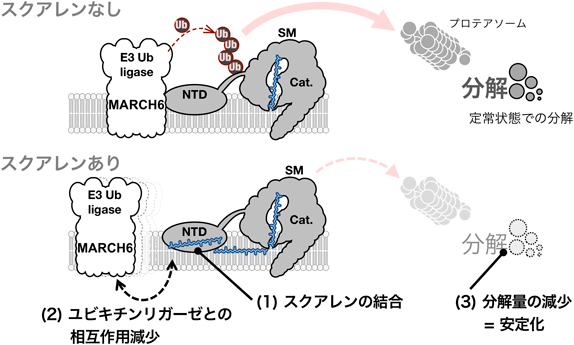
コレステロール生合成の新たな制御ポイント―スクアレンモノオキシゲナーゼの基質によるアロステリックな安定化―Allosteric stabilization of a key cholesterol biosynthetic enzyme squalene monooxygenase by its substrate
1 東京理科大学理工学部応用生物科学科Department of Applied Biological Science, Faculty of Science and Technology, Tokyo University of Science ◇ 〒278–8510 千葉県野田市山崎2641 ◇ 2641 Yamazaki, Noda, Chiba 278–8510, Japan
2 理化学研究所環境資源科学研究センターケミカルバイオロジー研究グループChemical Biology Research Group, Center for Sustainable Resource Science, RIKEN ◇ 〒351–0198 埼玉県和光市広沢2–1 ◇ 2–1 Hirosawa, Wako-shi, Saitama 351–0198, Japan