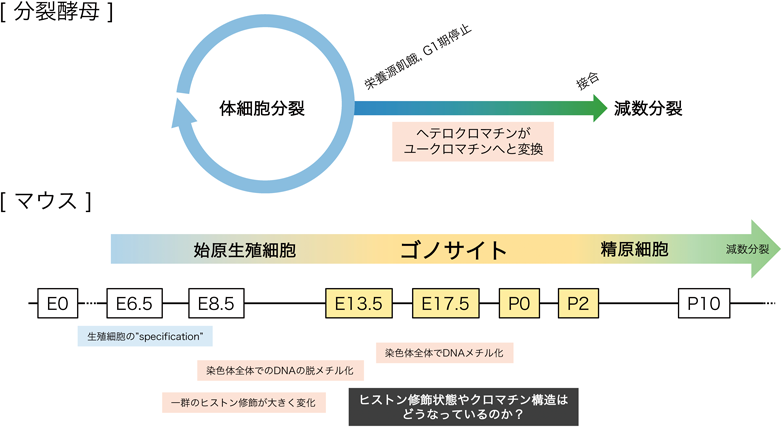
我々を構成する細胞のうち,次世代へと遺伝情報を受け渡す働きを持つのは唯一生殖細胞のみである.生殖細胞はジェネティックな遺伝情報だけでなく,“エピ”ジェネティックな遺伝情報も次世代へと受け渡す.生殖細胞におけるエピゲノムパターンはきわめて動的に変化し,特に,インプリンティング遺伝子に代表されるような遺伝子群におけるDNAメチル化パターンが生殖細胞において書き換わることが種の保持に必須である1).生殖細胞へと分化する段階でのクロマチンの大規模な構造および修飾の変化は,哺乳類以外の分裂酵母という減数分裂研究のモデル生物でも顕著である.分裂酵母は外界からの栄養源,特に窒素源が枯渇すると,異なる接合型を持った個体と接合し減数分裂へと移行する2).このように,非常に単純な誘導系で減数分裂が誘導できることから減数分裂研究においても広く利用されている.筆者は以前この分裂酵母を用いて,栄養源枯渇シグナルに応答したクロマチン変化を解析した.その研究から,体細胞条件下では,減数分裂期に発現が誘導されるような遺伝子上にヘテロクロマチンが形成されているのに対して,外界の栄養状態に応答してそのヘテロクロマチンが脱構築されることがわかった(図1上段)3).このように分裂酵母では,減数分裂に入る準備段階において,クロマチンがダイナミックに変化する.次に,このような現象がヒトやマウスなど高等真核生物においてもみられるかどうかを検証するために,マウスの生殖細胞を用いて実験を行うことにした4).
1)ゴノサイトの発生学的,ゲノム生物学的位置づけ
マウスの雄性生殖細胞の発生段階において,ゴノサイトと呼ばれる前駆細胞が精子幹細胞へと分化する.また,減数分裂に移行するのは精子幹細胞のうちの一部の集団である.そこで,分裂酵母で見いだしていたような,減数分裂に進行可能な細胞集団になるためのクロマチン変化が,このゴノサイトで起きているのではないかと考えた(図1下段).
ゴノサイトは雄特異的に出現する生殖細胞のある時期の集団を指す.受精後約6日目に出現する始原生殖細胞(primordial germ cell:PGC)はE13.5まで増殖を繰り返し,およそ10,000細胞に達する.その後,次第に細胞増殖を停止し,E17.5ではほぼすべての生殖細胞はG1/G0期で停止する.生後すぐ(P0)に生殖細胞は増殖を開始し,P2~P3から精子幹細胞の出現が観察される.ゴノサイトは上記のE13.5からP3あたりまでの雄性生殖細胞を指す5).
ゴノサイトはクロマチンという観点からもユニークな性質を持つ.PGCではおよそE7.5からゲノムワイドにDNAメチル化レベルが低下し,E13.5で最もメチル化レベルが低い状態になる.その後,ゴノサイトのE13.5からP0にかけて全ゲノムのDNAメチル化が確立する1).ゴノサイトにおける,この新規DNAメチル化が適切に起こらない変異体は,生育には支障がないものの,精巣において精子を作る精細管の構造に異常を来し,成熟した精子が形成されず,最終的には不稔の表現型を示す6).このように,ゴノサイトは発生学とゲノム生物学が密接に関係する非常に重要な細胞集団である.それにもかかわらず,一つの精巣あたり10,000細胞程度しか単離できないという細胞調製の困難さから,その詳細な解析は立ち遅れていた.そこで筆者らは少数細胞に対しても適用可能な手法を用いて,そのクロマチン状態を詳細に明らかにすることにした.
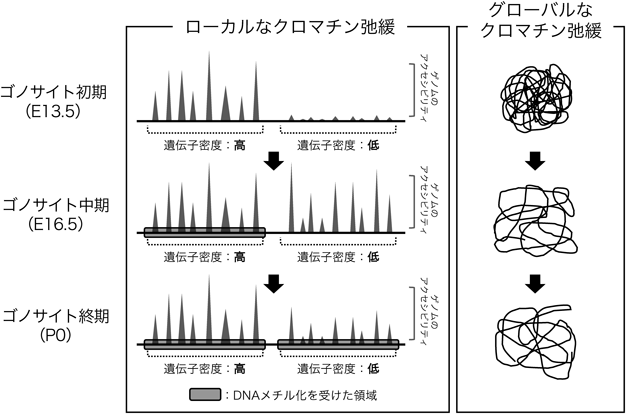
2)ゴノサイトではゲノムの14%もの領域が開いたクロマチン状態をとる
一般的にヘテロクロマチンは「閉じた」構造をとり転写活性は低いのに対して,ユークロマチンは「開いた」構造をとり,転写活性が高い.2013年にGreenleafとChangのグループによって開発されたATAC-seqは,クロマチンの開き具合(アクセシビリティ)をゲノム全体にわたって定量的に評価するための手法である7).この手法は単一細胞に対しても有効であるなど,生体に少数しか存在しない細胞群の解析に強い.そこでゴノサイトクロマチンの状態をATA C-seqによって経時的に解析した.その結果,ゲノム上の数Mbにわたる領域が一過的に開いたクロマチン構造をとっていた(図2).このようなダイナミクスを持つゲノム領域は以前に知られていなかったために,我々は上記の特性を持つ領域をdifferentially accessible domain(DAD)と名づけた.ある閾値に基づいて,ゲノム上の開いた構造をとる領域を探索し,マウス染色体上の計143の領域をDADとして同定した.これらの領域は大きく2種類に大別される.一つは,遺伝子密度が低い,いわゆる遺伝子砂漠,遺伝子間領域と呼ばれるゲノム領域である.もう一つは嗅覚受容体(olfactory receptor)遺伝子や鋤鼻受容体(vomeronasal receptor)遺伝子に代表されるような,特定の遺伝子が局所的にクラスター化した領域である.これらの領域は両者とも核膜付近でヘテロクロマチン状態にあることが示唆されている領域である.
3)DADは条件的ヘテロクロマチンである
ヘテロクロマチンには,細胞周期などに左右されず常にヘテロクロマチン状態にある恒常的ヘテロクロマチン(constitutive heterochromatin)と,栄養状態や発生など外界の状況に応じてユークロマチンへと動的に変化する条件的ヘテロクロマチン(facultative heterochromatin)が存在する.上述のように,DADは培養細胞を用いた実験ではヘテロクロマチン化した領域と考えられている.確かに,DADはゴノサイト初期(E13.5)では閉じた構造をとっている.それに対して,ゴノサイト中期(E16.5~P0)になるとこれらの領域は開いた構造になることから,ゴノサイト中期ではヘテロクロマチン状態がいったん解消されるのではないかと考えた.これを検証するために,ヘテロクロマチンの代表的な分子マーカーであるH3K9me3やH3K27me3に関してChIP-seqを行ったところ,E13.5のDAD領域で高レベル状態にあるものの,ゴノサイトの分化が進行するにつれてそれらのシグナルが低下することがわかった.さらに,転写活性と相関の高いH3K4me3に関してもChIP-seqを行った.その結果,上記のヘテロクロマチンマークとは逆に,ゴノサイト初期では低レベルに抑えられているのに対して,ゴノサイト中期においてDAD領域でシグナルが上昇した.上記の結果は,ゴノサイト初期でヘテロクロマチン状態にあったDADが,発生に伴ってユークロマチンへとその性状を変化させていることを示唆している.つまり,DADはゴノサイトにおいて条件的ヘテロクロマチンとして振る舞うことが明らかとなった.
4)DADには若いトランスポゾンが集積している
トランスポゾンやその残滓は,ヒトやマウスのゲノムのおよそ50%もの領域を占める8).マウスのトランスポゾンには多くの種類が存在することが知られ,たとえばSINEは遺伝子領域に濃縮して存在する.それに対して,LINE-1(L1)と呼ばれるトランスポゾンは遺伝子領域にはほとんど存在せず,遺伝子が比較的少ない領域に濃縮している8).このように,トランスポゾンの種類ごとにゲノム上の分布に違いがある.興味深いことに,遺伝子間領域に形成されるDADにおいて,一過的に開いた構造をとるクロマチン領域はトランスポゾンのプロモーター上に濃縮していた.さらに,クラスター化した遺伝子上にみられる開いたクロマチン領域も,クラスター化した遺伝子上ではなくその間隙に存在するトランスポゾン上にある.そこで,DADに含まれるトランスポゾンに関して解析を行ったところ,L1など複数のLTR型レトロトランスポゾンが,ゲノムの平均密度に比べて優位に濃縮しているのに対して,SINEはDAD領域にはあまり存在しないことが明らかとなった.
ゲノム上に存在する個々のL1やSINEは時間とともに変異を蓄積し,祖先型のものから配列的に大きく分岐することが知られている.その分岐の程度に従って,たとえばL1は古いタイプのものから,新しいタイプのものに段階的に分類される.ヒトとマウスのゲノム上に存在するL1には配列上似ているものも存在するが,種分化を起こして以降,L1の配列変化は個々の種で独立に起き,新しいL1の配列はヒトとマウスの間で違いが大きくなる.そこで,DADに濃縮しているL1がヒトのL1と相同性が高いのかを検証した.その結果,マウスがヒトと分岐したあとに現れた比較的新しいL1がDADに濃縮しているのに対して,ヒトと相同性が高い,古くから存在するL1はむしろDADにはほとんど存在しないことがわかった.上記の傾向は,遺伝子間領域に形成されるDADと,クラスター化した遺伝子領域に形成されるDADのどちらにも共通してみられる.つまり,DADは特定のトランスポゾンがゲノム上で濃縮した領域であることがわかった.
5)DADにおける新規メチル化は遅れて進む
前述のように,ゴノサイトは胎仔期に全染色体にわたって新規にメチル化を受ける.この新規のDNAメチル化は染色体で一様に進むわけではない9, 10).ゴノサイトの発生に従って経時的に行ったBisulfite-seqの結果から,遺伝子領域はゴノサイトの期間で徐々にメチル化が確立するのに対して,遺伝子間領域のメチル化はゴノサイト前期ではほとんど進まず,ゴノサイト後期で時期特異的に起きる.さらに,この新規DNAメチル化が遅れて起きる領域とDADはほぼ同様の領域であった.以上のことから,体細胞においてヘテロクロマチン化されている領域が生殖細胞において新規DNAメチル化を受ける際には,それに先駆けて当該領域がユークロマチン化して開いた構造をとることが明らかとなった.
6)ゴノサイトのゲノムは3次元的に再構成される
増殖を繰り返す細胞においてDNAメチル化レベルを維持することに,S期で形成される複製フォークが主要な働きを持つことが知られている11).複製フォークはヘテロクロマチン上も進行することから,ヘテロクロマチンにおけるDNAメチル化維持の際には複製フォークによる局所的な“クロマチンの緩み”が重要であることが示唆される.我々が見いだしてきた「DNAの新規メチル化」と「ヘテロクロマチンが開いた構造をとること」との関係性から,細胞周期停止を起こしている細胞でのDNAメチル化の誘導に,クロマチン弛緩が何らかの役割を担っていることが示唆される.一方で,ゲノムのユークロマチン領域における新規DNAメチル化はゴノサイトでいかにして誘導されるのだろうか.その手がかりを得るために我々は,ゴノサイトを用いて染色体の3次元構造を明らかにするHiC解析を行った.その結果,ゴノサイトの初期に形成されていた3次元構造がゴノサイト中期には大きく失われていることがわかった.さらに,ゴノサイト中期においては,3次元的な染色体間相互作用のつなぎ変えが頻繁に起こっていた.以上のことは,ゴノサイトにおいて新規DNAメチル化が起きている最中にゲノム全体が弛緩した状態をとっていることを示している.つまり,ゴノサイトにおいてはヘテロクロマチン領域が一過的な開いた構造をとることに加えて,染色体全体もきわめて弛緩した状態をとっていることがわかった.
7)本研究結果のまとめ
DNAメチル化酵素やヒストンメチル化酵素の多くはDNA結合ドメインを持たず,それらの相互作用因子を介して標的となる領域の特異性を獲得する.PIWI-piRNAによって誘導されるトランスポゾン上のDNAメチル化では,piRNAの配列相補性を利用して特異的にトランスポゾンを標的とすることが可能となる12).一方で,ゴノサイトにおけるDNAメチル化はほぼ全染色体にわたって起きることから,配列特異性を持たないメチル化誘導機構の存在が示唆される.また,新規DNAメチル化酵素であるDnmt3aはそれ自身にヘリカーゼ活性を持たず,さらにその相互作用因子としてDNAヘリカーゼも現在までに知られていない.つまり,ゴノサイトにおける新規DNAメチル化は複製フォークの移動のようにゲノムに対して効率的にシス方向に起きているとは考えづらい.興味深いことにlshというクロマチンリモデラーを変異させたマウスにおいては,クロマチンが高度に凝縮し,さらにそのDNAメチル化レベルが全染色体にわたって低下する13).これらの状況証拠から,ゴノサイトにおける全染色体上のメチル化形成には,Dnmt3aなどのDNAメチル化酵素の発現上昇だけでなく,その受け手となるクロマチンの状態変化が必須であることが示唆される.今回の我々の研究結果から,ゴノサイトクロマチンはローカルなヘテロクロマチン領域におけるアクセシビリティの上昇に加えて,染色体全体にわたる三次元的構造の弛緩が起きていることが明らかとなった(図2).これらの2段階の大規模なクロマチン弛緩が,おそらくDnmt3aなどの酵素がゲノムへと接近し,新規にDNAをメチル化することを容易にしていると考えられる.なお,本研究結果の紹介記事があり,そちらも参照されたい14).
卵子における新規DNAメチル化を引き起こす際に,以下のようなカスケードが働くことが明らかとなっている.まず最初に,転写の活発な遺伝子上にSetD2を介したH3K36me3が多く蓄積する.次に,Kdm1bによるH3K4meの脱メチル化が起きる.その後,上記のヒストン修飾変化が起きた領域において新規DNAメチル化が誘導される.これに対してゴノサイトにおいては,SetD2は新規DNAメチル化に影響を与えず,そのかわりNsd1がH3K36me2へのメチル化を誘導し,その領域での新規DNAメチル化の誘導を行う15).このようにゴノサイトで起きる核内イベントやそれが誘導する新規DNAメチル化機構が次第に明らかになりつつあるなど,近年ゴノサイトクロマチンの研究がいっそう盛んになってきている.
ゴノサイトは材料としての制限が多い細胞集団であり,さらに,その核で起きているイベントは非常にユニークである.1960年代に見いだされたゴノサイトの特異な細胞生物学的特徴として,細胞も核も肥大しているというものがある.さらに,エオシン染色をしたときに,核の染まりが弱いなど当該核が非常に緩んでいることが当時から示唆されていた16).このことは,今回の我々の論文でみてきた二段階のクロマチンの緩みがゴノサイトで起きているというシーケンス解析からの結果と符合する.上記のようなゴノサイト核のユニークさに加え,DNAメチル化の確立メカニズムのモデルシステムとしても,ゴノサイトは卵子と並んで重要なリソースといえる.また,ゴノサイトでのクロマチン成熟イベントの不具合が精子幹細胞のトランスクリプトーム形成に必須である17)など,その発生に対する影響は多角的である.今後,新規DNAメチル化の確立機構をはじめとしたゴノサイト核のユニークさを,分子レベルで記述するために解析を進めていきたい.