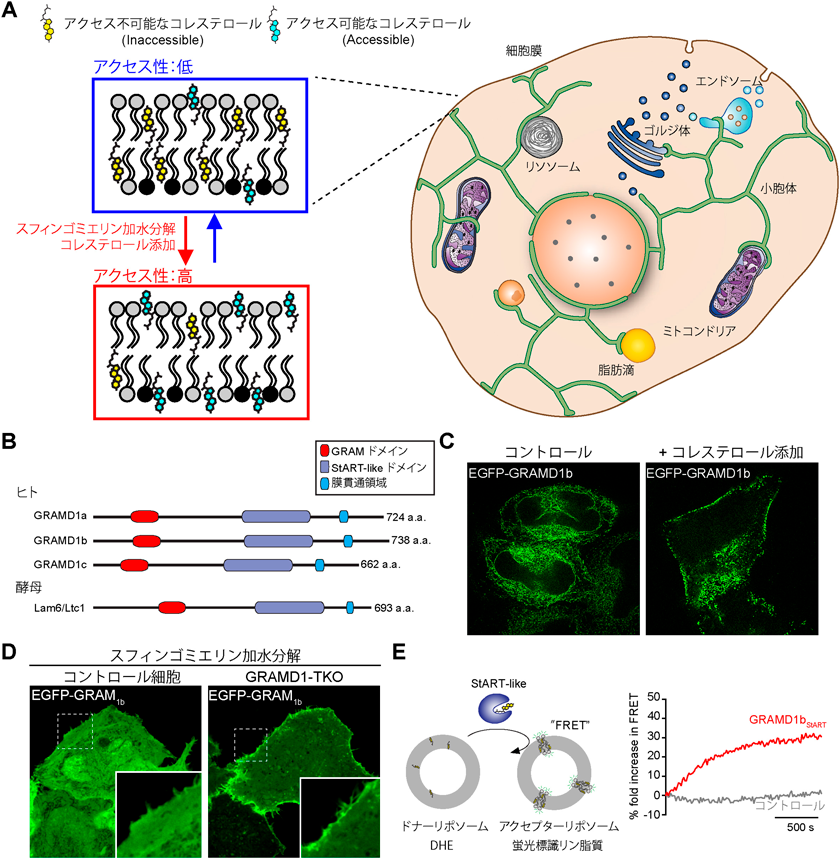
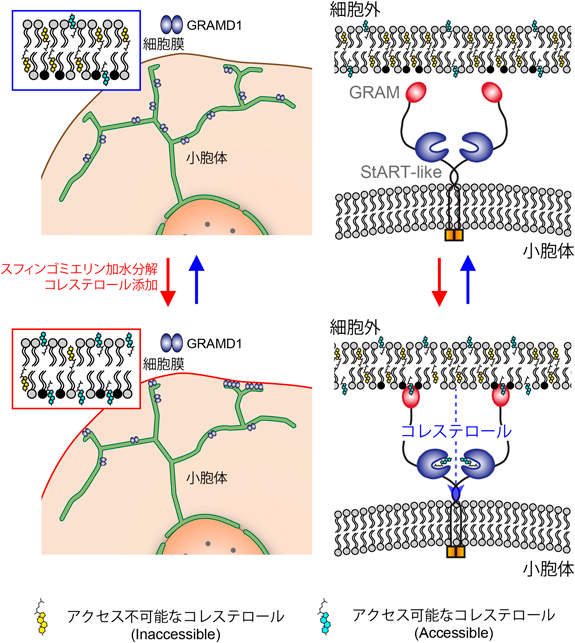
小胞体–細胞膜接着部位におけるコレステロール輸送Movement of accessible cholesterol at endoplasmic reticulum (ER)-plasma membrane (PM) contact sites
Lee Kong Chian School of Medicine, Nanyang Technological University, Singapore Cell Biology and Molecular Neuroscience Laboratory, Lee Kong Chian School of Medicine ◇ 11 Mandalay Road, Singapore 308232