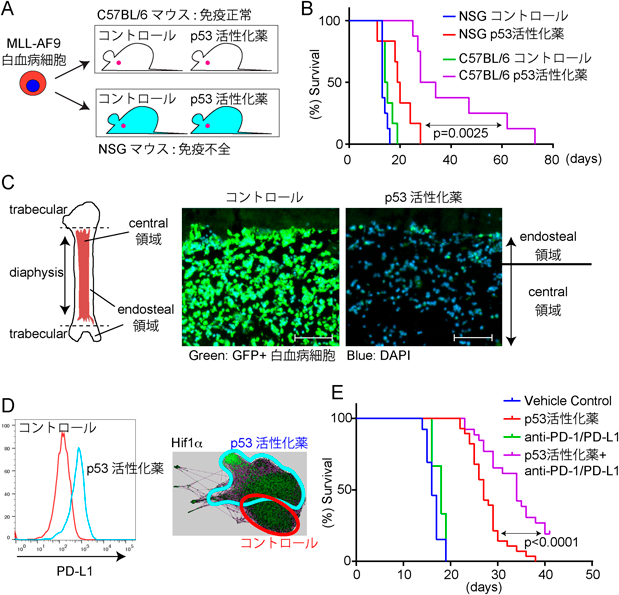
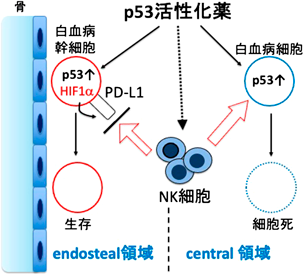
がん幹細胞と腫瘍免疫Cancer stem cells and tumor immunity
東京大学大学院新領域創成科学研究科 先進分子腫瘍学Division of Molecular Oncology, Graduate School of Frontier Sciences, The University of Tokyo ◇ 〒108–8639 東京都港区白金台4–6–1 2号館2F ◇ 4–6–1 Shirokanedai, Minato-ku, Tokyo 108–8639, Japan