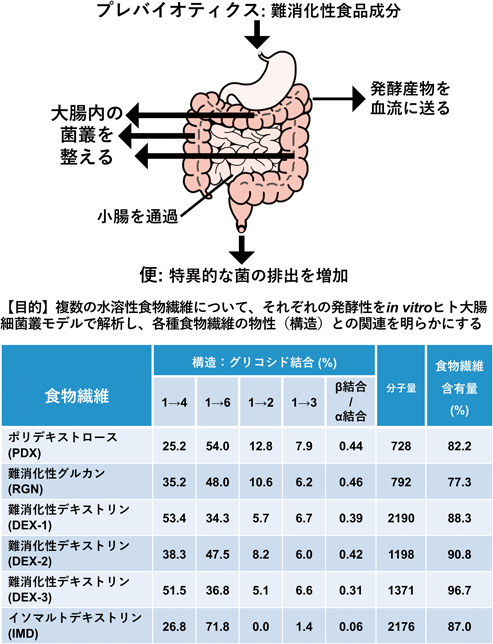
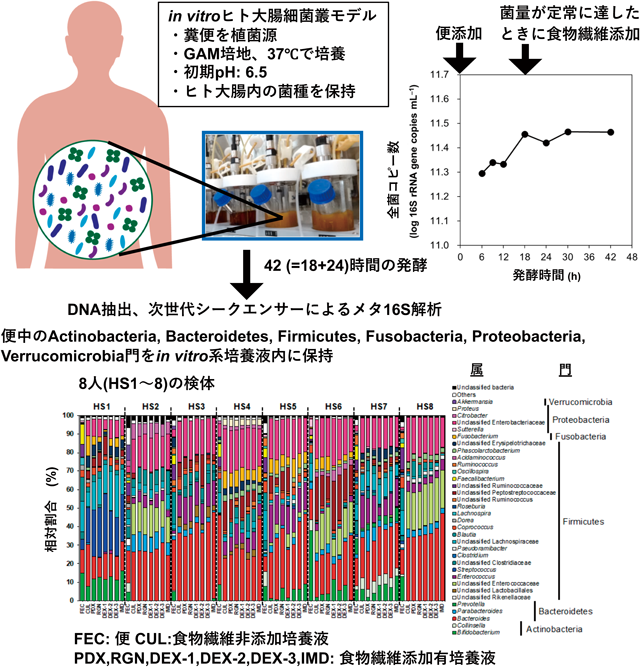
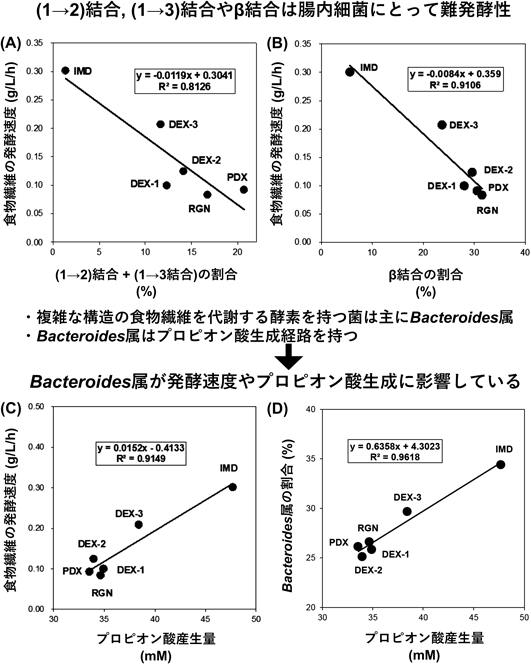
in vitroヒト大腸細菌叢モデルによる構造の異なる食物繊維の発酵性評価法Evaluation of dietary fibers by in vitro human colonic microbiota model
神戸大学大学院科学技術イノベーション研究科Graduate School of Science, Technology and Innovation, Kobe University ◇ 〒657–8501 兵庫県神戸市灘区六甲大町1–1 ◇ 1–1 Rokkodai-cho, Nada-ku, Kobe, Hyogo 657–8501, Japan