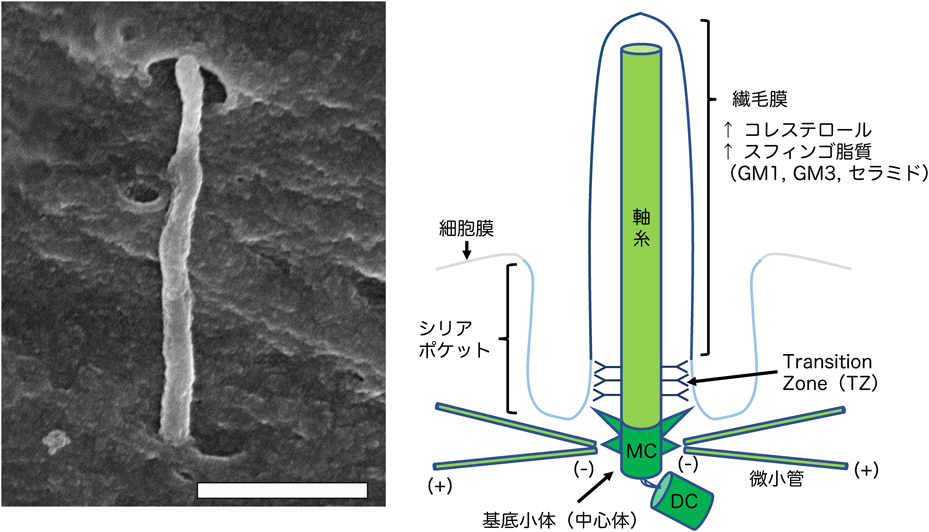
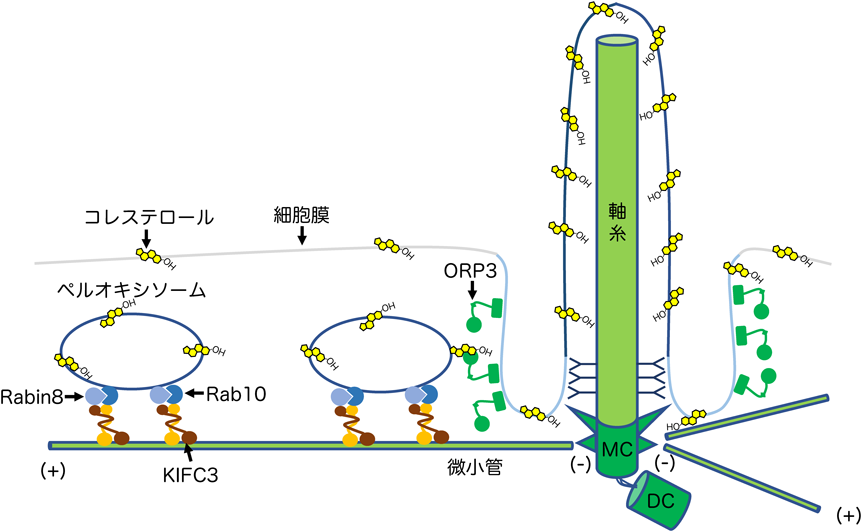
コレステロール欠乏による繊毛病の発症機構Insufficiency of ciliary cholesterol underlying ciliopathies
広島大学原爆放射線医科学研究所放射線ゲノム疾患研究分野Department of Genetics and Cell Biology, Research Institute for Radiation Biology and Medicine, Hiroshima University ◇ 〒734–8553 広島県広島市南区霞1–2–3 ◇ 1–2–3 Kasumi, Minami-ku, Hiroshima 734–8553, Japan