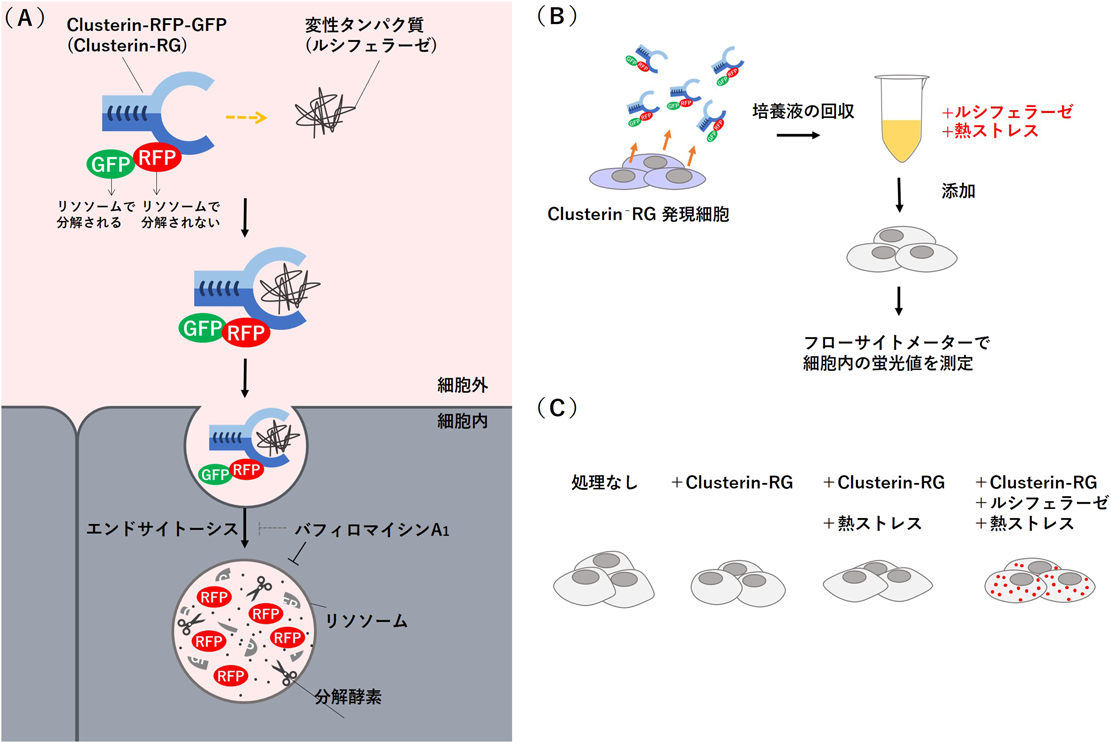
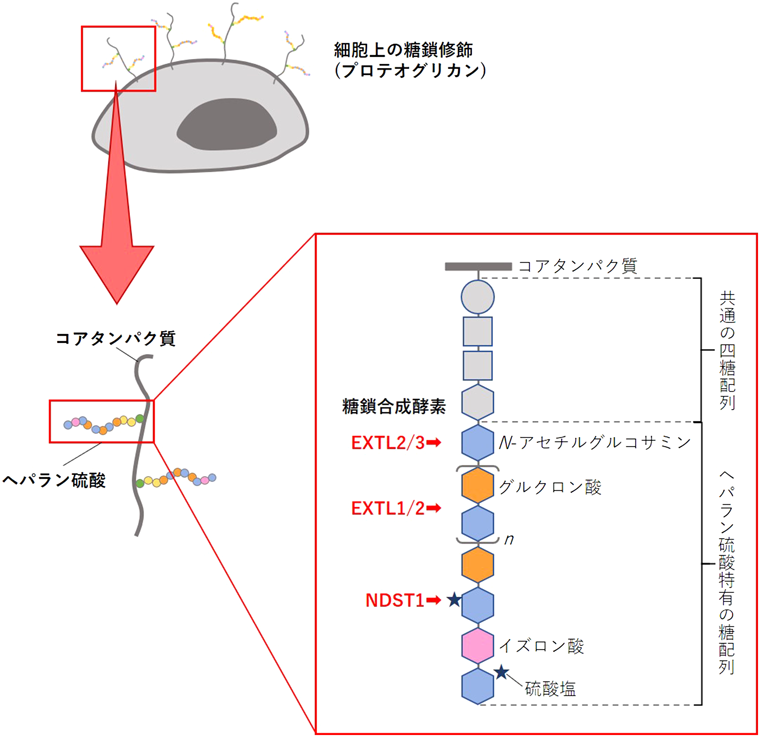
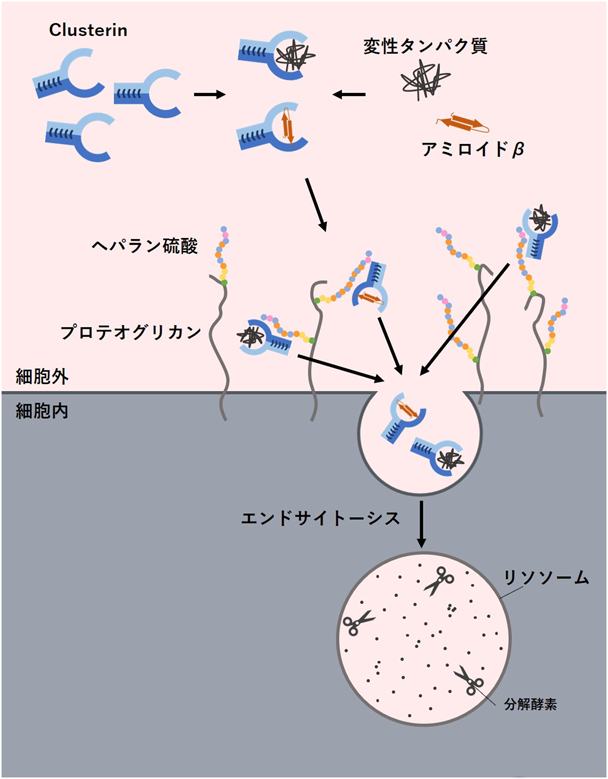
細胞外シャペロンClusterinによる細胞外タンパク質の分解機構The extracellular chaperone Clusterin-mediated extracellular protein degradation system
1 千葉大学理学部生物学科Department of Biology, Faculty of Science, Chiba University ◇ 〒263–8522 千葉県千葉市稲毛区弥生町1–33 ◇ 1–33 Yayoi, Inage-ku, Chiba 263–8522, Japan
2 千葉大学大学院理学研究院生物学研究部門Chiba, Department of Biology, Graduate School of Science, Chiba University ◇ 〒263–8522 千葉県千葉市稲毛区弥生町1–33 ◇ 1–33 Yayoi, Inage-ku, Chiba 263–8522, Japan