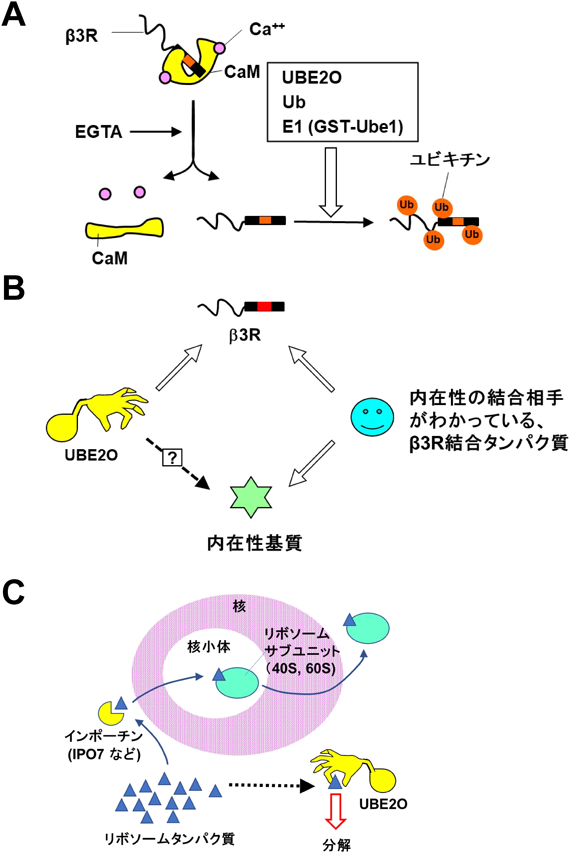
みなしごタンパク質の品質管理機構A quality control factor for orphan proteins
九州大学生体防御医学研究所,MRC分子生物学研究所Medical Institute of Bioregulation, Kyushu University/MRC Laboratory of Molecular Biology ◇ 〒812–8582 福岡県福岡市東区馬出3–1–1 ◇ 3–1–1 Maidashi, Higashi-ku, Fukuoka 812–8582, Japan