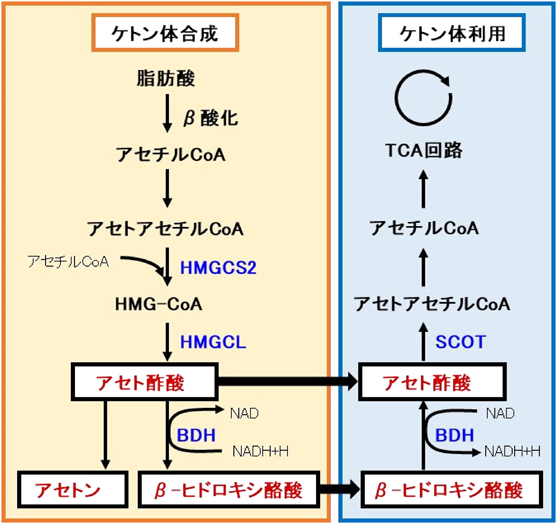
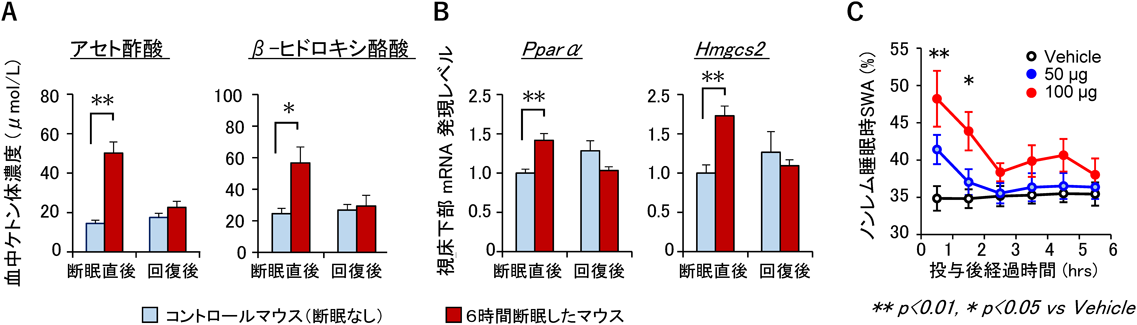
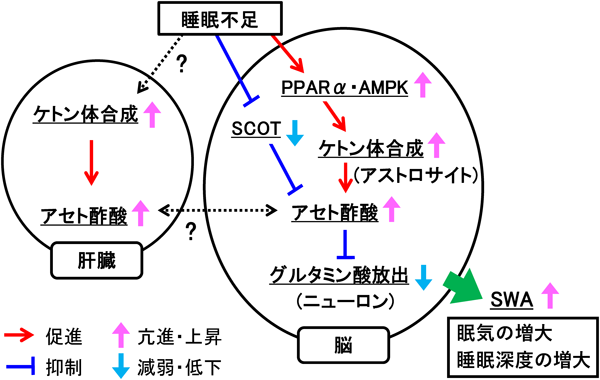
睡眠調節と脳内ケトン体代謝の関連性についてRelationship between sleep regulation and ketone bodies in the brain
徳島大学大学院医歯薬学研究部統合生理学分野Department of Integrative Physiology, Institute of Biomedical Sciences, Tokushima University Graduate School ◇ 〒770–8503 徳島県徳島市蔵本町3–18–15 ◇ 3–18–15 Kuramoto-cho, Tokushima 770–8503, Japan