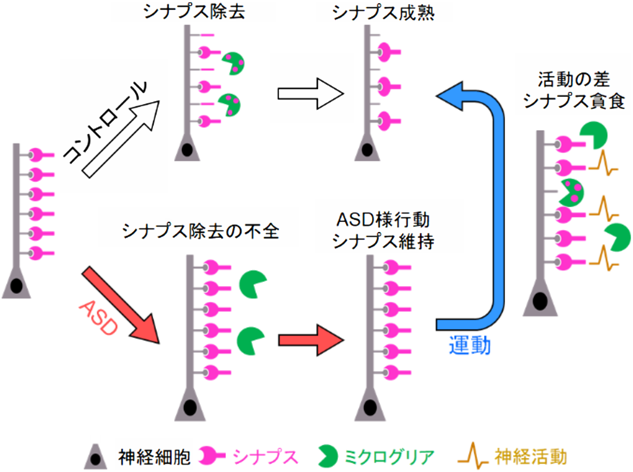
ミクログリアによる脳の恒常性維持とその破綻としての脳疾患Brain diseases as disruption of microglia-mediated brain homeostasis
東京大学大学院薬学系研究科薬品作用学教室Laboratory of Chemical Pharmacology, Graduate School of Pharmaceutical Sciences, The University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1 ◇ 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–0033, Japan