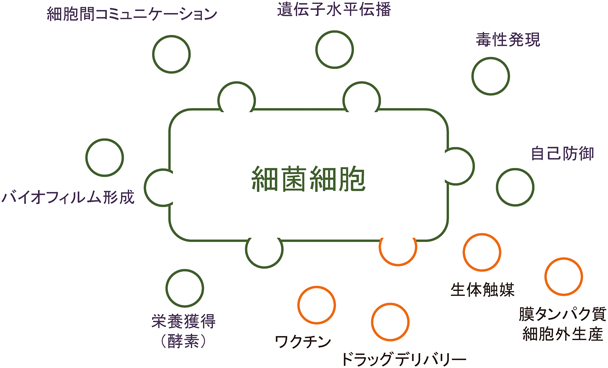
細胞外膜小胞の生産は細菌に普遍的に備わった性質であり,その生理機能は多岐にわたる(図1)1, 2).細胞間コミュニケーション,遺伝子水平伝播,病原性細菌の毒性発現,バイオフィルム形成,自己防御など,多様な機能を担っている.一方,膜小胞は応用研究においても重要な研究対象であり,特にワクチンとしての利用,ドラッグデリバリーにおけるキャリアとしての利用,生体触媒の足場としての利用などが期待されている(図1)3–5).
グラム陰性細菌では,多くの場合,外膜からの出芽によって膜小胞が形成される1, 6).グラム陰性細菌の細胞表層には内膜,ペプチドグリカン,外膜があり,外膜の内葉はリン脂質,外葉はリポ多糖が主成分となっている.外膜とペプチドグリカンの間にはタンパク質性の架橋があるが,膜小胞の形成では,この架橋が切断された部位,あるいは架橋がもともと存在しない部位で外膜が外側に膨らみ,膜小胞が生成すると考えられている1, 3).この他,細胞の破裂を伴って膜小胞が生成する機構も知られている7).
膜小胞は20 nmから250 nm程度の直径であることが多く,グラム陰性細菌の外膜に由来する場合,膜の外葉はリポ多糖,内葉はリン脂質が主成分となる1, 3, 6).細胞の破裂を伴う膜小胞生成の場合,外膜と内膜の両方に由来する二重の膜構造を有する膜小胞も生成することが知られている6).内容物としては,さまざまなタンパク質の他,DNAやRNAが含まれることもある6).
このような膜小胞の形成機構や,特定の分子が膜小胞に積み込まれる機構については多くのグループが精力的に研究を進めており1, 6, 8),その研究ツールの開発も行われているが9),本稿では,特定のタンパク質が膜小胞に輸送されるメカニズムについて,我々のグループの最近の成果を紹介する.
我々は,異種タンパク質の分泌生産系構築に適した微生物を自然界から取得することを目的としてスクリーニングを実施し,その過程で,きわめて純度の高い分泌タンパク質を著量生産するグラム陰性細菌Shewanella vesiculosa HM13をアジの腸内容物から見いだした10).本菌の培養上清をSDS-PAGEで分析すると,ほぼ単一のタンパク質(約49 kDaの分子質量に基づいてP49と命名)のバンドが観察された.この分泌機構を利用することで高純度の外来タンパク質を分泌生産する系の構築が可能になることが期待された.
本菌の全ゲノム配列の解析とP49のN末端アミノ酸配列の解析によってP49の一次構造を推定した結果,P49は473アミノ酸残基の前駆体から,N末端22残基のシグナルペプチドが切除されて成熟体になると推定された10).一方,顕著な相同性を持つ機能既知のホモログはデータベースに見いだされず,配列からの機能推定は困難であった.次に配列に基づいた局在性予測を行ったところ,P49の外膜への局在性が示唆された.培養上清に分泌されたP49について外膜への局在性が予測されたという結果は,P49が細胞外膜小胞に存在する可能性を示唆するものと考えられた.
そこで,培養上清をショ糖密度勾配超遠心で分画し,P49が回収された画分の電子顕微鏡観察を行ったところ,直径50 nm程度の大きさのそろった膜小胞が多数観察された(図2)10).また,P49のプロテアーゼ感受性試験を行ったところ,界面活性剤非存在下ではトリプシン耐性があり,膜小胞構造を破壊すると考えられる界面活性剤処理でトリプシン感受性となることが見いだされた.これらの結果から,P49は膜小胞に存在するものと考えられた.
さらに静置培養した本菌の細胞表層を電界放出型走査電子顕微鏡(FE-SEM)で観察したところ,多数の膜小胞が出芽している様子がみられた(図2)10).本菌の膜小胞生産性をさまざまな細菌と比較した結果,近縁のShewanella属細菌や,本菌と同じγプロテオバクテリアであるEscherichia coliやPseudomonas putidaと比べて顕著に高い生産性が認められた.
特定のタンパク質を大量に含む膜小胞(図2)を高生産するという性質は,膜小胞形成機構の解析や積荷タンパク質輸送機構の解析に有用と考えられ,また,タンパク質の細胞外生産場として膜小胞を開発する上でも本菌は利用価値が高いと考えられた.そこで,そのような応用開発も視野に入れ,本菌における膜小胞の特性解析や形成機構の解析,特に特定のタンパク質が膜小胞に輸送されるメカニズムの解析に取り組んだ.
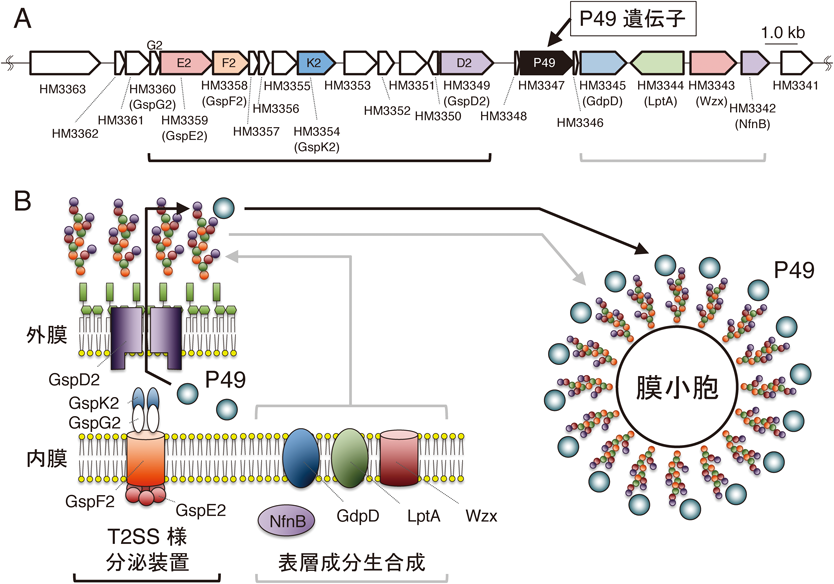
細菌では,機能的に関連のある遺伝子群がゲノム上でクラスターを形成していることが多い.そこでP49遺伝子周辺にP49の膜小胞輸送に関与する遺伝子群が存在する可能性を考えて解析を進めた11).全ゲノム解析の結果,P49遺伝子上流にはII型分泌装置(T2SS)サブユニットのホモログをコードする遺伝子群が存在することが明らかとなった(図3A).T2SSはグラム陰性細菌において,ペリプラズムから細胞外へのタンパク質移行を担う装置であり12),これらの遺伝子群がP49の細胞外への移行に関与する可能性が考えられた.一方,P49遺伝子の下流には,糖脂質や多糖の生合成に関与するWzxのホモログをコードする遺伝子など,表層成分生合成への関与が示唆される遺伝子群が見いだされた(図3A).これらの遺伝子群にコードされるタンパク質群によって生合成される表層成分が,P49と膜小胞の相互作用に関与する可能性が考えられた.
そこで,これらの遺伝子を破壊し,P49局在性への影響を解析した11).それぞれの遺伝子を破壊した変異株,および野生株を培養後,細胞画分,膜小胞画分,膜小胞を除去した培養上清画分[post-vesicle fraction(PVF)画分]に分画し,各画分中のP49をウエスタンブロット法で分析した.その結果,野生株においては,膜小胞と細胞の両方にP49が存在するのに対し,遺伝子破壊株については,P49が膜小胞から消失して細胞に残る「細胞局在型変異株」と,膜小胞と細胞の両方からP49がほとんど消失し,PVFに著量のP49が現れる「PVF局在型変異株」の二つに分類された.
T2SS様分泌装置をコードすると推定された遺伝子群(gspD2, gspK2, gspF2, gspE2)の破壊株は「細胞局在型変異株」であった.この結果から,これらの遺伝子群がコードするT2SS様分泌装置がP49の細胞外への移行を担うものと考えられた(図3B).本菌はこの遺伝子クラスターとは別に,グラム陰性細菌に広くみられる典型的なT2SSをコードする遺伝子クラスターも有しており10),P49遺伝子近傍の遺伝子群がコードするT2SS様分泌装置は,P49の輸送に特化した装置であることが示唆された.
一方,表層成分生合成への関与が示唆された遺伝子群(gdpD, lptA, wzx, nfnB)を破壊した変異株ではP49はPVFに局在した.これらの変異株では,P49はT2SS様分泌装置で細胞外に移行するが,膜小胞とも細胞とも相互作用できないと考えられた.すなわち,野生株においては,これらの遺伝子群に依存して作られる表層成分との相互作用によって,P49が膜小胞や細胞に積み込まれることが示唆された(図3B).上述のように,Wzxは表層多糖の生合成に関与することが知られている13).グラム陰性細菌の細胞表層にみられるリポ多糖のO抗原多糖や莢膜多糖の生合成初期段階は,内膜にアンカリングされたウンデカプレニル基を足場として進行する.細胞質側で3~8個程度の糖が重合した段階で,この糖鎖が細胞質側からペリプラズム側にフリップし,さらなる重合反応や細胞表層への移行反応が進行する.Wzxは,この細胞質側からペリプラズム側へのフリップ反応を担う.このことから,P49遺伝子近傍の遺伝子群が,リポ多糖のO抗原多糖や莢膜多糖の生合成に関与する可能性が考えられた.そこでまず,本菌のリポ多糖の解析を行ったところ,細胞と膜小胞のいずれについてもリポ多糖がリピドAとコアオリゴ糖のみを持つことが示され,O抗原多糖を有するリポ多糖は見いだされなかった14, 15).したがって,Wzxが生合成に関与する表層成分としては,O抗原多糖ではなく,莢膜多糖のような多糖を想定することが妥当と考えられた.実際,本菌がリポ多糖とは異なる表層多糖を生合成することや,その生合成がWzx欠損で阻害されることを示唆する結果が得られつつある(未発表データ).
以上の結果から,P49は(i)N末端シグナルペプチド依存的にペリプラズムに移行した後,(ii)P49遺伝子クラスターがコードするT2SS様分泌装置の働きで細胞外に移行し,(iii)P49遺伝子クラスターがコードするタンパク質群によって生合成される表層多糖との相互作用によって細胞および膜小胞の表層に結合するものと考えられた(図3B).このメカニズムは,精製P49と膜小胞を用いたin vitro積み込み実験でも支持されており(未発表データ),現在,積み込みに関与する多糖の構造解析,糖鎖と相互作用するタンパク質領域の同定などを進めている.
細菌の細胞外膜小胞は機能性ナノ粒子開発におけるプラットフォームや,膜タンパク質などさまざまな物質の細胞外生産場として注目される.たとえば,多段階反応を触媒する酵素群の集積発現によって新たな生体触媒を開発することに道が拓かれるものと期待される.また,膜小胞上に種々の抗原を提示することによって,望ましい免疫原性を有したワクチンの開発につなげることも可能になると期待される.このような応用展開を目指す上でも,本稿で紹介したような特定のタンパク質が膜小胞に輸送されるメカニズムを明らかにすることは重要と考えられる.膜小胞への輸送機構は積荷タンパク質の種類によって異なると考えられ,個々のタンパク質がどのような機構で膜小胞に取り込まれるのか明らかにしていくことが必要である.一方,膜小胞の膜構造形成や生産制御の仕組みに関する研究も活発に行われており,今後,それらの成果に基づいて膜小胞生産や機能発現の分子基盤に関する理解が深まり,応用開発にもつながることが期待される.