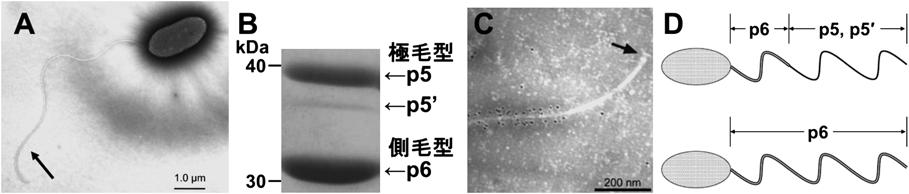
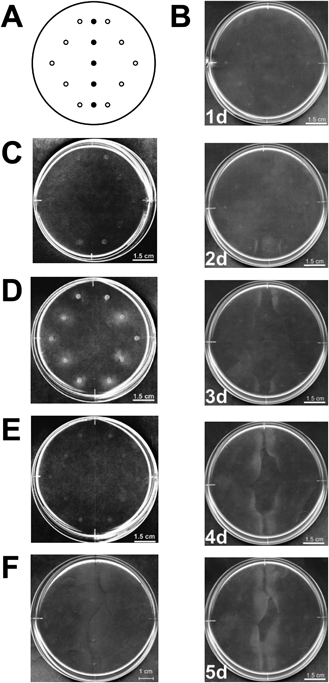
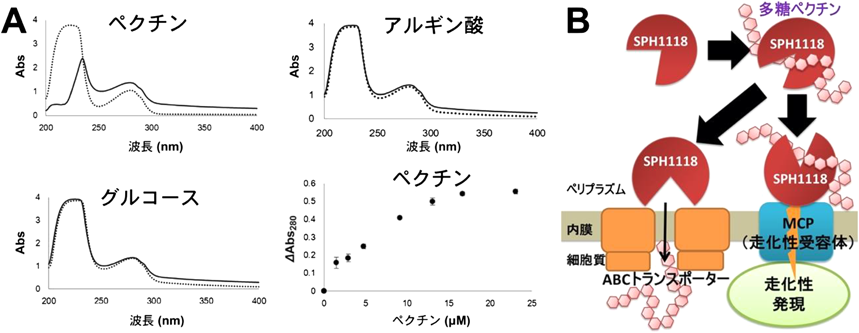
細菌が高分子多糖に走化性を示す分子機構Molecular mechanism for bacterial chemotaxis toward polysaccharides
1 京都大学農学研究科Graduate School of Agriculture, Kyoto University ◇ 〒611–0011 京都府宇治市五ヶ庄 ◇ Gokasho, Uji, Kyoto 611–0011, Japan
2 京都大学名誉教授Emeritus Professor of Kyoto University
3 石川県立大学生物資源工学研究所Research Institute for Bioresources and Biotechnology, Ishikawa Prefectural University ◇ 〒921–8836 石川県野々市市末松1丁目308番地 ◇ 1–308 Suematsu, Nonoichi, Ishikawa 921–8836, Japan