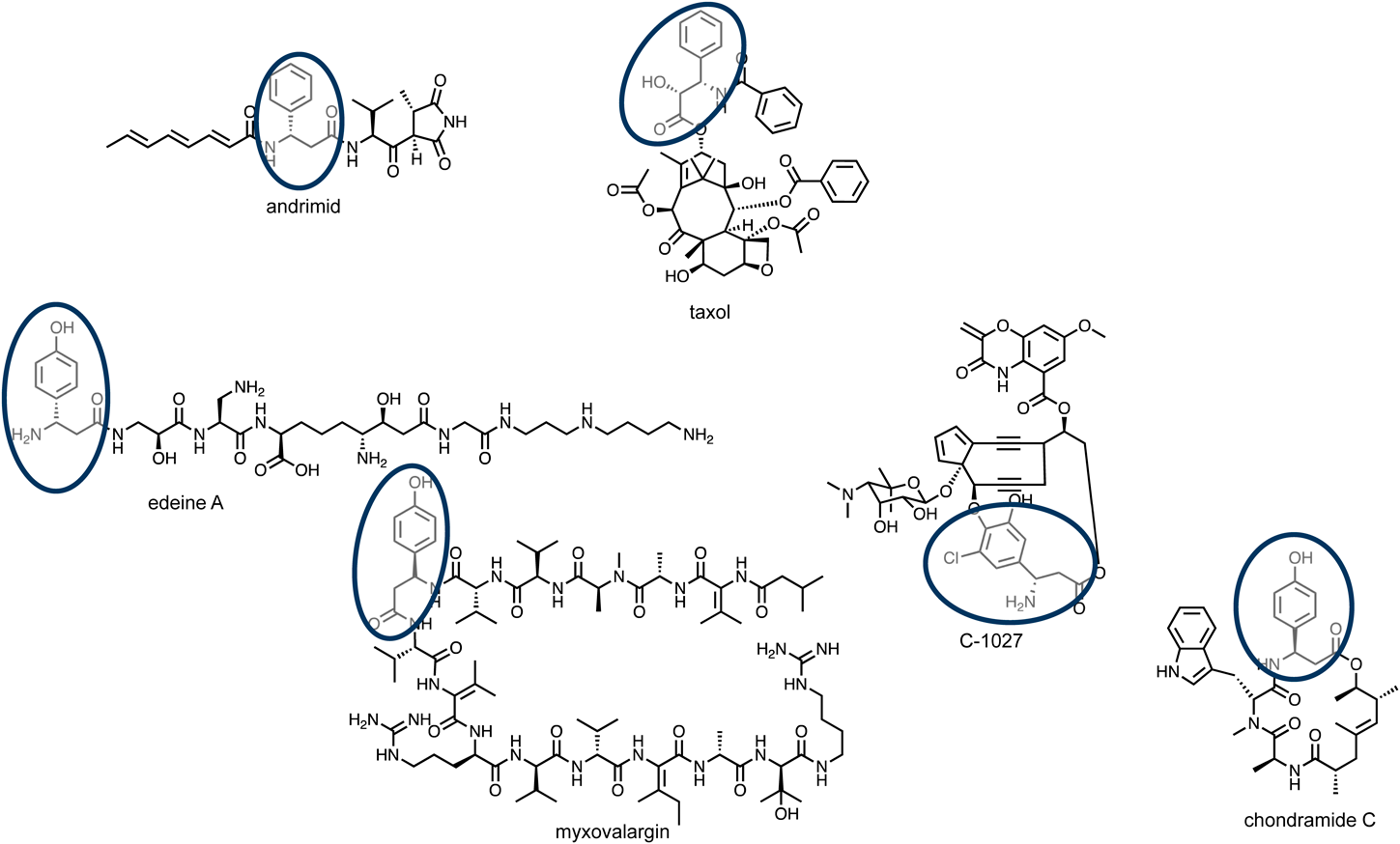
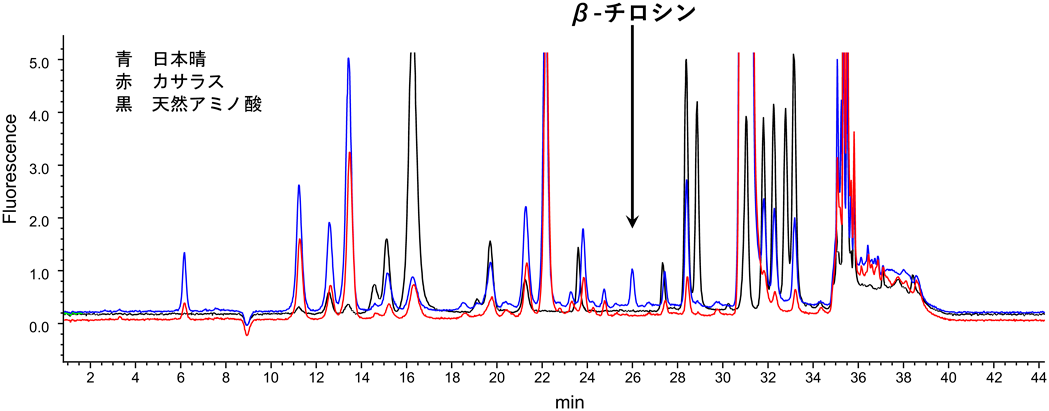
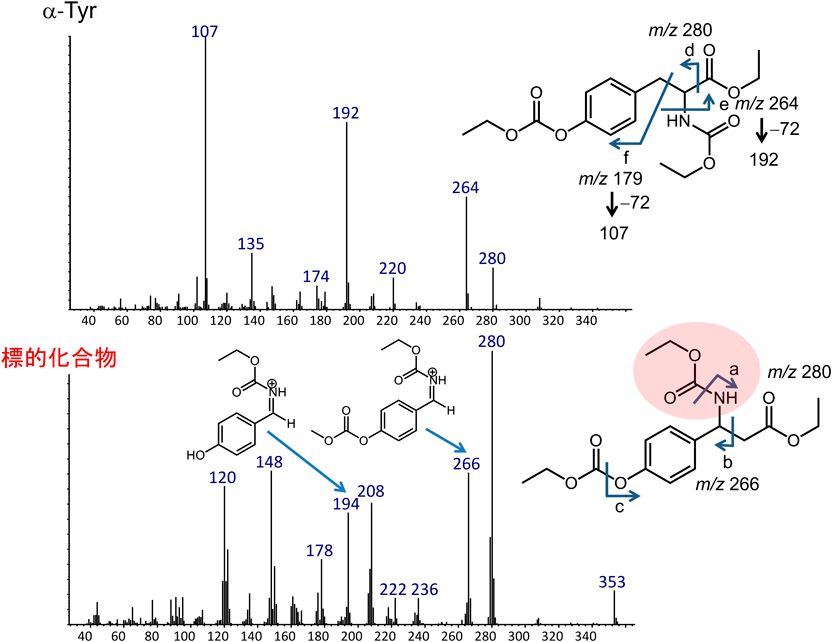
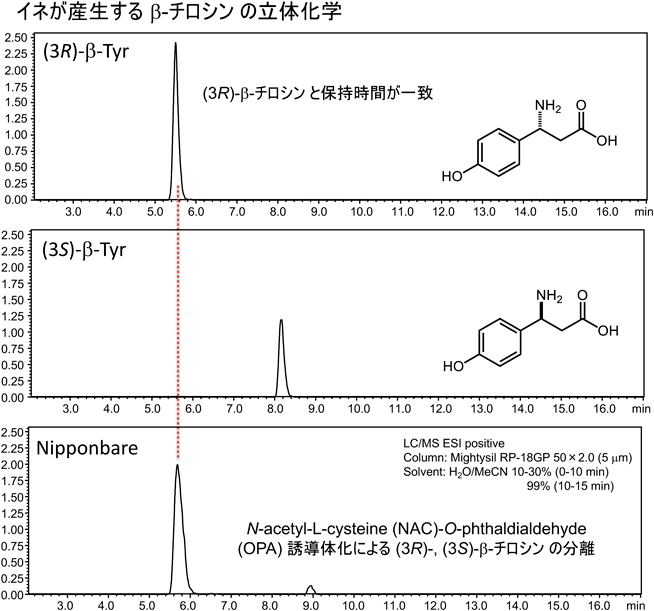
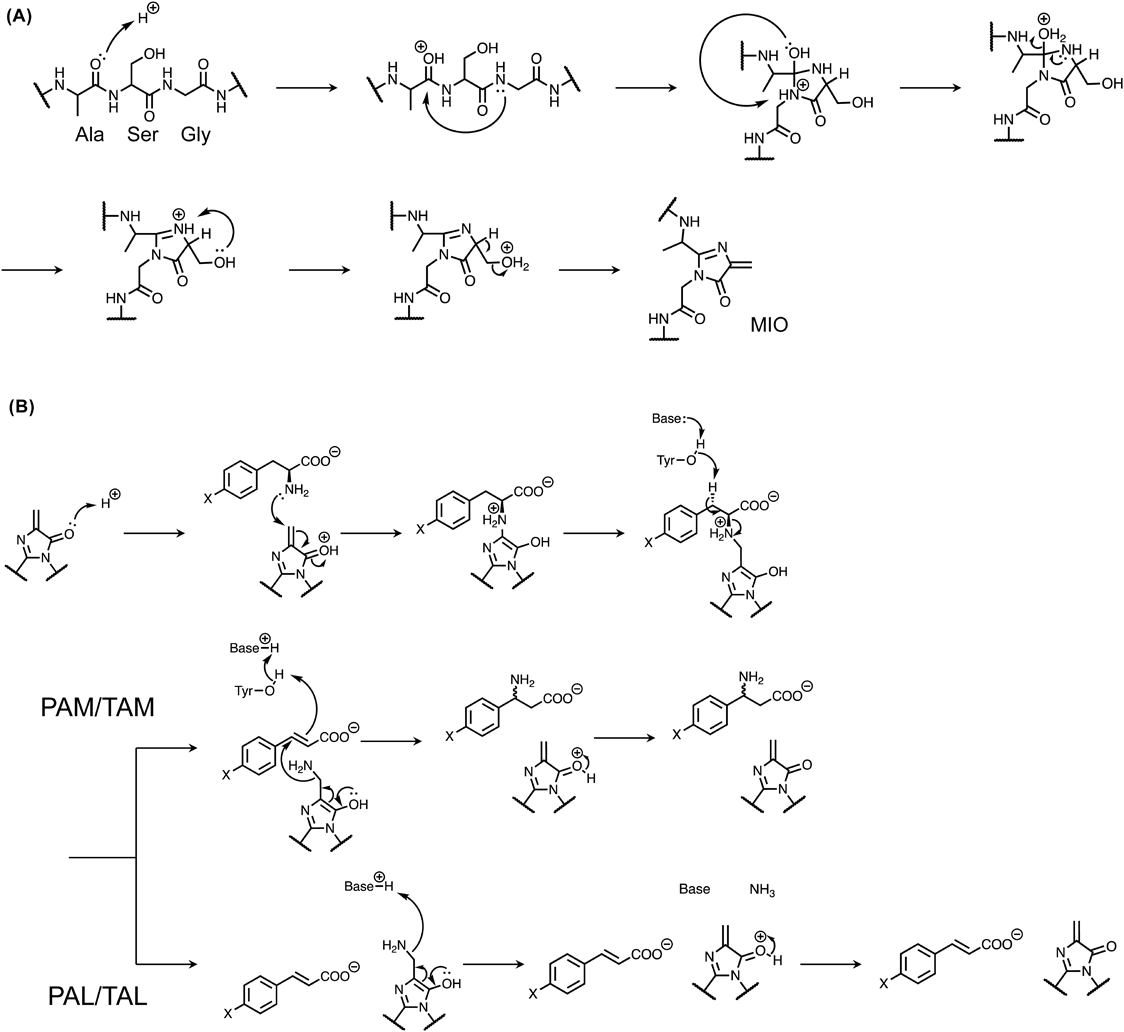
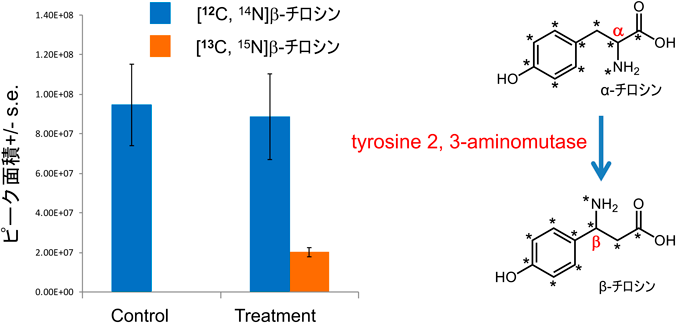
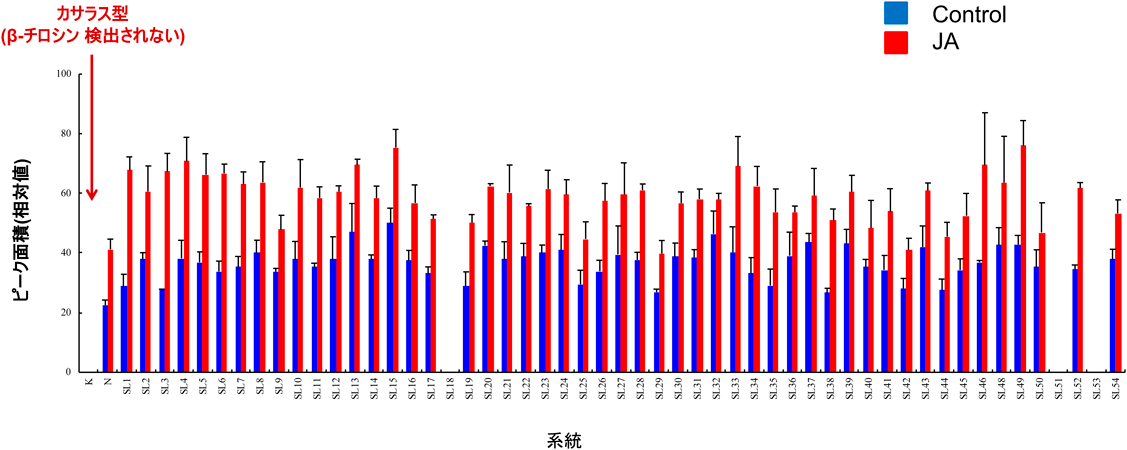
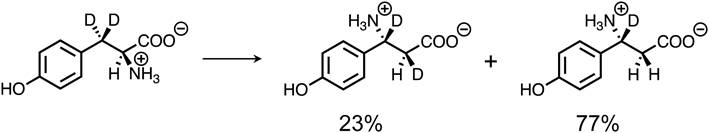
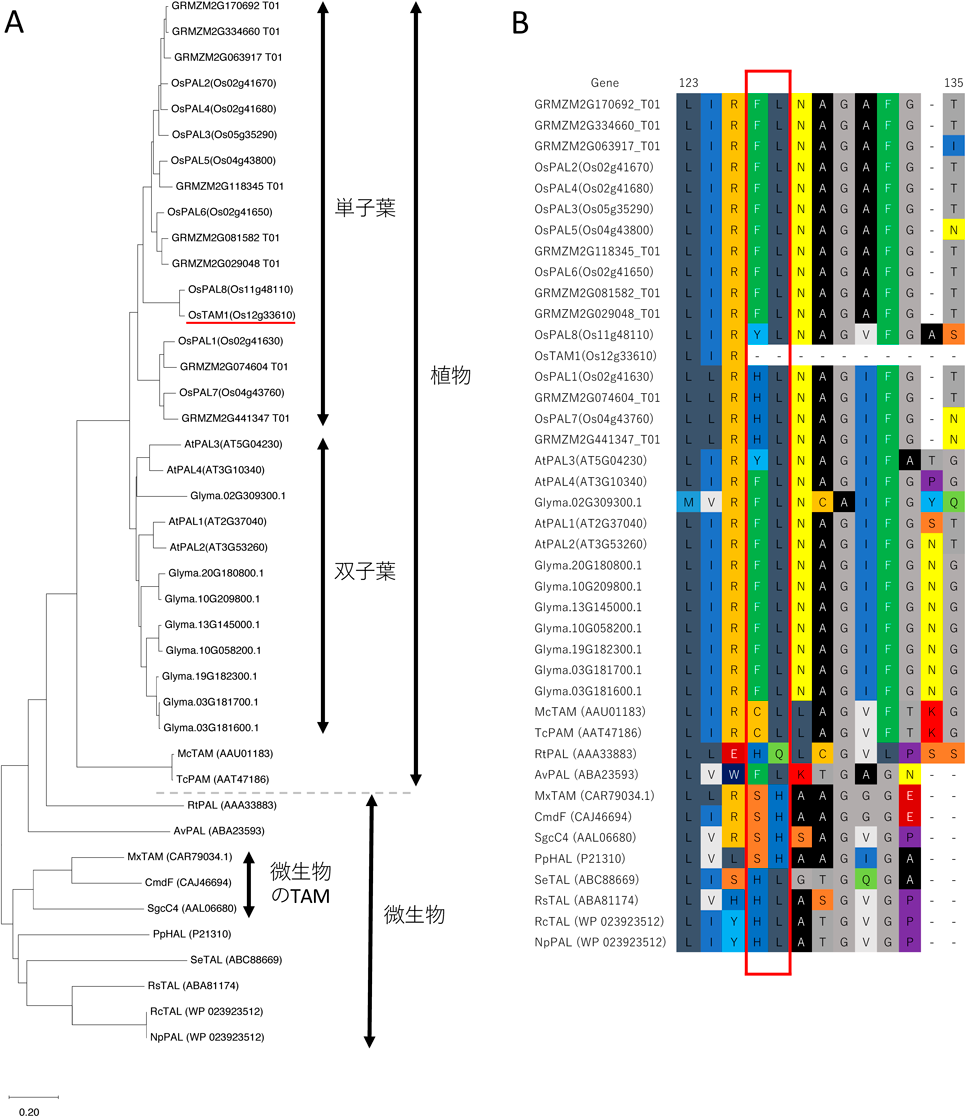
イネ(日本晴)における(3R)-β-チロシンの生合成The tyrosine aminomutase TAM1 for β-tyrosine biosynthesis in rice (Nipponbare)
1 京都大学大学院農学研究科応用生命科学専攻Applied Life Sciences, Graduate School of Agriculture, Kyoto University ◇ 〒606–8502 京都市左京区北白川追分町 ◇ Kitashirakawa-Oiwake, Sakyo, Kyoto 606–8502, Japan
2 山形大学農学部植物機能開発学コースCourse of Plant Functional Development, Faculty of Agriculture, Yamagata University ◇ 〒997–0037 山形県鶴岡市若葉町1–23 ◇ 1–23 Wakaba-cho, Tsuruoka City, Yamagata 997–0037, Japan
3 京都大学大学院農学研究科農学専攻Department of Agriculture, Graduate School of Agriculture, Kyoto University ◇ 〒606–8502 京都市左京区北白川追分町 ◇ Kitashirakawa-Oiwake, Sakyo, Kyoto 606–8502, Japan
4 摂南大学農学部農業生産学科Department of Agricultural Production, Faculty of Agriculture, Setsunan University ◇ 〒573–0101 大阪府枚方市長尾峠町45–1 ◇ 45–1 Nagaotoge-cho, Hirakata, Osaka 573–0101, Japan