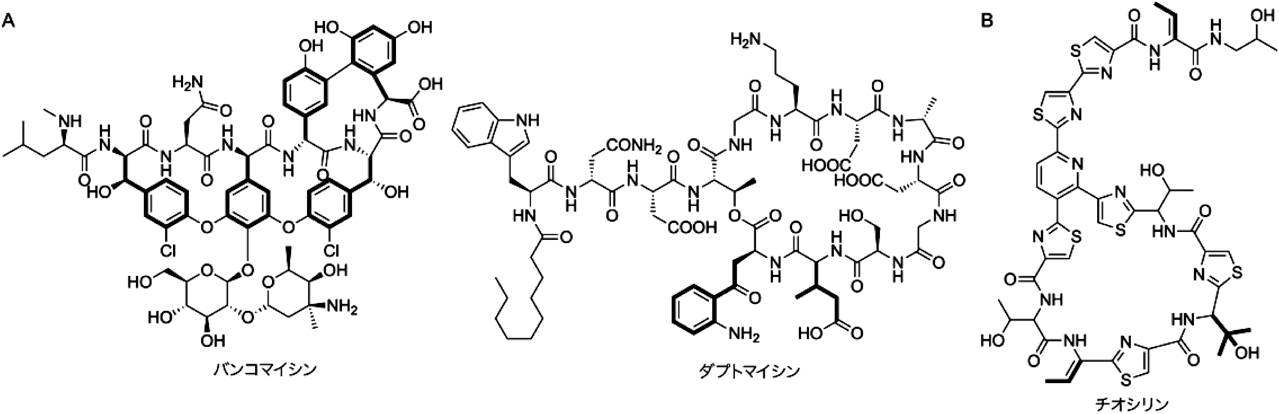
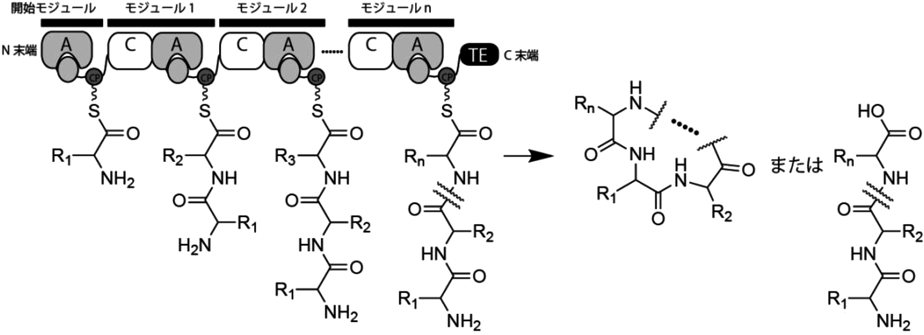
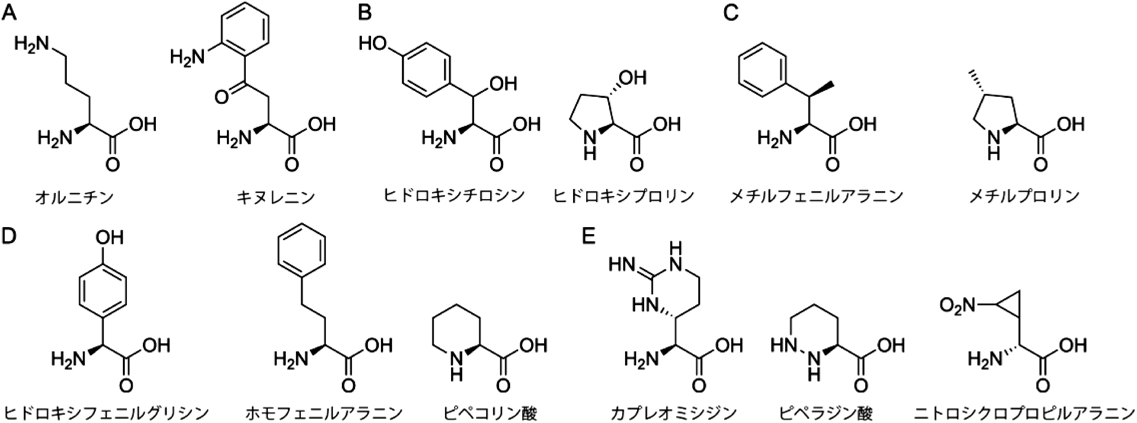
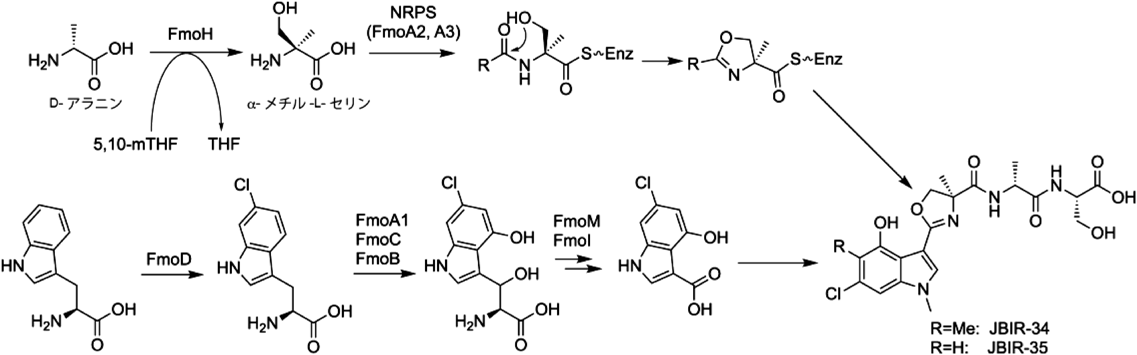
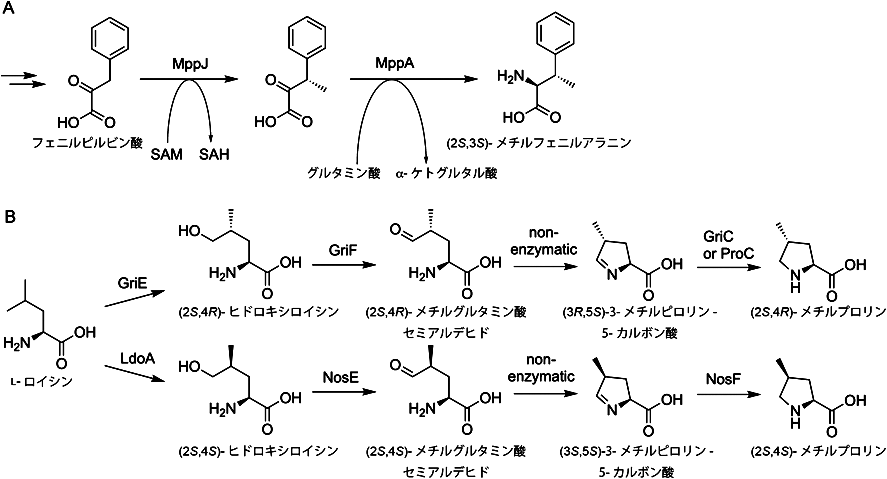
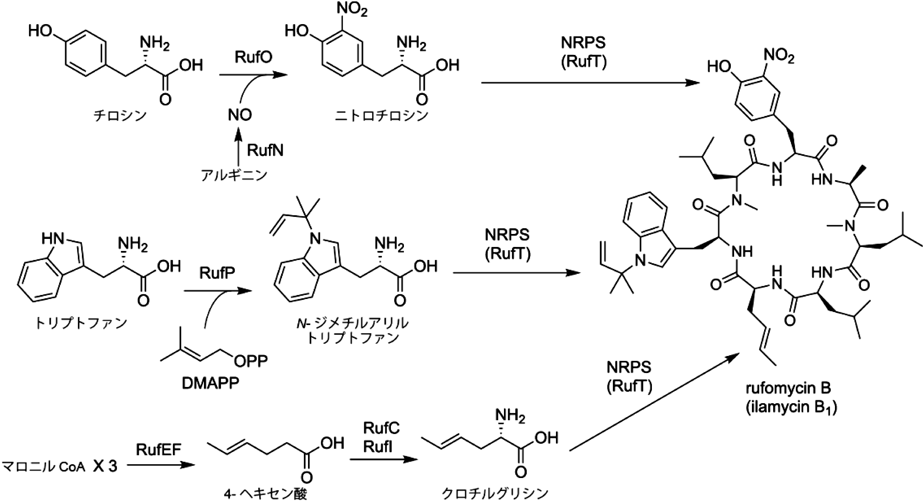
放線菌二次代謝における非標準アミノ酸とその生合成Biosynthesis of nonproteinogenic amino acids in secondary metabolism of actinomycetes
東京大学大学院農学生命科学研究科応用生命工学専攻,東京大学微生物科学イノベーション連携研究機構(CRIIM)Department of Biotechnology, Graduate School of Agricultural and Life Sciences, The University of Tokyo, Collaborative Research Institute for Innovative Microbiology, The University of Tokyo ◇ 〒113–8657 東京都文京区弥生1–1–1 ◇ 1–1–1 Yayoi, Bunkyo-ku, Tokyo 113–8657, Japan