小惑星探査機「はやぶさ2」の地球帰還が大きな話題となったように,地球上には隕石などの飛来を通じて,大量の地球外有機化合物が常に降り注いでいる.炭素質コンドライトという種類の隕石にはアミノ酸をはじめとするさまざまな有機化合物が含まれており,これらの地球外アミノ酸が原始地球に落下したと考えられている3–5).リュウグウのような地球近くに存在する小惑星が有機化合物を含んでいれば,これらが隕石を通じて地球上に落ち,原始生命の誕生に寄与したことを示す強い証拠になると期待されている.隕石などめったに地球に飛来しないから,このような地球外アミノ酸の存在量はたかが知れていると思うかもしれない.ところが非常に小さな隕石(微小隕石)が年間1~2万トン地球上に降り注いでいるのである.
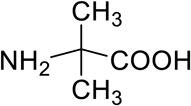
2-アミノイソ酪酸(2-aminoisobutyric acid:Aib)(図1)はこのような地球外アミノ酸の一種であり,年間約0.8トンものAibが宇宙から到達しており,生命が活動する上で十分量の有機化合物として供給され続けている5).長期間にわたる地球への有機化合物の供給において主要な役割を果たしてきたと考えられる.地球外有機化合物は非生物由来であるが,地球上にはこれらの有機化合物を栄養源としてうまく利用する微生物が存在している.
1)2-アミノイソ酪酸を資化する微生物の分離と解析
Aibはα,α-ジアルキルα-アミノ酸の一種である.α-アミノ酸からのα水素の引き抜きは,多くのアミノ酸代謝酵素にとって重要なステップであるが,Aibはα水素原子を欠いているため,Aibは酵素学的観点から関心を集めてきた化合物でもある.筆者らが研究を開始した当初,2,2-ジアルキルグリシンデカルボキシラーゼ(2,2-dialkylglycine decarboxylase:DGD)がAibと反応する唯一の酵素として知られていた6).DGDはピリドキサールリン酸(pyridoxal phosphate:PLP)を補酵素として持つ酵素であり,Aibから二酸化炭素を脱離すると同時にα-アミノ基をピルビン酸に転移して,アセトンとL-アラニンを生成する反応を触媒する.これに対し筆者らは,DGDに依存しない新たなAib代謝経路の探索を行い,Aibと反応する新規酵素の発見を目指した.
Aibを唯一の炭素源とした集積培養法により,約2500株の土壌微生物を分離した.このうち7株においてAib分解活性を確認した.Aib分解菌のうち4株はAib分解によりアセトンを生成し,また,このアセトン生成がPLP依存性酵素阻害剤であるアミノオキシ酢酸(aminooxyacetic acid:AOA)によって完全に阻害されたため,DGD活性を持っていると考えられた.一方,残りの三つのAib分解菌はアセトンを生成せず,AOAの存在下でもAibを分解した.すなわち,これらの分離株がDGDとは独立したAib異化経路を持っていることが明らかになった.このうち,最も活発な増殖を示した分離株C31-06は,放線菌Rhodococcus wratislaviensisと同定され,以降の詳細な生化学的解析に用いられた.
R. wratislaviensis C31-06は通常,Aib異化産物としてアンモニアのみを生成するが,AOAの存在下では,アンモニア以外の三つの新しい化合物を生成した.高速液体クロマトグラフ質量分析(liquid chromatography-mass spectrometry:LC-MS)により,これらの化合物のうち二つは,それぞれ2-メチル-D-セリン(D-MeSer)およびL-アラニン(L-Ala)と同定された.最も顕著に蓄積していたもう一つのAib異化代謝産物は,Aibより30 Da大きい分子量を有していた.この化合物を精製し,NMR分析を行ったところ,2-アミノ-2-メチルマロン酸(2-amino-2-methylmalonic acid:Amma)であることが確認された.
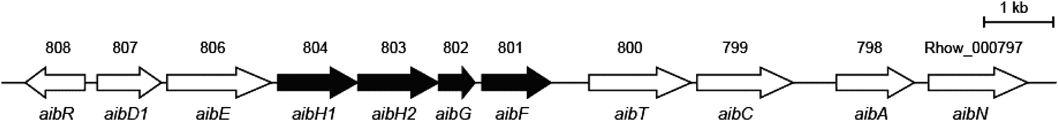
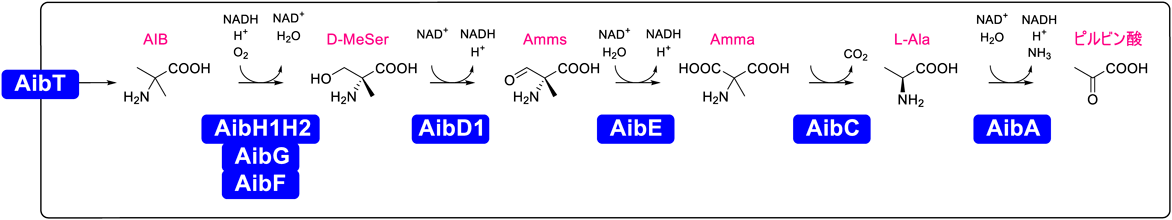
次に培地にAibを添加した誘導条件下および非添加の非誘導条件下で培養したR. wratislaviensis C31-06の総タンパク質をnanoLC-MS/MSを使用した定量的比較プロテオーム解析に供した7).Aib誘導条件下で高度に発現が上昇したタンパク質は,R. wratislaviensis C31-06ゲノム上の一つの遺伝子クラスター(Rhow_000797-808)にコードされていた(図2).これらのタンパク質の多くがアミノ酸代謝に関連する酵素であったことから,この遺伝子クラスターはAib異化に関与すると考えられ,aib遺伝子クラスターと名づけた.
2)2-アミノイソ酪酸水酸化反応の解析
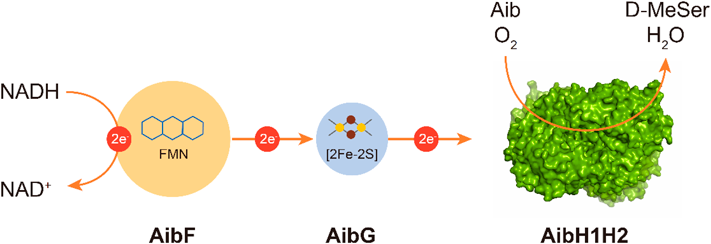
R. wratislaviensis C31-06のAib異化代謝物の解析結果から,水酸化反応によるAibからD-MeSerへの変換が初発反応であると考えられた.しかし,aib遺伝子クラスターには既知の水酸化酵素に関連した遺伝子が存在しなかった.一方で,aibGおよびaibF遺伝子はそれぞれ,Rieske型フェレドキシンおよびフェレドキシンオキシドレダクターゼをコードしていた.またaibGの上流には二つの機能未知遺伝子aibH1とaibH2が位置していた.AibH1とAibH2は互いに28%のアミノ酸同一性を持つアミドヒドロラーゼスーパーファミリータンパク質であった.以上より,AibH1とAibH2がレドックスパートナータンパク質(AibGとAibF)から電子を受け取ることにより,Aibモノオキシゲナーゼシステムのヒドロキシラーゼユニットとして機能すると考えた.そこで,AibH1, AibH2, AibG, AibF(AibH1H2GF)を共発現する組換え放線菌株を構築し,そのAib水酸化活性を評価した.予想どおり,この組換え株はAibからD-MeSerを比活性8.33 nmol-1 min-1 mL culture-1で生成した.また,D-MeSerの生成には四つのタンパク質(AibH1, AibH2, AibG, AibF)すべてが必要であった.AibFはFMN含有フェレドキシン:NAD+オキシドレダクターゼであり,Rieske型フェレドキシンAibGとともに電子伝達鎖を形成する.AibH1とAibH2はヘテロ四量体タンパク質複合体を形成し,ヒドロキシラーゼユニットとして機能する.すなわち,このAibモノオキシゲナーゼシステムは,電子伝達鎖とヒドロキシラーゼユニットから形成されており,NADHからヒドロキシラーゼユニットに電子を輸送することで,Aibの立体選択的な水酸化反応を触媒してD-MeSerを生成することを明らかにした(図3).
3)2-アミノイソ酪酸モノオキシゲナーゼシステムの解析
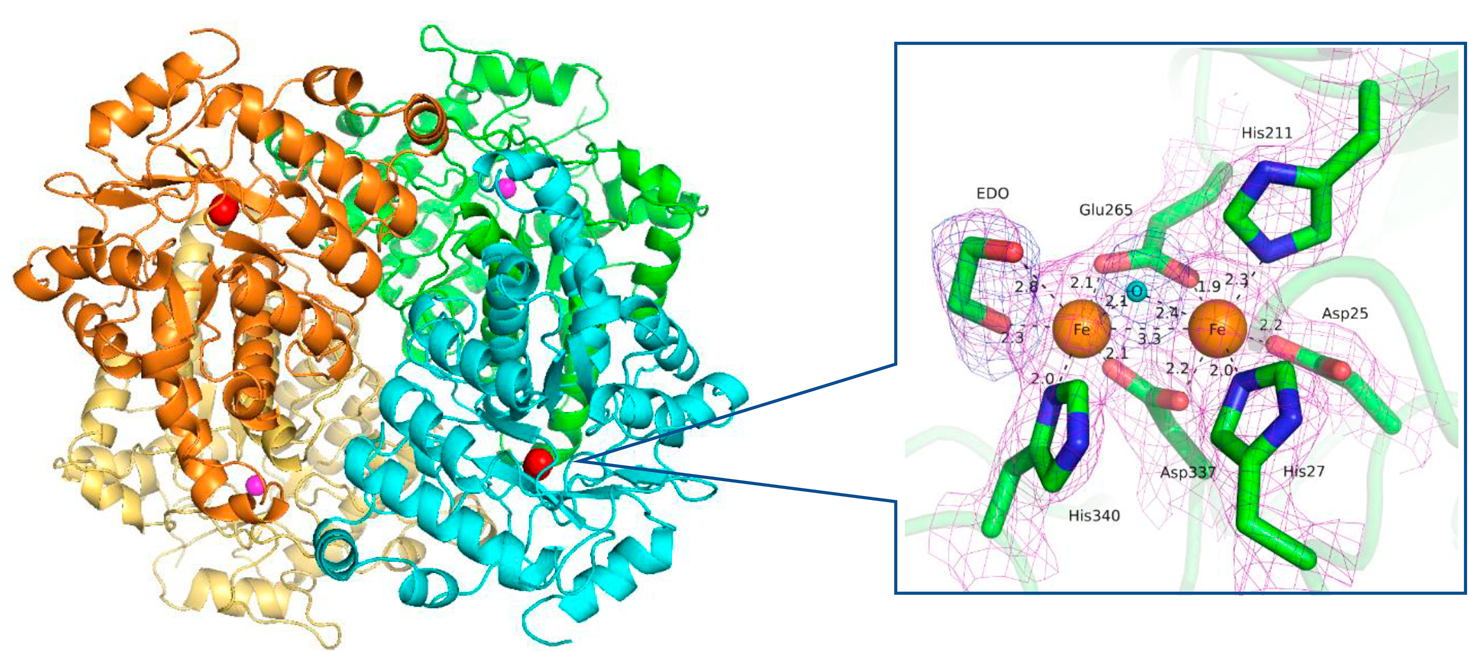
Aibモノオキシゲナーゼシステムを構成するAibH1H2ヒドロキシラーゼユニットの結晶構造解析より,AibH1およびAibH2サブユニットは,アミドヒドロラーゼスーパーファミリーに特徴的な(β/α)8バレル(TIMバレル)構造を備えていることが判明した(図4).AibH1とAibH2のアミノ酸相同性は低いものの,立体構造は広範囲において近似していた.AibH2では,二つの鉄イオンが三つのヒスチジンと三つの酸性アミノ酸残基(Asp25, His27, His211, Glu265, Asp337, His340)の側鎖によって配位され,触媒部位である(μ-hydroxo)-bis(μ-1,3-carboxylato)diiron(III)コアを形成する.一方,AibH1は一つの亜鉛イオンが二つのヒスチジンと三つの酸性アミノ酸残基(Asp24, His26, His201, Glu255, Asp328)の側鎖によって配位される.したがって,AibH1H2ヘテロ四量体には,二鉄中心を持つ二つの触媒AibH2サブユニットと,亜鉛イオンを含む二つのAibH1サブユニットが含まれる.
これまでに報告されている不活性な末端メチル基を酸化する金属酵素としては,シトクロムP450,二価鉄/α-ケトグルタル酸依存性ジオキシゲナーゼ(α-ketoglutarate-dependent dioxygenase:DOX),メタンモノオキシゲナーゼなどがあり,シトクロムP450はiron(IV)–oxo porphyrin π-cation radicals8),DOXはnon-heme iron(IV)–oxo species9),メタンモノオキシゲナーゼはbis(μ-oxo)diiron(IV)10),といった酸化力の特に強い鉄四価オキソ中間体をそれぞれ酸化反応における活性種として用いている.一方でAibH2の持つ(μ-hydroxo)-bis(μ-1,3-carboxylato)diiron(III)コアによる酸化反応は,これまでに報告例がないことから,その反応機構はまったくの未知である.AibH2もAibの不活性な末端メチル基を酸化するため,大きな酸化力を持つ鉄四価オキソ中間体が活性種として反応の過程で生じることが予想される.本酵素の触媒機構はこれまで報告されている酸化酵素とは大きく異なることから,今後本酵素系の詳細な機能解明に興味が持たれる.
Aibモノオキシゲナーゼシステムは,本放線菌がAibを利用するための鍵となる酵素システムである.タンパク質複合体としてヒドロキシラーゼユニットを構成するAibH1とAibH2はともにアミドヒドロラーゼスーパーファミリーに属しており,通常このファミリーに属する酵素は活性中心に亜鉛イオンが配位した加水分解酵素である.しかしAibH1/AibH2複合体は加水分解ではなく水酸化活性を持ち,またAibH1には二核鉄イオンが配位していた.本放線菌は何らかのアミドヒドロラーゼスーパーファミリーの加水分解酵素を祖先として分子進化させることで,二核非ヘム鉄酵素であるAibH1/AibH2タンパク質複合体を生み出し,Aibを水酸化して代謝できるように適応したと考えられる.すなわち非生物由来の地球外アミノ酸であるAibがきっかけとなって独自の進化を遂げたことが,他に類をみないユニークな酵素を生み出す原動力となったのかもしれない.この原動力は,Aibと類似した構造を持つ天然の化合物をきっかけとした進化だった可能性もある.一方,その逆,すなわち,本ヒドロキシラーゼユニットがアミドヒドロラーゼの祖先である可能性も考えられよう.
4)2-アミノイソ酪酸の微生物代謝の解析
R. wratislaviensis C31-06のaib遺伝子クラスターにコードされた酵素の解析により,Aibは5段階の反応を経て,最終的にピルビン酸へと異化されることを明らかにした.Aibモノオキシゲナーゼシステムにより生成したD-MeSerは,2種のデヒドロゲナーゼ(AibD1とAibE)による2段階の脱水素反応により,2-アミノ-2-メチルマロン酸(Amma)へ変換される.AibD1は,D-MeSerを2-アミノ-2-メチルマロン酸セミアルデヒド(Amms)に酸化するNAD+依存性D-MeSerデヒドロゲナーゼであり,AibEは,AmmsをAmmaに酸化するNAD+依存性Ammsデヒドロゲナーゼである.AibD1は絶対的な基質立体選択性を持ち,L-MeSerとは反応せず,18.1 µmol-1 min-1 mg-1の比活性でD-MeSerを脱水素する.AibCはAmmaデカルボキシラーゼであり,18.7 µmol-1 min-1 mg-1の比活性でAmmaの脱炭酸活性を示し,L-Alaが反応産物として生じる.AibCはセリンヒドロキシメチルトランスフェラーゼと相同性を示したが,L-MeSer,D-MeSer,L-セリン,またはD-セリンに対するヒドロキシメチルトランスフェラーゼ活性を保持しない.PLPはAibCによるAmmaの脱炭酸に不可欠な補酵素であり,AOAの添加により,R. wratislaviensis C31-06にAmmaが著量蓄積した理由が説明できる.AibAはNAD+依存性L-Alaデヒドロゲナーゼであり,768 µmol-1 min-1 mg-1の比活性でL-Alaをピルビン酸を変換する.本研究で解明したR. wratislaviensis C31-06のAib異化経路を図5に要約した.
5)2-アミノイソ酪酸モノオキシゲナーゼシステムの産業応用
Aibモノオキシゲナーゼシステムは,高原子価の二鉄オキソ種を使用して不活性C–H結合を活性化する実用的な生体触媒として期待される.特に,化学的に酸化しにくい飽和末端メチル基の選択的水酸化反応を触媒する能力は,産業的なバイオプロセスにおいて魅力的である11).そこでAibH1H2GFの触媒能を活用した,D-MeSer生産の新たなバイオプロセス開発を行った.AibH1H2GFおよびAibTを共発現するRhodococcus erythropolis株を新たに構築し,AibからD-MeSerへの変換を行った.aib遺伝子クラスターにコードされるAibTはアミノ酸透過酵素であり,AibやD-MeSerを膜輸送する機能を持つ.この組換え菌株により約32 mMのD-MeSerが生成しており,AibTを含まない組換え菌株と比較して大幅に生成量が増加した.D-MeSerは,誘導型一酸化窒素合成酵素の選択的阻害剤などの原料として有用である12).
このように,高い酸化反応性を持ち,かつ選択的に働く新規酵素Aibモノオキシゲナーゼシステムの発見は,今後酵素触媒の産業利用を拡張していくための契機になると考えられる.
非標準水酸化アミノ酸が,微生物・植物・動物に至る広範な生物種から見いだされている.その存在形態としては遊離アミノ酸の場合もあれば,ペプチドやタンパク質の構成アミノ酸である場合もある.微生物の産出するペプチドには抗菌活性などの有用な性質を示すものが多数知られているが,ある種のペプチドは構成要素として水酸化アミノ酸を含んでいる.また高等植物の中には遊離型の水酸化アミノ酸を特定の箇所に高度蓄積するものもあり,その機能性や生理学的な意義に興味が持たれる.
二価鉄/α-ケトグルタル酸依存性ジオキシゲナーゼ(DOX)はこうした水酸化アミノ酸の生合成酵素の一種であるが,筆者らが研究を開始した当時,遊離アミノ酸に対して作用するDOXは数種類しか知られていなかった.
1)脂肪族アミノ酸水酸化酵素
筆者らはL-イソロイシン含有培地を用いた集積培養で単離された菌株を対象に,L-イソロイシンに対する水酸化活性を指標とした微生物スクリーニングを実施した.その結果,グルコース依存型のインスリン放出活性を示す(2S,3R,4S)-4-ヒドロキシ-L-イソロイシン(4OH-L-Ile)をL-イソロイシンの水酸化によって生成する菌株として,Bacillus thuringiensis 2e2を単離することに成功した13).この細菌は4OH-L-Ileをさらに酸化して他の微生物に対する生育阻害物質である2-アミノ-3-メチル-4-ケトペンタン酸を生成する.本菌の保持するL-イソロイシン水酸化酵素(L-isoleucine 4-hydroxylase:IDO)を精製・同定したところ,DOXファミリーに属する新規な酵素であった14).筆者らはIDOを発現し,かつα-ケトグルタル酸供給が強化された大腸菌を用いることで,4OH-L-Ile生産プロセスを実用レベルで開発している15)(図6).
IDOの基質特異性解析を進めたところ,L-イソロイシン以外の脂肪族L-アミノ酸に対しても広く4位水酸化活性を示すことがわかった16).この活性を利用することで,L-ロイシンから4-ヒドロキシ-L-ロイシンを,またL-ノルバリンから(S)-4-ヒドロキシ-L-ノルバリンを,さらにL-ノルロイシンから4-ヒドロキシ-L-ノルロイシンを生成することができた.
IDOは含硫アミノ酸に対しても作用し,キラルスルホキシドを生成した.たとえばL-メチオニンと反応させた場合L-メチオニン-(S)-スルホキシドを,S-メチル-L-システインからはS-メチル-L-システイン-(S)-スルホキシド(メチイン)を,S-アリル-L-システインからはS-アリル-L-システイン-(S)-スルホキシド(アリイン)が生成した17).メチインやアリインはネギ属やアブラナ属の食用植物に著量含まれており,抗酸化・抗肥満・疾病改善作用を示す生理活性物質である.
2)脂肪族アミノ酸水酸化酵素群の多様性
筆者らはいくつかのIDO相同酵素を大腸菌にて発現し,基質特異性解析を実施した.Pantoea ananatisのゲノム上には2種類のDOX(HilA, HilB)が並んで存在しており18),これらのDOXによる連続的な水酸化反応によりL-イソロイシンから4,4′-ジヒドロキシ-L-イソロイシンが生成した.Nostoc punctiforme由来のDOX(LdoA)は,この細菌の産出する環状ペプチドの生合成経路に組み込まれており19),L-ロイシンやL-ノルロイシンの5位炭素を水酸化して(4S)-5-ヒドロキシ-L-ロイシンおよび5-ヒドロキシ-L-ノルロイシンを生成する活性を示した.5-ヒドロキシ-L-ノルロイシンはマメ科サンヘンプ(Crotalaria juncea)の種子に高度に蓄積することが知られている非標準遊離アミノ酸である.Burkholderia ambifaria由来のDOX(SadA)20)は幅広い種類のN置換の脂肪族L-アミノ酸のβ位炭素への水酸化反応を触媒した.β位に水酸基を持つアミノ酸はペプチドなどの天然物に最も多く含まれる非標準水酸化アミノ酸であり,β-ラクタムをはじめとする医薬品骨格の前駆体としても用いられる重要な化合物である.
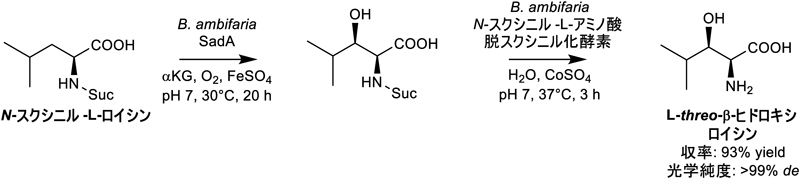
SadAはB. ambifariaのゲノム中において16種類のアミノ酸代謝関連遺伝子から構成される生合成クラスターに含まれており,SadAのすぐ上流にはN-スクシニル-L-アミノ酸脱スクシニル化酵素(LasA)がコードされていた.筆者らはSadAとLasAを触媒とした複合酵素的な生産プロセスを開発し21),高光学純度のL-threo-β-ヒドロキシロイシン生産に成功している(収率93%,光学純度99%)(図7).
3)環状イミノ酸水酸化酵素
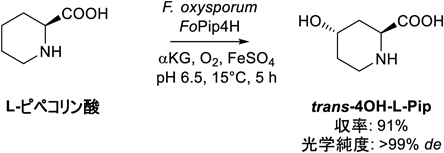
ヒドロキシプロリンやヒドロキシピペコリン酸は自然界に広く見いだされる水酸化環状イミノ酸であり,また製薬産業における有機合成のためのビルディングブロックとして使用されている.筆者らは,L-ピペコリン酸に対する水酸化活性を探索し,L-ピペコリン酸からtrans-4-L-ヒドロキシピペコリン酸(trans-4OH-L-Pip)を生成するFusarium oxysporum c8Dを単離した21).この糸状菌の保持するL-ピペコリン酸水酸化酵素を精製・同定したところ,DOXファミリーに属する新規な酵素でありFoPip4Hと名づけた.FoPip4Hを触媒として利用した酵素合成プロセスでは,trans-4OH-L-Pipを収率91%,光学純度99%以上で生産することが可能であった(図8).trans-4OH-L-Pipはマウスに対する抗糖尿病および抗酸化作用を有していることが報告されている.
FoPip4Hに対して詳細な基質特異性解析を進めたところ,L-ヒドロキシピペコリン酸以外にもいくつかの環状L-イミノ酸に対して水酸化活性を示すことがわかった.この活性を利用することで,L-プロリンからtrans-4-L-ヒドロキシプロリンが生成可能であった21).
FoPip4H相同酵素群の分子系統解析を実施した結果,FoPip4H相同酵素群は子嚢菌門の糸状菌に広く保存されていることがわかった21).いくつかのFoPip4H相同酵素を選別し,組換え酵素を用いて基質特異性解析を実施した結果,子嚢菌門糸状菌に由来するFoPip4H相同酵素にL-ピペコリン酸をtrans-4OH-L-Pipに水酸化する活性を認めた.このうちAspergillus nidulans FGSC A4由来のAnPip4Hは広い基質特異性を示し,D-プロリンからcis-4-D-ヒドロキシプロリンを生成した21).