地球上のすべての生物の生命活動を支えているタンパク質は,基本的に標準遺伝暗号表で指定された20種類ほどのL体に偏ったアミノ酸(標準アミノ酸)で構成されている.アミノ酸分子はアミノ基とカルボキシ基の二つの官能基を有するため,特有の生理機能や物理化学的特性を発現し,生物に内在するアミノ酸やペプチド関連の代謝酵素の働きやそれらを利用することによって非標準アミノ酸を含む多様なアミノ酸誘導体の創出も可能となっている.さらに,アミノ酸が連結したペプチドでは環状体も含めその構造は多岐にわたるため,自然界に存在するアミノ酸誘導体はきわめて広い多様性を有することになる.たとえば,細菌の細胞壁に存在するペプチドグリカンやある種の微生物が産生する一部のペプチド性抗生物質にはD-アミノ酸が含まれている.これは,生物の進化や生存戦略を考える上で興味深く,それらの生合成機構や反応システムを理解して新たな合成法を考えることは,非天然型を含むアミノ酸誘導体や生理活性ペプチドなどの機能性化合物や創薬原料の創出に大いに貢献するものと考える.
筆者らは,微生物の機能を利用した有用化合物の効率的な合成プロセスの開発を目的に研究を行っている.そのなかで,D-アミノ酸を含む非天然アミノ酸の効率的合成法や,新規アミノ酸リガーゼやアデニル化酵素を利用したキラリティ制御を可能とする革新的なアミド結合形成反応システムを開発しており,その結果,非標準アミノ酸を含むペプチドやジケトピペラジンをはじめとする多様なアミド化合物の合成に成功している.本稿では,筆者らのこれら研究の一部を紹介する.
1)アミノ酸ラセマーゼとアミノトランスフェラーゼ
光学異性体を分離・分析する技術の進展を受けて,D-アミノ酸は微生物以外の高等生物にも広く存在することが明らかになってきた.また,生体内では神経伝達や内分泌機能の制御等さまざまな生理機能を有する重要な生体内分子であることも明らかになってきており,D-アミノ酸の生合成に関与する酵素や代謝系の研究も進んでいる1).D-アミノ酸は生体内だけでなく,普段口にしている食材や発酵食品中にも多種類の遊離のD-アミノ酸が存在し,食品機能成分としての可能性も報告されている2).アミノ酸ラセマーゼは遊離型D-アミノ酸の生合成を担う代表的な酵素であるが,微生物にはD-アミノ酸アミノトランスフェラーゼ(D-AAT)によってD-アミノ酸のアミノ基をα-ケト酸へ転移させ,別のD-アミノ酸を合成する反応システムが存在している.
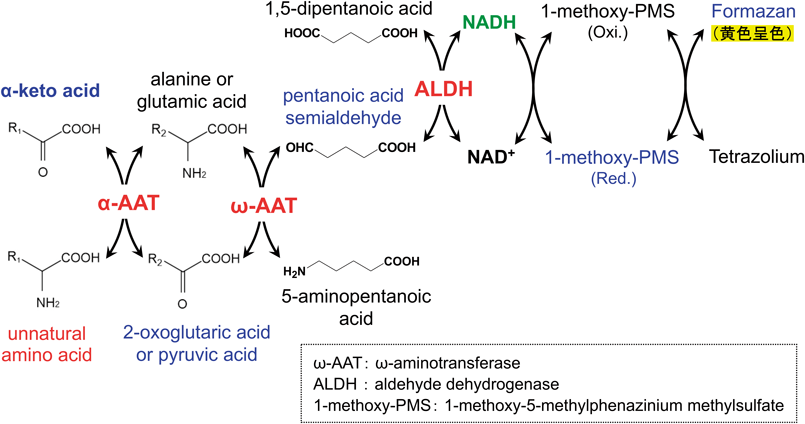
筆者らは,D-アミノ酸を含む非天然アミノ酸の合成法の確立を目的に,人為的にデザインしたケト酸からの非天然アミノ酸への酵素的変換反応を触媒するα-アミノトランスフェラーゼ(α-aminotransferase:AAT)の探索を検討した.目的とする任意アミノ酸の合成前駆体となるα-ケト酸を基質とするL-AATやD-AATがあれば,自在に目的のアミノ酸を合成することができる.特殊環境に生育する高度好熱菌や超好熱始原菌からAATを探索した.Aeropyrum pernix K1(NBRC 100138),Pyrococcus horikoshii OT3(NBRC 100139),Sulfolobus tokodaii 7(NBRC 100140)などからゲノム情報に基づいて得られた複数のAAT候補遺伝子を大腸菌で高発現させたところ,それぞれから基質特異性の異なる酵素を得た.100°Cでも安定な当該酵素は工業的利用価値も高く,これら酵素の基質特異性などの酵素特性を踏まえた非天然アミノ酸合成が可能となる.実際に,任意のα-ケト酸を基質としうるAATのハイスループットな呈色探索法も開発し(図1),医薬品合成におけるキラルブロックとして有用な新規フェニルグリシン誘導体の合成法の開発に成功している3).
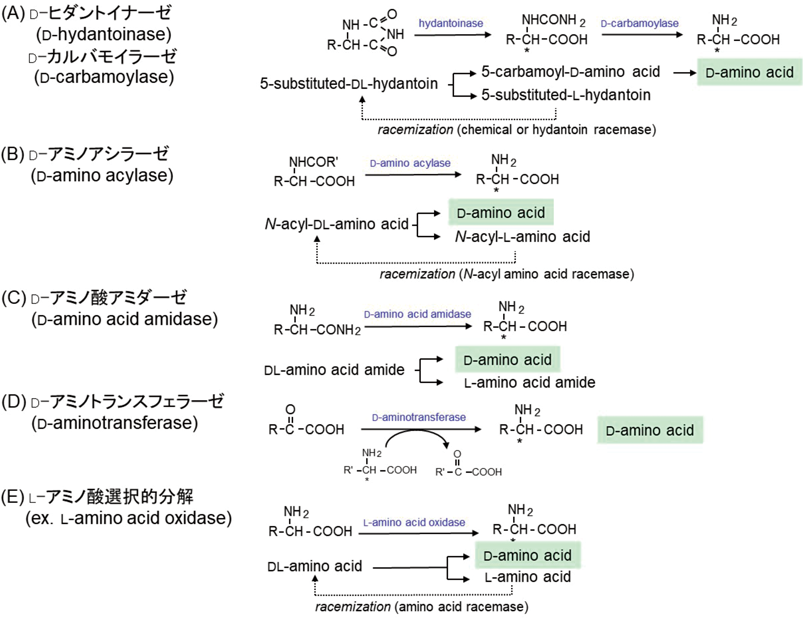
D-アミノ酸の産業応用を見据えた工業的製造法に関しては,微生物起源の関連代謝酵素を用いた方法が知られている4).原料となるケト酸の安価な供給や対応する酵素の存在の有無が製法の成立要件となる.また,酵素や反応の特性によっては合成収率を高めるためにプロセスを工夫する必要もある.たとえば,上述のD-AATによるD-アミノ酸合成は平衡反応のため生成側に反応を傾ける必要がある.そのため,D-アラニン(D-Ala)を別のD-アミノ酸を合成するためのアミノ基供与体とした場合,アミノ基を供与した結果生成するピルビン酸を,いくつかの関連酵素を組み合わせながら還元アミノ化させて再度D-Alaを供給する方法などがとられる.その他,ラセミ体のアミノ酸誘導体を原料とする速度論的光学分割法では,片方のエナンチオマーのみを選択的に分割したり,系内でラセミ化反応を同時進行させながら光学分割して理論収率100%を目指したりする方法などが構築されている(図2).
2)ヒドロキシアミノ酸の合成
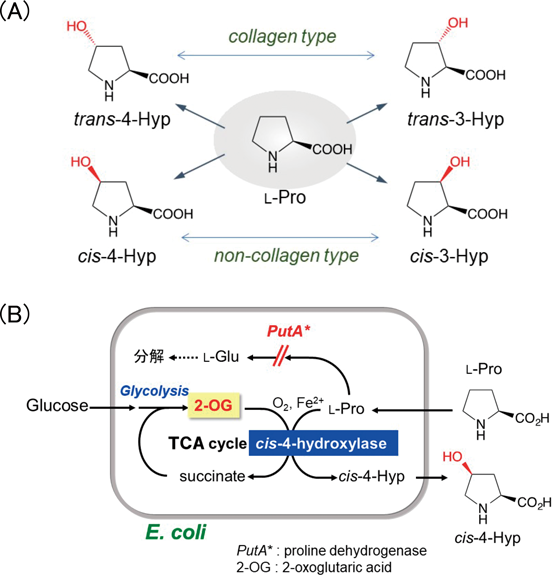
ヒトの全タンパク質の約25%を占めるコラーゲンはtrans-4-ヒドロキシ-L-プロリン(trans-4-Hyp)を構成成分として多く含んでいるが,これはプロリン残基が4-プロリルヒドロキシラーゼによる翻訳後修飾を受けたものである.L-セリン(Ser),L-トレオニン(Thr),L-チロシン(Tyr)などのヒドロキシアミノ酸はタンパク質のリン酸エステル化や脱リン酸化により細胞機能の調節に関わる重要な生理機能を担っており,医薬品合成におけるキラルブロックとして広く利用されている.筆者らは,産業上有用なヒドロキシアミノ酸の工業的生産プロセスの開発を目的に,位置立体選択的にアミノ酸に水酸基を導入可能な酵素の探索を実施し,多種類のヒドロキシアミノ酸の合成法を開発している5).
ヒドロキシプロリン(Hyp)は医薬品原料として重要な化合物で,天然には4種類の異性体が存在するが,trans-4-Hypとcis-3-HypはそれぞれDactylosporangium sp. RH1およびStreptomyces sp. TH1から対応する水酸化酵素の遺伝子がクローニングされ,それら遺伝子を高発現させた組換え大腸菌による工業的生産プロセスが確立されている6).筆者らは,残りの2種類のHYPの効率的合成法の開発を目指して検討を行った.L-プロリン(Pro)を水酸化してcis-3-HYPを合成する酵素に存在する特徴的なドメイン(Pfam:PF05373)に着目し,当該ドメインを有する機能未知タンパク質の中から,Pro-cis-3-水酸化酵素(EC 1.14.11.28)とわずかにアミノ酸配列上の類似性があり,2-オキソグルタル酸依存型ジオキシゲナーゼに特徴的なHis-1モチーフ(H-X-D…H)を有しているMesorhizobium loti由来mlr6283とSinorhizobium meliloti由来SMc03253を候補遺伝子として選択した.当該遺伝子を大腸菌で高発現させた結果,いずれの酵素も2-オキソグルタル酸(2-oxoglutaric acid:2-OG)依存的にProの水酸化反応を触媒し,cis-4-Hypを選択的に合成するPro-cis-4-水酸化酵素(EC 1.14.11.56)であることが明らかになった7).反応諸条件を検討し,対基質モル変換率がほぼ100%となるcis-4-Hypの効率的な工業生産プロセスの開発に成功し,上市されている(図3)8).一方,好塩菌Halomonas elongata由来のエクトイン水酸化酵素EctDにtrans-3-Hyp合成活性のあることを見いだし,さらにそのホモログ酵素であるStreptomyces cattleya由来EctDは広範な基質特異性を有する2-OG依存型ジオキシゲナーゼであることを明らかにした.さらに,Proから変換率約90%の高収率で選択的にtrans-3-Hypを生産する工業プロセスの開発にも成功した9, 10).その他,ゲノム情報や類似酵素のX線結晶構造解析から得た情報(機能未知ドメイン,活性中心モチーフ,アミノ酸配列)などを手がかりに,脂肪族アミノ酸11),L-リシン(Lys)12),L-ヒスチジン(His),L-グルタミン(Gln)などを位置立体選択的に水酸化する2-OG依存型ジオキシゲナーゼを数多く見いだしており,対応するヒドロキシアミノ酸の効率的生産プロセスの開発にも成功している.興味深いことに脂肪族アミノ酸を水酸化する酵素の多くはL体だけでなく対応するD-アミノ酸も基質として認識し,そのなかでも4-ヒドロキシ-L-イソロイシン合成活性を有するGloeobater violaceus由来の2-OG依存型ジオキシゲナーゼBAC90543は,L-イソロイシン(Ile),L-ロイシン(Leu),L-バリン(Val),ノルノイシン,ノルバリンのすべてに対してL体もD体もほぼ同じように認識してそれらの水酸化反応を触媒していた.
一方,5-ヒドロキシ-L-トリプトファン(5-HTP)は,高等動物の脳内セロトニン経路における中間体で,抗精神病薬として効果が期待される有用化合物である.筆者らは,発酵法で安定供給可能なL-トリプトファン(Trp)を直接水酸化して5-HTPを生産する酵素として,微生物から高等動物まで広く存在する芳香族アミノ酸水酸化酵素(aromatic amino acid hydroxylase:AAH)に着目した.微生物では唯一,Chromobacterium violaceumのフェニルアラニン水酸化酵素(phenylalanine hydroxylase:PAH)が報告されているが,活性がきわめて低いためPAHの改変による活性向上を検討した.PAHはX線結晶構造解析により立体構造が解明されていたため(PDB code:1LTZ),ヒト由来AAHの立体構造モデリングと比較して有効変異部位を予測した.その結果,基質Trpと補酵素プテリンの認識に関与すると推察したアミノ酸残基に変異を導入した二重変異酵素(L101Y-W180F)では野生型PAHと比較してkcatは5.2倍になり,さらに反応条件の最適化を行うことで5-HTPのTrpからの変換収率は160倍に向上した13).
1)D-アラニン-D-アラニンリガーゼと微生物多様性
前述したように,地球上の生物を構成しているアミノ酸はL体に偏っているが,微生物にはD-アミノ酸の代謝関連酵素が内在しており,D-アミノ酸含有ペプチド性抗生物質の生合成に関わるなど生体防御や生存戦略に貢献している.細菌の細胞壁に含まれるペプチドグリカンはD-アラニン-D-アラニン(D-Ala-D-Ala)を構成要素の一つとしており,細菌の有するd-Ala-D-Alaリガーゼ(D-Ala-D-Ala ligase:Ddl)(EC 6.3.2.4)によって合成されている.筆者らは,D-アミノ酸の生理的意義から予測されるD-アミノ酸含有ペプチドの機能多様性を期待して,D-アミノ酸ジペプチドの合成法を検討した14).
院内感染菌methicillin-resistant Staphylococcus aureus(MRSA)対応抗菌剤であるバンコマイシンは,D-Ala-D-Alaに特異的に結合してペプチドグリカンの構造変化を引き起こすことで抗菌活性を示すが,バンコマイシンに耐性を獲得した腸球菌vancomycin-resistant enterococci(VRE)ではペプチドグリカン構成要素がD-Ala-D-AlaからD-Ala-D-乳酸に変化していることに着目した.これはVREのDdlが変異してD-乳酸を基質として認識するようになったからで,当該変異型DdlはD-Ala-D-Serの合成反応も触媒することが報告されている15).大腸菌やその他の細菌由来のDdlでもD-AlaだけでなくD-メチオニン(D-Met),D-フェニルアラニン(D-Phe)などをD-Alaに連結する活性を有していることから,筆者らはDdlが細菌に広く存在することと微生物の多様性に期待して基質特異性の異なる新規Ddlの探索を行った.進化系統樹の結果から系統的に離れている4種類の細菌由来Ddlの基質特異性を検証した結果,D-Alaしか認識しないものや,D-Ser,D-Thr,D-システイン(D-Cys),グリシン(Gly)をほぼ同程度の活性で認識してホモジペプチドを変換率70%で生成するDdlが存在することなどがわかった16).
2)耐熱性酵素を利用したD-Ala-D-Alaの効率的合成
4種類の細菌の中で基質特異性が最も広かった好熱性細菌Thermotoga maritima ATC C 43589由来TmDdlは,温度安定性も高く90°Cまで活性を維持していた.ATPが化学的に加水分解を受けにくい60°Cで評価を行ったところ,高温反応であるため活性化エネルギーの増大による反応速度の上昇に起因するものと推察されるが,基質特異性がD-Lys,D-Arg,D-His,D-Ile,D-Leu,D-Val,D-Phe,D-Met, β-Alaと広がった17).ただし,本反応には当量のATPが必要であるため工業生産においてコスト面で課題となる.筆者らは,この課題に対してD-アミノ酸ジペプチドがL-アミノ酸ジペプチドに比べ生分解を受けにくいことに着目して,糖代謝と共役してATP再生が可能となる菌体反応系で検討を行った.さらに低基質特異性のアミノ酸ラセマーゼとTmDdlを組み合わせることで,安価なl-アミノ酸やD,L-混合アミノ酸を原料とすることが可能となり,目的のD-アミノ酸ホモジペプチドを効率的かつ安価に合成するプロセスの開発に成功した.さらに,TmDdlの温度特性を踏まえた高温域での反応系の構築を目指し,ATP再生が可能な好熱菌Thermosynechococcus elongatus BP-1由来の耐熱性ポリリン酸キナーゼを共発現させた組換え大腸菌による休止菌体反応系を開発した.その結果,反応温度60°Cの場合,ATPの添加量にかかわらずD-Ala-D-Ala合成は高収率を維持し,ATP無添加の場合でもポリリン酸とD-Alaを培地に添加することで80%を超える収率を達成した.60°Cの高温反応によって常温菌である大腸菌由来の酵素が失活するために副反応が抑制され,また大腸菌膜の損傷によってポリリン酸やATPなどの物質移動が容易になる副次的な効果も確認できた.この耐熱型のATP再生系は,D-アミノ酸ジペプチドの合成のみならずATP依存型の物質生産において汎用性の高い有効なツールになると期待される18).
1)L-アミノ酸α-リガーゼ(Lal)の発見
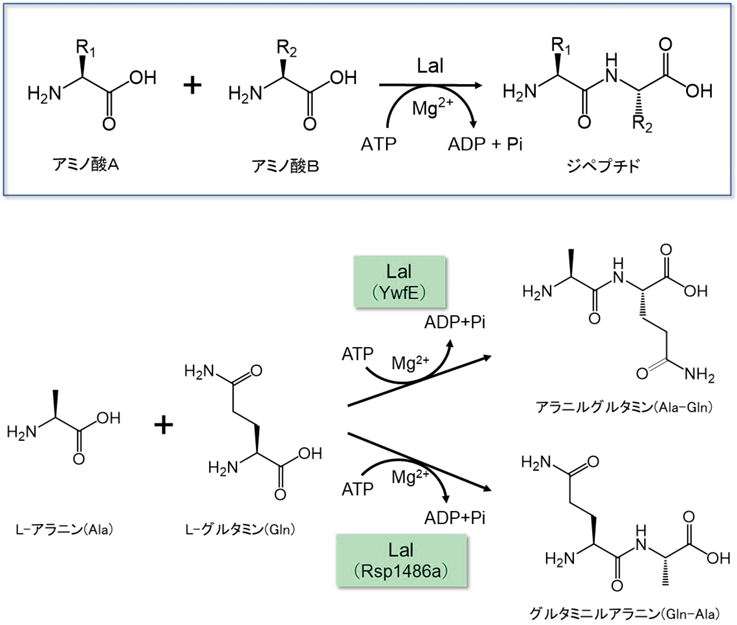
無保護の遊離D-アミノ酸をATP依存的に連結してジペプチドを合成するDdlに対して,L-アミノ酸を同じような反応機構によって連結するジペプチド合成酵素L-アミノ酸α-リガーゼ(L-amino acid α- ligase:Lal)(EC 6.3.2.49)がTabataらによって初めて見いだされた19).ゲノム情報を活用した巧みな探索技術によって機能未知タンパク質の中から見いだされた酵素であるが,当該酵素YwfEはBacillus subtilis ATC C 15245が産生するペプチド性抗生物質バチリシン(bacilysin:Ala-anticapsin)の合成を担い,N末端にAlaをC末端にGlnなど比較的かさの大きいL-アミノ酸をATP依存的に連結してジペプチドを合成する酵素である.基質特異性も広く多種類のジペプチド合成が可能であるが,工業的には輸液原料や動物細胞培養の培地成分として需要のあるAla-Glnの発酵生産法が開発されている20).
2)Lalの探索と特性
有用なYwfEの機能発見とその経緯を踏まえて,筆者らもゲノム情報を活用してATP結合モチーフを有する機能未知タンパク質から多種類のLalを見いだすことに成功している21).
Ralstonia solanacearum JCM 10489から見いだしたRsp1486a22)は,YwfEと同様に基質特異性が広く,なかでもN末端配置のアミノ酸としてAla, Ser, Cys, Met, His, Pheを認識するが,無保護アミノ酸の連結順序はYwfEとは異なり,たとえばAlaとGlnからはGln-Alaを選択的かつ優先的に合成する(図4).また,Bacillus licheniformis NBRC 12200から見いだしたBL0023523)では,N末端配置アミノ酸の基質特異性は狭くMetとLeuに対してのみ活性を有しており,Lalによるジペプチド合成において厳密な基質認識に基づく酵素反応の特徴が明らかになった.なお,両酵素ならびにYwfEのアミノ酸配列上の相同性はいずれも30%以下と低かった.また探索方法がゲノム情報に基づくin silico screeningであったため,これら酵素の生体内での役割は不明である.
一方,YwfEがAlaとアンチカプシン(anticapsin)という非タンパク質性アミノ酸を連結して抗生物質バチリシンを生合成する酵素であったことから,筆者らは自然界に広く存在が報告されているペプチド性生理活性物質を産生する微生物に新たなLalを見いだすことができると考えて検討を行った24).微生物が産生するペプチド性抗生物質の多くは,非リボソームペプチド合成酵素(nonribosomal peptide synthetase:NRPS)やアミノ酸リガーゼによって合成されている.いずれもmRNAを鋳型としないため,多種類の非標準アミノ酸を構成アミノ酸として取り込むことが可能であり,それらアミノ酸の特性と多彩な化学構造によって固有の生理活性を発現している.
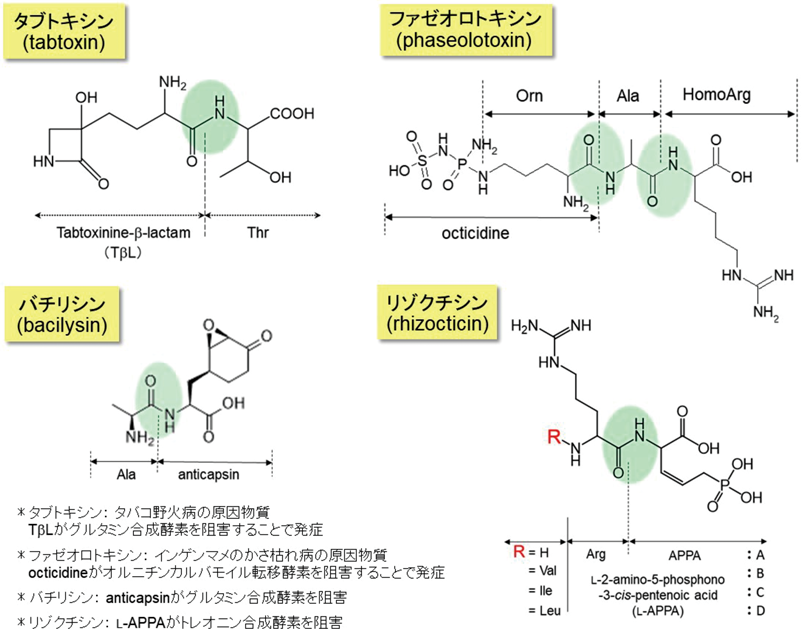
筆者らが着目したペプチド性抗生物質の一部を図5に示す.タバコ野火病の原因物質であるタブトキシン(tabtoxin)の産生菌Psuedomonas syringae NBRC 14081から見いだしたTabSは,予想どおりジペプチド合成反応を触媒するLalであり,β-Alaを加えた21種類のアミノ酸の組合わせのうち,その60%にあたる136種類のジペプチド合成活性を有する興味深い酵素であった.さらに,Lalでは通常N末端に配置されるアミノ酸の基質特異性が厳密である一方,C末端側のアミノ酸選択は比較的甘い場合が多かったが,このTabSではC末端に配置されるアミノ酸の種類が限定されていた.ただし,β-AlaはN末端にもC末端にも導入可能であり,C末端にはアミノ酸エステルをはじめヒドロキシアミノ酸や各種アミノ酸誘導体(γ-アミノ酪酸,タウリン,テアニン等)も結合可能であり,変異型TabSではLys-Xaaを約80%の高収率で合成することに成功している25).また,オリゴペプチドであるリゾクチシン(rhizocticin)を産生するB. subtilis NBRC 3134からは,ユニークな遺伝子取得方法を考案してジペプチド合成活性を有するRizA(EC 6.3.2.48)と最大八量体のオリゴマー合成を可能とする初めてのオリゴペプチド合成酵素RizB(EC 6.3.2.B1)を発見している26, 27).RizBの発見を発端として多種類のオリゴペプチド合成酵素を見いだすことにも成功した28).
現在は,取得したLalの酵素特性やX線結晶構造解析を進めており,それら情報を踏まえた酵素のデザインや創製によって,非標準アミノ酸を含む遊離の無保護アミノ酸をシーケンシャルに連結して任意のオリゴペプチドを合成することが可能になっている.当該酵素を用いるペプチド合成プロセスの開発は,創薬をはじめとして機能性化成品や健康食品等への開発研究に大いに貢献するものと考えている.
3)Lalを利用した機能性ジペプチドの合成
筆者らは,取得したLalを用いて有用な機能性ジペプチドの探索や生産プロセスの開発研究も実施している.2種類のアミノ酸が連結してジペプチドになると,アミノ酸の溶解性や安定性などの物性が改善したり,元のアミノ酸にはない生理機能を発現したりすることが知られている29).たとえば,低カロリー甘味料であるアスパルテームはPheとL-アスパラギン酸(Asp)からなるジペプチドのメチルエステル体である.構成アミノ酸はどちらもわずかに苦いものの甘味は示さないが,連結してアスパルテームになるとショ糖の約200倍の甘味を示すことが知られている.また,血圧降下作用や抗酸化作用など多くの効能をうたったジペプチドが健康食品素材として販売されているが,そのほとんどが天然のタンパク質を加水分解酵素等で処理して得た有効画分から見いだされたものである.筆者らは,従来の機能性ペプチドの探索法では加水分解されやすいペプチド等は活性スクリーニングの対象にもなっていないと考え,任意の無保護アミノ酸を順序どおりに連結するLalの酵素特性に着目した.塩味増強作用を示すジペプチドの探索を目的とした香料会社との共同研究において,これまで評価対象となっていなかったジペプチドのライブラリーを構築して評価したところ,塩味増強作用を示す新たなジペプチドを見いだすことに成功し,さらに,副生するジペプチドの抑制や変換収率の向上した改変酵素の創出にも成功した30–32).
抗酸化作用に伴う抗疲労効果・脳記憶改善効果など多様な生理機能を有するイミダゾールジペプチド(カルノシン,アンセリン,バレニン)はβ-AlaとHisあるいはHisのメチルヒスチジン誘導体が連結したジペプチドで,高齢化社会や高ストレス社会に対応する健康食品素材として期待されているが,それらの効率的合成法の開発にも成功している.非標準アミノ酸であるβ-Alaを含むジペプチドが大腸菌では分解されにくいこともあって,YwfEの変異酵素を発現させた組換え大腸菌を用いたATP無添加の菌体反応系では,カルノシンもアンセリンもそれぞれの合成反応において対基質モル変換率95%以上を達成している33).
1)非リボソームペプチド合成酵素(NRPS)のアデニル化ドメインの利用
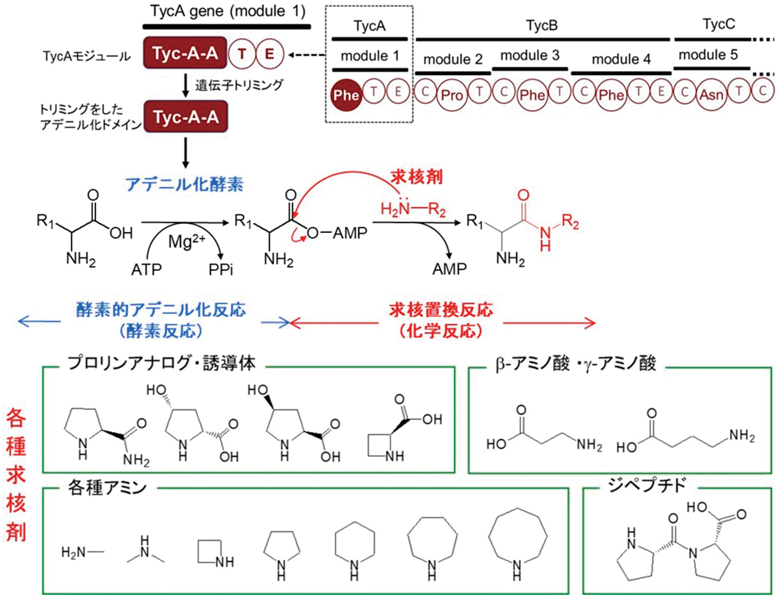
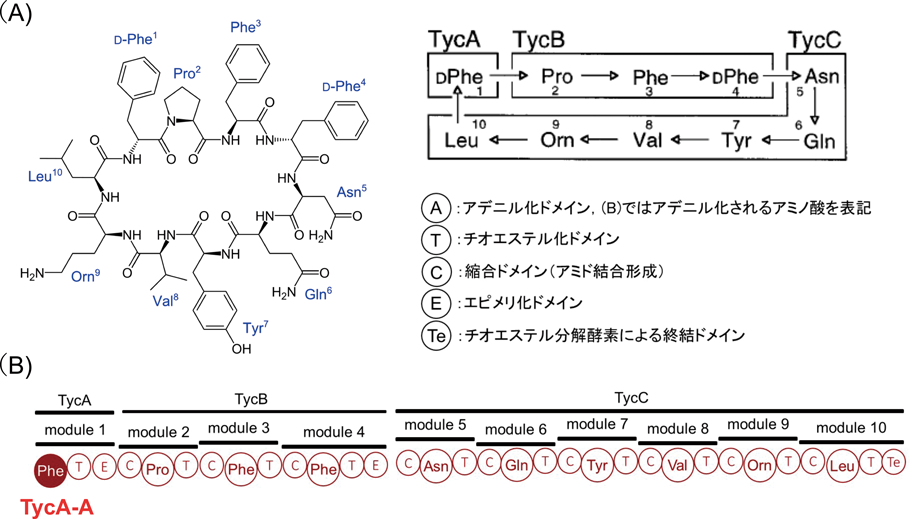
前述したように,放線菌などの微生物が産生する多様なペプチドはNRPSによって合成されているものが多く,D-アミノ酸を含むペプチドのシステマティックな合成反応システム34)には生物が作り上げた緻密さと芸術性を感じる.筆者らは,Lalを用いたジペプチド合成の研究において,N末端に配置されるアミノ酸の基質特異性は厳密であるが,C末端に基質特異性の制限を受けにくいことを経験的に感じていた.そこで,ペプチド合成におけるアミド結合形成は活性化されたカルボキシ基へのアミンによる求核置換反応によって進行するため,カルボキシ基を活性化できれば求核活性を有するアミノ酸を作用させるだけでジペプチド合成が達成できるとの仮説を立てた.Lalはカルボキシ基の活性化と縮合反応を触媒する両活性を併せ持つ独立したタンパク質であるため,上記推察を検証するためには,一つのまとまった反応に必要な機能ドメインを一式持ち合わせているNRPSのモジュールの利用を考えた.具体的には,環状デカペプチドであるチロシジン(tyrocidine)産生に関わるNRPSのモジュールの一つであるTycAに着目し,基質アミノ酸のカルボキシ基をアデニル化するドメインTycA-Aをトリミングすれば独立した単独酵素のように扱うことができると予想して前述の仮説を検証した.TycA-Aの基質となるTrpをN末端アミノ酸として検討したところ,予想どおり縮合酵素が存在しないにもかかわらず求核剤として作用させたアミノ酸のすべてがTrpと連結し,対応するジペプチドの合成を確認することができた.しかも,化学的な求核置換反応のみに依存しているためか,キラリティに関係なくD-アミノ酸もC末端基質として導入可能であった.また,ヒドロキシアミノ酸やβ-およびγ-アミノ酸をはじめとした非標準アミノ酸,さらにはアミノ酸に限定されず直鎖状および環状のアミンなど多様な化合物が求核剤として作用し,それらが結合した多彩なアミド化合物の合成を確認することができた(図6).アデニル化ドメインによる酵素反応とアミンのような求核剤による化学反応を連携させたユニークなアミド結合形成反応(chemoenzymatic amide bond formation reaction)は,その反応機構や合成可能な化合物の多様性を考えるときわめて画期的なアミド化合物合成法であり,創薬や機能性化成品の開発研究の進展に大きく貢献するものと確信している35).
2)D-アミノ酸を基質とするアデニル化酵素の探索と利用
TycA-AはPheが本来の生理基質であるが,Trp, Tyr, Val, Leu, Metも基質とし,さらにそれらのD-アミノ酸も基質とする興味深いアデニル化ドメインである.生合成されたチロシジンではPheはD-Pheとして組み込まれているが,これはモジュールTycA内に存在するエピメリ化ドメインによってD-Pheに変換制御されている.TycA-AがなぜPheのみならず多くのアミノ酸やそのD体を同じように認識しているのかは興味あるところであるが,TycA-AのNRPS内での位置や機能から,仮にアデニル化段階でアミノ酸の種類やそのD,L体を区別しなくても,その後に控えているエピメリ化ドメインや本来の基質であるD-Pheおよび次の基質となるProを厳密に認識して結合する縮合ドメインが存在するのであれば,微生物菌体内でのチロシジン生合成は問題なく完成することになる.この作業仮説に基づいて,TycA-Aと同じような配置をとるアデニル化ドメインを各種NRPSの中から探索したところ,TycA-Aと同じようにD-,L-アミノ酸を基質とする新規アデニル化ドメインを効率よく見いだすことができた36).これは前述の仮説を支持する結果と考えており,微生物のキラリティ認識に関わるあいまいさと,その上でキラリティを厳密に制御するメカニズムが構築されているという絶妙な生命システムの一端を垣間見るようである(図7).
B. subtilis 168株由来のDltAはグラム陽性細菌のペプチドグリカン合成に関わる酸–チオール結合酵素であるが,DltAとチオール基を有するCysの特性を生かしてCysをC末端に配置するジペプチド(D-Xaa-Cys)を合成する報告がある37).この反応はチオール基の存在が不可欠で,DltAによってD-XaaとCysの間に生成したC-S結合がC-N結合に転移する有機化学的な反応によって進行するが,筆者らは自身の開発した化学酵素的アミド結合形成反応系にDltAを適用できることを明らかにしている.DltAが有する幅広い基質特異性(D-Ala,D-Ser,D-Thr,D-Cys,D-Val, Ala, Ser, Gly, β-Ala)を反映して,多様なD-,L-アミノ酸混合型ジペプチドの合成が可能となった.C末端にはこのアミド結合形成反応の特徴を生かして,Cys以外の非標準アミノ酸,さらにはアミノ酸以外にも求核活性を有する多種類の化合物を連結することができる.
3)D-,L-アミノ酸を含むジペプチドや環状ジペプチドの合成
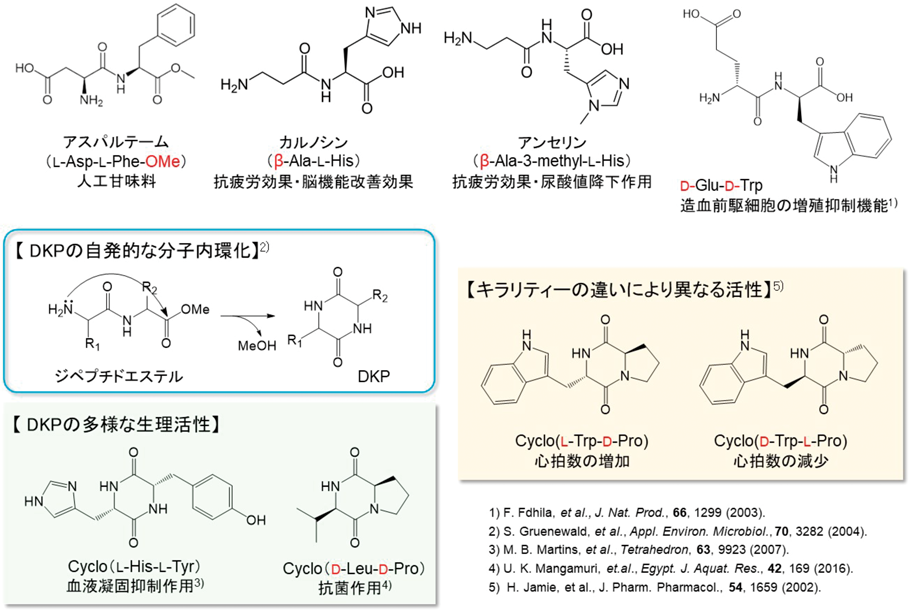
キラリティを制御したD-,L-アミノ酸を任意に含有するジペプチドの酵素合成がNRPSのアデニル化ドメインを利用して可能となった.この化学酵素的アミド結合形成反応系を利用して合成可能となるジペプチドエステルは自発的分子内環化によって,最小の環状ジペプチド[2,5-ジケトピペラジン(2,5-diketopiperazine:DKP)]を生成する.DKPは構成するアミノ酸やその光学異性によってさまざまな生理活性を示すことが知られているため医薬品原料として期待されている(図8).前述のキラリティを制御した任意のジペプチドエステルの合成法の開発によって,多彩な立体構造に起因する新たな生理活性を示すDKPの創出も可能になると考えている38).
地球上の生物はL体の標準アミノ酸で構成されるタンパク質が生命維持の中心的役割を担っているが,生体防御や環境適応など生存戦略としてD-アミノ酸を含む細胞構造体やペプチド性抗生物質を合成する活性を有している.アミノ酸リガーゼやNRPSのような酵素反応系がそれら生理活性物質の生合成の一端を担っているが,触媒活性を有する一部の酵素などでは基質特異性が厳密でなく,D-,L-アミノ酸を区別なく基質とするものが存在している.NRPSを構成するアデニル化ドメインで明らかになったように,こうした酵素のあいまいさを許容するメカニズムが生命システムに備わっていることは興味深い.一方で,生物の多様な機能を利用した有用物質生産プロセスの開発研究を進めている筆者らにとっては,この酵素のあいまいさが利用価値を生み,新たな研究の可能性を示してくれていると考えている.今回,NRPSに存在するアデニル化ドメインを利用するアミド化合物の合成法を紹介したが,自然界にはアミノ酸以外に芳香族カルボン酸や脂肪酸をアデニル化する酵素やホタルルシフェラーゼのような酵素が数多く報告されており,こうした酵素活性ドメインの利用にも大きな可能性を感じている.このような革新的な合成反応プロセスの開発によって,今後,非標準アミノ酸が有用化合物の重要な構成アミノ酸として脚光を浴びることを期待したい.
本稿で紹介した化学酵素的アミド結合形成反応は,有用アミド化合物の汎用性の高い合成法として大きく貢献するものであるが,化学反応と酵素反応の特長を巧みに組み合わせる方法論はアミド結合形成にとどまらず,その他の反応システムによるものづくり研究にも適用できると考えている.
引用文献References
1) 宮本哲也(2019)細菌のD-アミノ酸生合成機構とその機能.生化学,91, 309–315.
2) 老川典夫(2010)食品中のD-アミノ酸:おいしさとの関連と食品産業への応用.BIO INDUSTRY,27, 44–48.
3) Sawai, T., Koma, D., Hara, R., Kino, K., & Harayama, S. (2007) A high-throughput and generic assay method for the determination of substrate specificities of Thermophilic α-aminotransferases. J. Microbiol. Methods, 71, 32–38.
4) 浅野泰久,安川和志(2014)産業応用を見据えたD-アミノ酸代謝酵素研究.BIO INDUSTRY,31, 49–56.
5) 木野邦器(2021)有用微生物酵素の探索とバイオプロセス開発への応用研究.生物工学会誌,99, 2–14.
6) 柴崎 剛,尾崎明夫(2000)2-オキソグルタル酸依存型ジオキシゲナーゼ・プロリン水酸化酵素の開発.化学と生物,38, 204–209.
7) Hara, R. & Kino, K. (2009) Characterization of novel 2-oxoglutarate dependent dioxygenases converting L-proline to cis-4-hydroxy-L-proline. Biochem. Biophys. Res. Commun., 379, 882–886.
8) 協和発酵バイオ株式会社プレスリリース(2011.5.12)https://www.kyowakirin.co.jp/pressroom/news_releases/2011/20110512_01.html
9) Hara, R., Nishikawa, T., Okuhara, T., Koketsu, K., & Kino, K. (2019) Ectoin hydroxylase displays selective trans-3-hydroxylation activity towards L-proline. Appl. Microbiol. Biotechnol., 103, 5689–5698.
10) Hara, R. & Kino, K. (2020) Enzymatic reactions and microorganisms producing the various isomers of hydroxyproline. Appl. Microbiol. Biotechnol., 104, 4771–4779.
11) 木野邦器(2009)アミノ酸水酸化酵素の開発と応用.ファインケミカル,38, 56–63.
12) Hara, R., Yamagata, K., Miyake, R., Kawabata, H., & Kino, K. (2017) Discovery of lysine hydroxylases in the clavaminic acid synthase-like superfamily for efficient hydroxylysine bioproduction. Appl. Environ. Microbiol., 83, e00693-17.
13) Kino, K., Hara, R., & Nozawa, A. (2009) Enhancement of L-tryptophan 5-hydroxylation activity by structure-based modification of L-phenylalanine 4-hydroxylase from Chromobacterium violaceum. J. Biosci. Bioeng., 108, 184–189.
14) 木野邦器(2006)アミノ酸連結酵素の探索とジペプチド合成への利用.BIO INDUSTRY,23, 59–67.
15) Healy, V.L., Lessard, I.A., Roper, D.I., Knox, J.R., & Walsh, C.T. (2000) Vancomycin resistance in enterococci: Reprogramming of the D-ala-D-ala ligases in bacterial peptidoglycan biosynthesis. Chem. Biol., 7, R109–R119.
16) Sato, M., Kirimura, K., & Kino, K. (2005) D-amino acid dipeptides production utilizing D-alanine-D-alanine ligases with novel substrate specificity. J. Biosci. Bioeng., 99, 623–628.
17) Sato, M., Kirimura, K., & Kino, K. (2006) Substrate specificity of thermostable D-alanine-D-alanine ligase from Thermotoga maritima ATCC 43589. Biosci. Biotechnol. Biochem., 70, 2790–2792.
18) Sato, M., Masuda, Y., Kirimura, K., & Kino, K. (2007) Thermostable ATP regeneration system using polyphosphate kinase from Thermosynechococcus elongatus BP-1 for D-amino acid dipeptide synthesis. J. Biosci. Bioeng., 103, 179–184.
19) Tabata, K., Ikeda, H., & Hashimoto, S. (2005) ywfE in Bacillus subtilis codes for a novel enzyme, L-amino acid ligase. J. Bacteriol., 187, 5195–5202.
20) Tabata, K. & Hashimoto, S. (2007) Fermentative production of L-alanyl-L-glutamine by a metabolically engineered Escherichia coli strain expressing L-amino acid α-ligase. Appl. Environ. Microbiol., 73, 6378–6385.
21) 木野邦器(2009)機能性物質生産に向けた酵素探索と評価.生物工学会誌,87, 186–189.
22) Kino, K., Nakazawa, Y., & Yagasaki, M. (2008) Dipeptide synthesis by L-amino acid ligase from Ralstonia solanacearum. Biochem. Biophys. Res. Commun., 371, 536–540.
23) Kino, K., Noguchi, A., Nakazawa, Y., & Yagasaki, M. (2008) A novel L-amino acid ligase from Bacillus licheniformis. J. Biosci. Bioeng., 106, 313–315.
24) 木野邦器(2010)オリゴペプチド合成を触媒する新規アミノ酸リガーゼ.Yakugakuzasshi,130, 1463–1469.
25) Arai, T., Arimura, Y., Ishikura, S., & Kino, K. (2013) L-amino acid ligase from Pseudomonas syringae producing tabtoxin can be used for the enzymatic synthesis of various functional peptides. Appl. Environ. Microbiol., 79, 5023–5029.
26) Kino, K., Kotanaka, Y., Arai, T., & Yagasaki, M. (2009) A novel L-amino acid ligase from Bacillus subtilis NBRC 3134, a microorganism producing peptide-antibiotic rhizocticin. Biosci. Biotechnol. Biochem., 73, 901–907.
27) Kino, K., Arai, T., & Tateiwa, D. (2009) A novel L-amino acid ligase from Bacillus subtilis NBRC 3134 catalizes oligopeptide synthesis. Biosci. Biotechnol. Biochem., 74, 129–134.
28) Arai, T. & Kino, K. (2010) New L-amino acid ligase catalyzing oligopeptide synthesis from various microorganisms. Biosci. Biotechnol. Biochem., 74, 1572–1577.
29) 矢ヶ崎誠,田畑和彦,池田 創,橋本信一(2006)高効率ジペプチド工業製法の開発.BIO INDUSTRY,23, 26–34.
30) Kino, H. & Kino, K. (2015) Alteration of the substrate specificity of L-amino acid ligase and selective synthesis of Met-Gly as a salt taste enhancer. Biosci. Biotechnol. Biochem., 79, 1827–1832.
31) Kino, H., Nakajima, S., Arai, T., & Kino, K. (2016) Effective production of Pro-Gly by mutagenesis of L-amino acid ligase. J. Biosci. Bioeng., 122, 155–159.
32) 木野邦器,木野はるか(2017)L-アミノ酸リガーゼを利用した塩味増強効果を発揮するジペプチドの探索とその効率的な合成法:ユニークな酵素で拡がる機能性ジペプチドの世界.化学と生物,55, 182–188.
33) 木野邦器(2019)アミノ酸リガーゼを用いたイミダゾールジペプチド合成法の開発.第73回日本栄養・食糧学会大会(静岡),SY12-3, 講演要旨集,p. 171.
34) 鷲尾健司,森川正章(2006)mRNAを鋳型としないペプチド合成反応.化学と生物,44, 85–92.
35) Hara, R., Hirai, K., Suzuki, S., & Kino, K. (2018) A chemoenzymatic process for amide bond formation by an adenylating enzyme-mediated mechanism. Sci. Rep., 8, 2950.
36) Kano, S., Suzuki, S., Hara, R., & Kino, K. (2019) Synthesis of D-amino acid-containing dipeptides using the adenylation domain of nonribosomal peptide synthetase. Appl. Environ. Microbiol., 85, e00120-19.
37) Abe, T., Hashimoto, Y., Zhuang, Y., Ge, Y., Kumano, T., & Kobayashi, M. (2016) Peptide bond synthesis by a mechanism involving an enzymatic reaction and a subsequent chemical reaction. J. Biol. Chem., 291, 1735–1750.
38) 唐鎌翔太,横田光希,鈴木 伸,木野邦器(2020)化学酵素的アミド結合形成システムを応用したキラリティ制御可能なジケトピペラジン合成法の開発.日本農芸化学会2020年度大会(福岡),4A12a09.
著者紹介Author Profile
 木野 邦器(きの くにき)
木野 邦器(きの くにき)早稲田大学理工学術院 教授.工学博士.
略歴1955年札幌市に生る.79年早稲田大学理工学部卒業.81年同大学院理工学研究科博士前期課程修了,同年協和発酵工業(株)入社,99年より現職.科学技術振興機構研究開発戦略センターシニアフェロー,かずさDNA研究所客員特別研究員等を兼任.
研究テーマと抱負微生物の生存戦略に基づく多様な機能を担う酵素の探索と解析・改変を行い,有用物質の創出や合成システムの構築,さらには社会実装を目指した効率的な生産プロセスの開発に取り組んでいる.微生物から多くを学び生命の本質に迫るような研究をしたい.
ウェブサイトhttps://www.waseda-applchem.jp/ja/professors/kino-kuniki/
趣味旅行,食べ歩き.
 鈴木 伸(すずき しん)
鈴木 伸(すずき しん)早稲田大学理工学術院総合研究所 次席研究員.博士(工学).
略歴2014年早稲田大学先進理工学部応用化学科卒業.16年同大学院先進理工学研究科応用化学専攻修士課程修了.17年同大学先進理工学部助手.20年より現職.
研究テーマと抱負酵素を利用したアミド化合物合成に関する研究を行っています.有用アミド化合物の合成や新規機能性アミド化合物の創出,効率的な生産法の開発などを通じて,化学産業や社会に貢献したいと考えています.
趣味パズル.
 原 良太郎(はら りょうたろう)
原 良太郎(はら りょうたろう)京都大学大学院農学研究科産業微生物学講座(寄附講座) 特定准教授.博士(工学).
略歴1979年愛媛県に生る.2009年早稲田大学大学院理工学研究科博士後期課程修了.同年早稲田大学先進理工学部助手.11年早稲田大学理工学術院総合研究所次席研究員.18年より現職.
研究テーマと抱負多種多様な微生物に新しい機能を求め,酵素の探索・機能解析・物質生産に関する研究に取り組んでいる.微生物機能をバイオプロセスに応用し,化学産業の発展に貢献したい.
ウェブサイトhttp://www.sangyo.kais.kyoto-u.ac.jp
趣味ツーリング(バイク・車),運動.