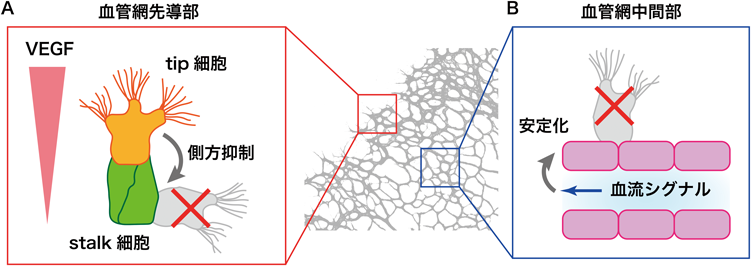
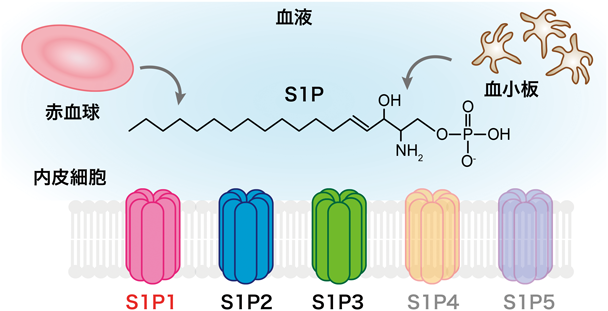
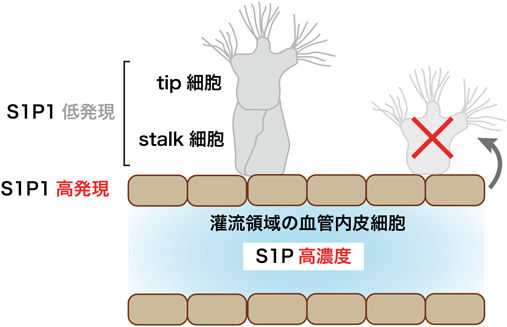
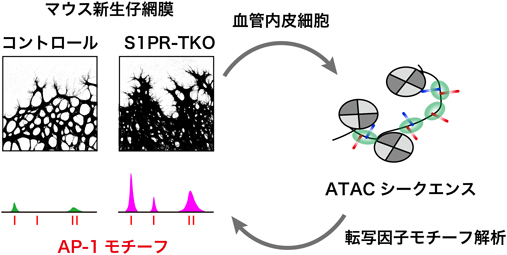
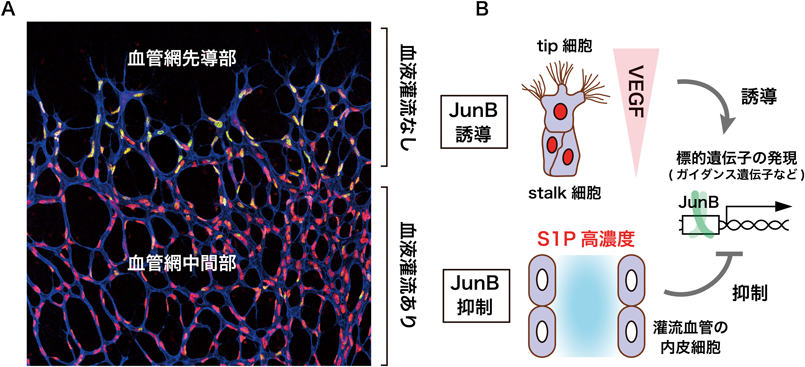
血管新生の終結と血管安定性をもたらす血流シグナル分子スフィンゴシン1-リン酸Vascular stabilization by Sphingosine 1-phosphate
国立国際医療研究センター脂質シグナリングプロジェクトDepartment of Lipid Signaling, National Center for Global Health and Medicine ◇ 〒162–8655 東京都新宿区戸山1–21–1 ◇ 1–21–1 Toyama, Shinjuku-ku, Tokyo 162–8655, Japan