1. ショウジョウバエ精巣:幹細胞制御のパラダイム
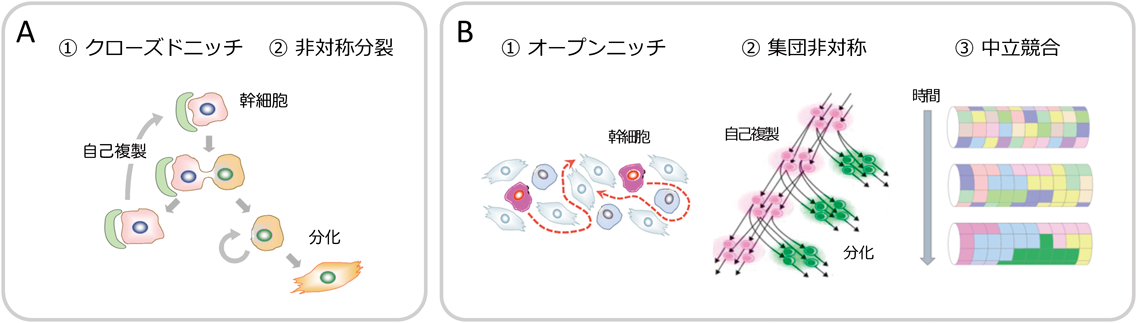
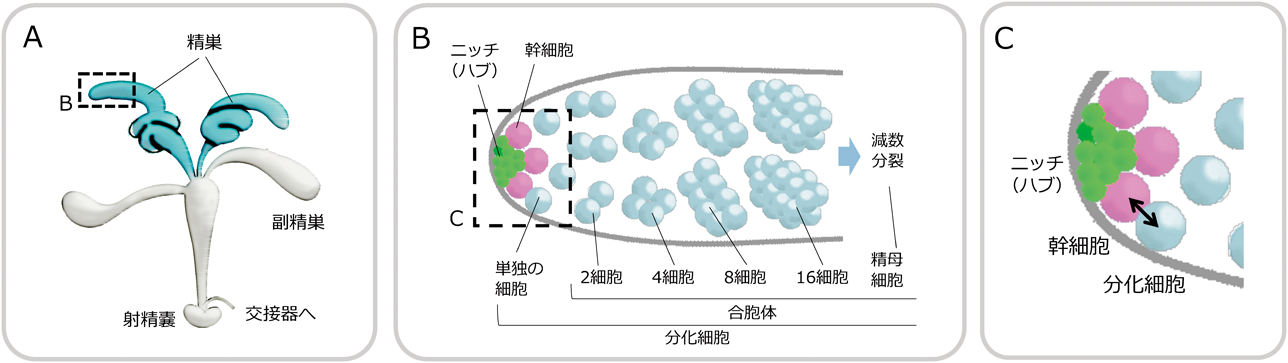
マウス精子幹細胞について述べる前に,幹細胞ニッチと非対称分裂のパラダイムを確立したショウジョウバエの精子幹細胞について簡単に説明したい(オスメス共通に「生殖幹細胞」と呼ばれることが多いが,本稿では精子幹細胞と呼ばせていただく)1).ショウジョウバエ精子幹細胞は,精巣の遠位端で,ハブと呼ばれる特殊な体細胞が作る「ニッチ」と強固に接着している(図2A~C).幹細胞は,厳密に制御された非対称分裂によって,ニッチとの接触を保って幹細胞の性質を維持する娘細胞と,ニッチから離れて分化する娘細胞を生じる.後者は,4回の体細胞分裂によって16個の精原細胞(spermatogonia)となったのちに減数分裂に入る.興味深いことに,これらの分裂は細胞質が完全にちぎれず,娘細胞どうしが細胞質の通路でつながる「不完全分裂」で,一つの幹細胞から生じた16個の精原細胞は,互いに連結して一つの合胞体を形成する.さらに,減数分裂の結果,16×4=64個の半数体細胞が連結した合胞体となり,精子へと分化する.幹細胞から作られた分化細胞は徐々にニッチから離れていき,分化が進行する時間的な順番が空間的な配置に反映される.メスの卵巣でも,組織形態は異なるが,幹細胞はオス同様特殊化したニッチに局在して,非対称分裂を繰り返す.
このように,ショウジョウバエの雌雄の生殖幹細胞は,①特殊な微小環境(ニッチ)に常に存在する,②幹細胞は常に非対称分裂を行う,③ニッチから離れると細胞は分化する,という整然とした振る舞いを示す(図1A).これらの条件が成り立てば,組織ホメオスタシスは見事に説明される.では,ショウジョウバエの精巣と卵巣で明らかとなったこのメカニズムは,他の組織幹細胞にも共通するユニバーサルルールなのだろうか.マウスを例に,哺乳類精巣の精子幹細胞の場合をみていこう.
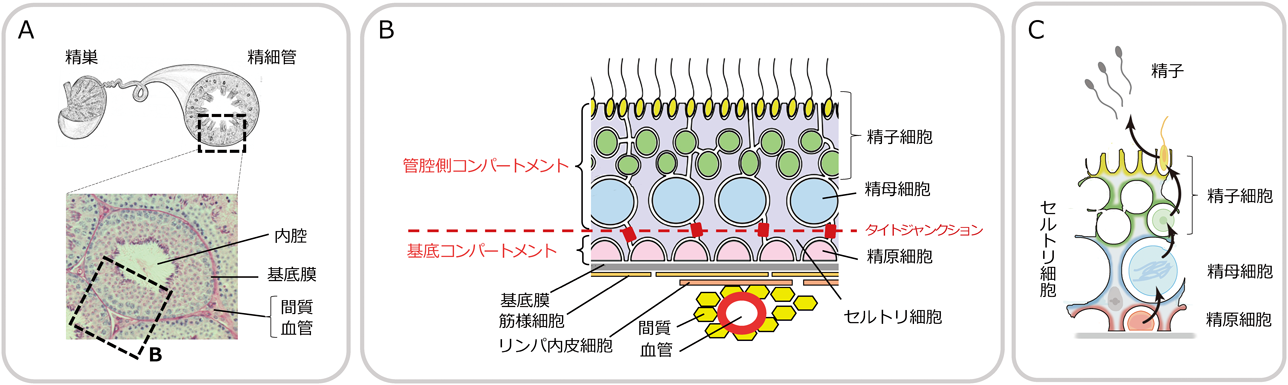
哺乳類の精子形成は,精巣を構成する精細管(seminiferous tubules)と呼ばれる管状の組織で進行する(図3)2, 3).多数の精細管がループ構造を作り,精巣網と呼ばれる精子の出口に両端を開口している.精細管は,動物種を問わず直径が150~200マイクロメートル程度,精巣あたりの合計の長さはヒトで250メートル,マウスでも1.7メートルに及ぶ.この長い精細管が,綺麗に折りたたまれて被膜(白膜)の中に納まっている.精細管の間には血管が走行し,男性ホルモンを作るライディッヒ細胞やマクロファージなどの間質細胞が詰まっている(図3A).
精細管は,一つ一つの細胞にとっては無限といってよいほど長い.そして,その構造は単純かつ均一で,金太郎飴のように「切っても切っても精細管」状態である(図3A).これは,安定して多数の精子を作るのに実に都合がよいのだが,我々研究者にとっても,再現性がきわめて高くて構造が単純明快な組織を大量に解析できることを意味する.多数の幹細胞の振る舞いを観察して,統計的に解析するのに実に都合がよい.解剖学的に複雑な構造を持つ神経系の幹・前駆細胞や,逆にアモルファスで典型的な構造を示さない骨髄の造血幹細胞の研究では得られない,幹細胞研究のストロングポイントの一つである(逆につまらないと感じる人もいるかもしれないが).
精細管は,精子幹細胞が自己複製するとともに,幹細胞から生まれた細胞が精子まで分化する舞台である.その管状のフレームワークは,体細胞であるセルトリ細胞が作る(図3B).セルトリ細胞は高度に極性化した上皮細胞で,基底膜に接着し,発達した密着結合(タイトジャンクション)を持つ(図3C).このタイトジャンクションが,血液精巣関門(blood-testis barrier)の実体で,基底膜とタイトジャンクションの間の「基底コンパートメント」と,内側の「管腔側コンパートメント」を隔てる.精細管の間を走る毛細血管からにじみ出た細胞間液は,基底コンパートメントまで到達するが,タイトジャンクションを越えることはない.管腔側コンパートメントには,セルトリ細胞の細胞質を経由して水が輸送され,基底コンパートメントとは異なる外液環境を作るとともに,管腔内を通って精巣網に至る流れを作り出す4).
セルトリ細胞が形作る上皮の間で,生殖細胞は精子へと分化する(図3B).基底コンパートメントは,体細胞分裂で増える「精原細胞」の安住の地である.精原細胞には,自己複製する「幹細胞」とともに,分化に向かいながら増幅する「前駆細胞」が含まれる.減数分裂に入ると「精母細胞」と呼び名が変わり,タイトジャンクションを越えて管腔側コンパートメントに移動する.このとき,精母細胞を上下から挟むように二つのタイトジャンクションが一時的に作られ,二重扉のある前室のように,脳精巣関門の機能を損なわずに細胞だけが通り抜ける5).しかし,多数のセルトリ細胞の間に入り込んだ数十から数百個の精母細胞は,互いに連結して巨大な網のような合胞体を作っている.複雑に枝分かれした合胞体が丸ごとタイトジャンクションを通り抜けるのである.しかも,同じ基底コンパートメントにありながら,精原細胞が二重扉に取り込まれて管腔側に移動することは決してない.どうすればこのような制御ができるのか,簡単には想像できないが,実際に起こっているのだ.管腔側コンパートメントに移った後に減数分裂を完了して半数体となった「精子細胞」は,成熟精子へと形を変えながらさらに内腔側に移動して,最終的に管腔に放出される.この一連のプロセスに,マウスで1か月,ヒトでは2か月の期間を要する.
ところで,セルトリ細胞は実に興味深い細胞である.マウスでは生後2週間くらいで分裂を停止し,その後入れ替わることなく一生涯にわたって精子形成を支えるとされる.巨大な細胞表面は高度に機能分化して,薄く延びた細胞質が精原細胞,精母細胞,精子細胞を包み込み,それぞれに適した微小環境を提供している.生殖細胞からみると,精原細胞から成熟精子まで,セルトリ細胞の表面を基底側から管腔側まで1か月かけて移動するのである(図3C).
精細管の周り,基底膜の外側には,扁平な筋様細胞(精細管側)とリンパ内皮細胞(間質側)が存在する(図3B).筋様細胞は,基底膜表面を隙間なく覆っている平滑筋様の性質を持つ細胞で,精細管を収縮させて管腔内フローの形成に寄与すると考えられているが,よくわかっていない.リンパ内皮細胞は,間質細胞と筋様細胞の間に存在する.精巣はリンパ管構造を持たず,細胞外液が流れる間質領域を内側から覆うことからこう呼ばれるが,大きくて扁平で隙間だらけで,通常のリンパ管の内皮とはまったく違う姿をしている.これらの細胞は,セルトリ細胞とともに,基底膜を挟んで精原細胞(すなわち精子幹細胞や前駆細胞)が存在する基底コンパートメントの微小環境を構成する要素となっている.
以上は,精細管の大部分(マウスで99%以上,ヒトではさらに多い)を占める「曲精細管」の話である.一方,曲精細管と精巣網を連結する「直精細管」領域は,セルトリバルブと呼ばれる特殊な組織構築を呈し,幹細胞が多く集まる.この付近では,低頻度ながらセルトリ細胞の入れ替わりが起こっていることも知られている.本稿では,文献を紹介するにとどめさせていただくが,幹細胞制御も異なっており興味深い領域である6).
3. 未分化型精原細胞:精子形成を支えるヘテロな幹細胞集団
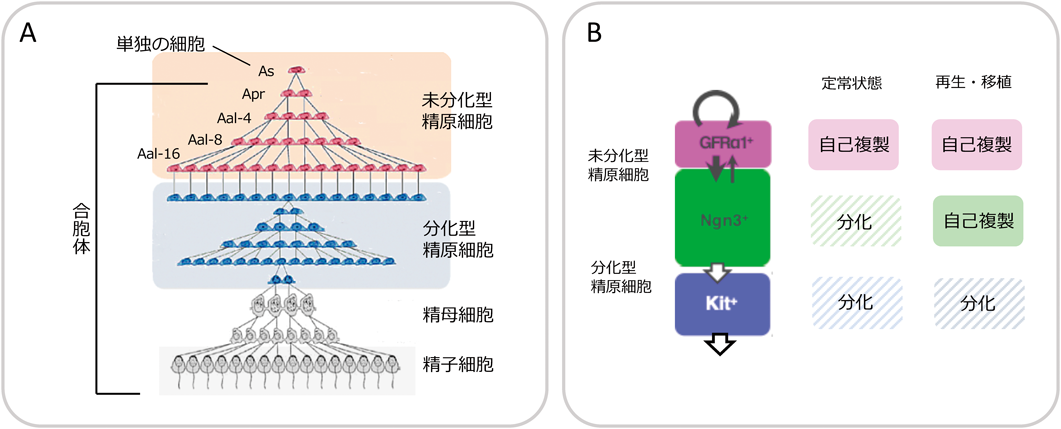
「基底コンパートメント」すなわちセルトリ細胞のタイトジャンクションと基底膜の間にいる精原細胞は,「未分化型」と「分化型」に分けられる(図4A)2, 7, 8).未分化型精原細胞は自分自身を維持するとともに分化型精原細胞を作り出し,幹細胞としての役割を担う.一方,分化型精原細胞は不可逆的に分化にコミットした前駆細胞で,6回の体細胞分裂を経て,理論的には26=64倍に増幅したのちに減数分裂に入る(実際には細胞死の結果,生き残るのは1/4にすぎないといわれている).前述のように,減数分裂に入ると基底コンパートメントを出て,タイトジャンクションを越えて管腔側コンパートメントに移動する.生殖細胞全体の1%に満たない,少数の「未分化型精原細胞」が,本稿のメインプレーヤーである.
未分化型精原細胞の数は少ないが,決して均一ではない.形態的にも遺伝子発現の観点からもヘテロな集団である.形態的には,一般的な細胞同様一つ一つバラバラになった細胞と,複数の細胞がつながった合胞体とがある(図4A.合胞体は,細胞質分裂が完全に終了せず,娘細胞どうしの連結が残存することによって形成される.単独の精原細胞をAs(A-single),2個つながったものをApr(A-paired),3個以上をAal(A-aligned)と呼ぶ.合胞体(AprおよびAal)は,「細胞間橋」を介して細胞質を共有することで細胞周期が同期するため,同じ合胞体を構成する細胞は同じタイミングで分裂を繰り返す.合胞体の大部分が2n個(2, 4, 8, 16など)の細胞が連結したものであることは,このことを反映する.しかし,図4Aには書かれていないが,3, 5, 6などそれ以外の数の合胞体も少数ながら確実に存在することに留意いただきたい9, 10).
遺伝子発現においても,未分化型精原細胞は不均一である8, 11–13).現在,トランスクリプトームその他のシングル細胞オミックスが,組織幹細胞生物学やその他の多細胞生物の研究分野に革命を巻き起こしている.多くの組織で今まで知られていなかった細胞集団が次々と明らかになっている.未分化型精原細胞も例に漏れず,その興味深い不均一性が明らかになってきている.これは現在進行形のテーマであり,精子幹細胞の理解が今後どのように進むか,楽しみである14).一方,主に今世紀に入ってから「クラシック」な手法による遺伝子マーカー探索や,それらを利用した細胞系譜追跡が精力的に行われてきた結果,未分化型精原細胞集団の幹細胞としての役割と,形態や遺伝子発現の不均一性との関係が少しずつ明らかにされてきている8, 11).
過去10年から15年間の研究の結果,未分化型精原細胞は,大雑把に「より未分化な画分」と「分化に向かった画分」に分けられることがわかってきた14–24).前者はGFRα1やNanos2, Id4,後者はNgn3, Nanos3, RARγ, Miwi2をはじめとする遺伝子によって特徴づけられる(他にもたくさんの遺伝子が知られている).形態的には,前者の多くはAsあるいはAprで,少数のAal-3やAal-4が含まれる.一方後者は,より長い合胞体が多く,As, Aprも含まれるが,その数は少ない.このように形態と遺伝子発現は相関しているが,一対一の厳密な対応があるわけではない.
我々は,タモキシフェン(tamoxifen)誘導的Creリコンビナーゼを用いてGFRα1陽性細胞やNgn3陽性細胞をパルス標識して,その運命を追跡した9, 16, 17).その結果,成体マウス精巣の生理的条件で恒常的に進行する精子形成では,前者が自分自身を維持するとともに後者を作り出すこと,後者はまれにしか自己複製せずほぼすべてがKit陽性の分化型精原細胞に分化することがわかった(図4B).GFRα1陽性の未分化型精原細胞の性質や精細管基底コンパートメントでの振る舞いを知ることが,精子幹細胞を理解する上でのキモであることを意味する.
4. オープンニッチ:精細管を動き回るGFRα1細胞
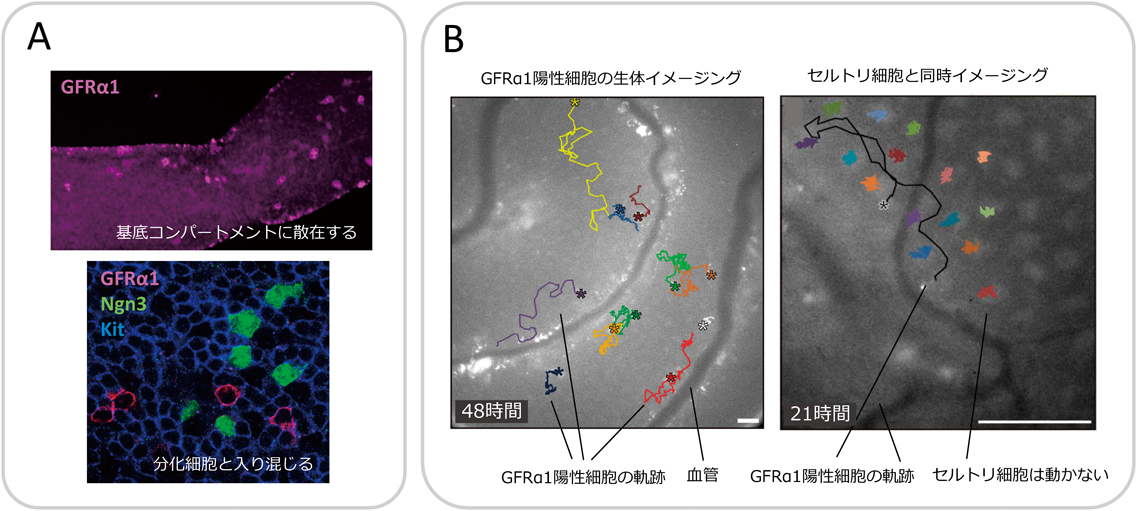
基底コンパートメントで,GFRα1陽性未分化型細胞は1か所に集まることなく,Ngn3陽性の未分化型細胞やKit陽性の分化型精原細胞の間に散らばって存在している(図5A)9).さらに,生体ライブイメージング法による観察を行った9, 25).これは我々が開発した手法で,成体マウスを麻酔下に維持し,正常の血流を保った精巣組織中の蛍光タンパク質標識された細胞を,数日間にわたって連続撮影することを実現した25).その結果,GFRα1陽性未分化型細胞が,セルトリ細胞の間を縫うように活発に動き回っているようすが明らかとなった(図5B).その動きは,分化に向かったNgn3陽性細胞やKit陽性細胞よりもはるかに活発であった.GFRα1陽性細胞は基底コンパートメント全体にみられるが,丁寧に観察すると,間質や血管(正確には,間質の中を走る中動脈や中静脈)に近い場所では密度が高いことがわかった9).間質や血管に近接する傾向はNgn3陽性細胞でより顕著になるが,Kit陽性細胞に分化するときには,精細管全体に満遍なく散らばるように移動する25).このことから,基底コンパートメントの中でも,血管や間質付近の微小環境は,より自己複製しやすい環境となっていることが示唆される.我々は,「血管構築に関連したニッチ」(vasculature-associated niche)と名づけた3, 25).血管が幹細胞ニッチに関わる例は,中枢神経系など他の組織でも知られており,組織に偏りを作るときに便利なやり方なのかもしれない.
このような観察結果が教えてくれるのは,幹細胞は明瞭な構造を持つ決まった指定席「ニッチ」でじっとしていて,分化に向かう子孫細胞はそこから離れていく,という古典的なパラダイム(図1A)とはまったく異なる幹細胞の姿である.最近では,ショウジョウバエ精巣のような古典的なニッチは「閉じたニッチ(closed niche)」あるいは「確定的ニッチ(definitive niche)」,マウス精巣のように幹細胞と分化細胞が入り混じって存在する場合は「開かれたニッチ(open niche)」あるいは「条件的ニッチ(facultative niche)」と呼ばれることが多い(以下,「クローズドニッチ」「オープンニッチ」と記す)(図1B①)26–28).いくつかの組織を比較すると,「組織幹細胞ニッチ」は,さまざまなバリエーションを含む連続的な概念として理解することができそうである26).その中で,ショウジョウバエとマウスの精子幹細胞のニッチが両極端に位置して,クローズドニッチとオープンニッチの典型となっているのは,少し面白い.
クローズドニッチとオープンニッチでは,幹細胞の分布や動きだけでなく,自己複製や分化を制御する細胞外リガンド分子の分布や作用にも大きな違いがある26, 29).クローズドニッチでは,ニッチ細胞特異的に自己複製因子[ショウジョウバエ精巣の場合はUnpaired(Upd)]が生産され,近接する幹細胞だけが受容できる環境を作っている.実に明瞭である.一方,マウス精巣のオープンニッチでは,GFRα1陽性細胞の自己複製を促進して分化を抑制することが知られているグリア細胞株由来神経栄養因子[glial cell line-derived neurotrophic factor(GDNF);GFRα1はこの因子の受容体である]や,線維芽細胞増殖因子[fibroblast growth factors(FGFs)],GFRα1陽性細胞からNgn3陽性細胞への分化を促進するWntや,Ngn3陽性細胞からKit陽性細胞への分化を誘導するレチノイン酸は,いずれも特定の領域に限局しない30–37).
GDNFやWnt(特にWnt6)は主にセルトリ細胞によって,レチノイン酸はセルトリ細胞と分化途中の生殖細胞が協調することによって作り出され,未分化型精原細胞に作用する.興味深いことに,これらのシグナルは異なるタイミングで順序よく活性化され,それが8.6日周期で繰り返される.いずれも,ONのフェーズでは精細管のとある区画全体で全周にわたって活性化され,OFFのフェーズでは全体で抑制される3, 38).しかも,活性化のタイミングが精細管の長軸方向に沿って少しずつずれており,活性化領域は時間とともに精細管に沿って移動する.これらは,1950~60年代に「精細管周期」と「精子形成の波」として組織学的に記載された精細管環境の時空間パターン2, 39–41)に一致するもので,未分化型精原細胞の増殖や分化に時間的・空間的周期性を与えている.一方,FGF(FGF5など)が精細管を取り囲むリンパ内皮細胞に発現することを,最近我々は報告した37).この細胞は間質付近に比較的多く存在する一方で,精細管周期に関連したFGFsの発現変動は認められず,未分化型精原細胞の分布に空間的偏りをもたらす一因と考えている(詳しくは後に述べる).
基底コンパートメントにおける,このような細胞外因子の時間的空間的分布は,動き回る精子幹細胞(GFRα1陽性精原細胞)の自己複製や分化を,いちいち厳密に規定することはできそうにない.そのかわり,未分化型精原細胞の亜集団によってこれらのシグナルに対する反応性が異なっており,幹細胞が全て自己複製したり,全て分化してしまうようなことにはならない18, 32).残念ながら本稿では詳しく語れないが,時間的・空間的に変動するオープンニッチの微小環境で,未分化型精原細胞がシグナルに対する反応性を変えながら増殖,自己複製,分化を行うサマは,実にうまくできている.全貌の理解にはいまだ遠いが,現在の知見については他稿を参照いただきたい3, 26).
5. 集団非対称と中立競合:未分化型精原細胞のランダムな挙動
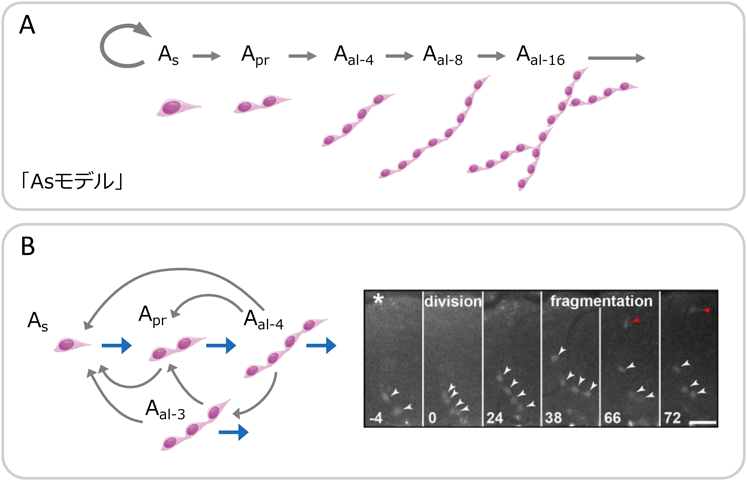
GFRα1陽性細胞の集団は,自らを維持しながらNgn3陽性細胞を作り出す.ではそのとき,一つ一つの細胞はどのように挙動しているのだろうか? 「幹細胞は,自己複製する娘細胞と,分化する娘細胞を生み出す非対称分裂を繰り返す」というパラダイム(図1A)に従えば,この問いの答えはおのずから明らかに思われる.しかし,可能な限り先入観を排除してGFRα1陽性細胞一つ一つの運命を追跡することが大切である.そもそも,GFRα1陽性の未分化型精原細胞にはAs細胞と合胞体(Apr, Aal)があるため,この図式を単純に適用するわけにはいかない.As細胞の分裂には,完全分裂によって二つのAs細胞を作る場合と不完全分裂によってAprを作る場合があると想定されるからである.1971年に提唱されて定説となった「Asモデル」ではAs細胞=幹細胞,合胞体=分化細胞と規定する(図6A)42).その場合,As細胞の完全分裂は1個の幹細胞が2個に増える「自己複製分裂」,不完全分裂は1個からゼロになる「分化分裂」と理解される.定常状態では幹細胞の数は変わらないので,Asモデルに従うと「完全分裂=自己複製分裂」と「不完全分裂=分化分裂」の頻度は釣り合っていなければならない43).
そこで,生体ライブイメージング法によって撮影された,GFP標識GFRα1陽性As細胞の分裂パターンを,通算1年分解析した9).驚いたことに,そのほとんどがAprを生み出す不完全分裂であった.これでは時間経過とともにAs細胞が枯渇してホメオスタシスが維持できなくなってしまう.しかし同時に,AalやAprの細胞間橋がちぎれる「断片化」が起こることで,失われたAs細胞が補充されていることがわかった(図6B).As細胞はずっとAs細胞であり続けるのではなく,不完全分裂と断片化によって,As細胞と合胞体の間を行き来しながら集団を維持していることになる.Asモデルの再考を求めるもので,議論は現在も続いている8, 12, 13, 38).
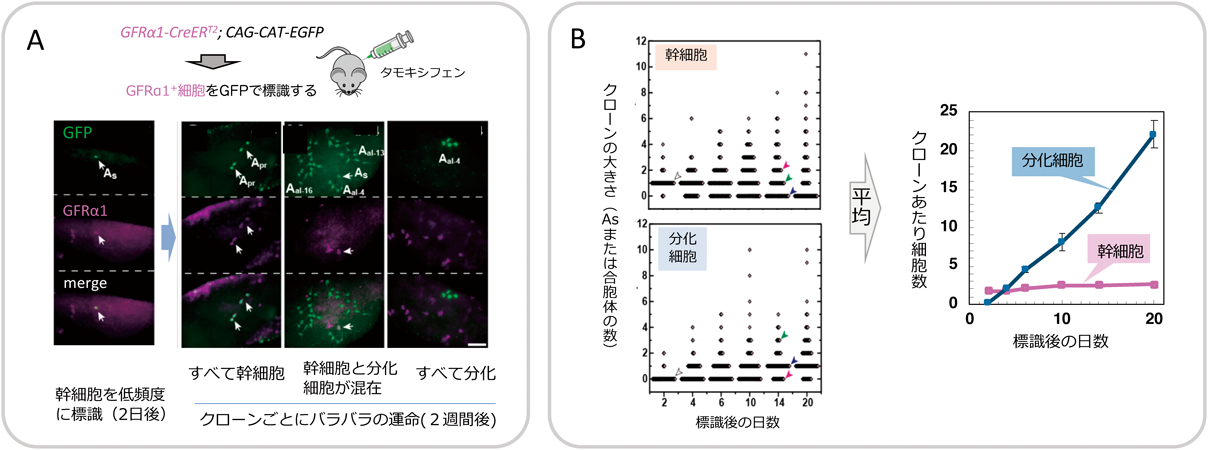
ライブイメージングは細胞の挙動を直接観察できる一方,数日の観察が限界で,それより長時間にわたる運命はわからない.そこで,GFRα1-CreERマウスにタモキシフェンを低濃度で投与することでGFRα1陽性細胞を低頻度で標識し,一つ一つのGFRα1陽性細胞(Asあるいは合胞体)の子孫細胞が作るクローンの運命を,数日から1年以上にわたって追跡した9).その結果,GFRα1陽性細胞は,クローンごとてんでバラバラの運命をたどることがわかった.分裂によって増えた子孫すべてがGFRα1陽性であるクローンもあれば,分化したGFRα1陰性細胞だけからなるクローン,これらが混じったクローンもある,といった具合である(図7A).クローンごとの運命のばらつきは時間とともに拡大する(図7B左).しかし興味深いことに,多数のクローンの平均をとると,幹細胞の数は一定に維持されて着実に分化細胞が生まれるという,典型的な幹細胞ホメオスタシス動態を示すことがわかった(図7B右).自己複製と分化という幹細胞運命の非対称性は,一つ一つの細胞分裂で決まるのではなく,組織レベルでバランスされているのだ.この動態は「集団非対称」と呼ばれる(図1B②)8, 44).
興味深いことに,生体ライブイメージングによって計測した頻度に基づいて,GFRα1陽性細胞が不完全分裂と断片化をランダムに繰り返す数理モデルを構築すると,クローンのバラバラな運命を正しく予測できることがわかった9, 45).さらに,安定して観察されるAs細胞とさまざまな長さの合胞体(Apr, Aal-3, Aal-4, Aal-5, Aal-6……)の比率が,きわめて高い精度で予測されたことは重要である.Asモデルでは「例外的な存在」とみなされてきた2n個以外の長さの合胞体(Aal-3, Aal-5, Aal-6……)が,不完全分裂と断片化がランダムに起こった結果「必然的に生じる存在」であることを示唆するからである.
幹細胞全体の数を一定に保ちながら一つ一つの幹細胞が自己複製と分化をランダムに選ぶことを繰り返すと,時間経過とともに,子孫すべてが分化して「絶滅」するクローンが生じる一方,生き残ったクローンは幹細胞の数が増えて大きくなる(図1B③).幹細胞クローンの運命を長期間追跡して数理解析を行った結果,1年以上(14か月)にわたる幹細胞クローンの消長が,上記の単純な数理モデルで正確に予測できることが明らかとなった9, 45).この事実は,各幹細胞の子孫細胞からなるクローン(家系)は,互いに「中立競合」の関係にあり,どのクローンが増えてどのクローンが絶滅するのかは,偶然によって決まることを意味する.
このように,精子幹細胞は,集団として安定した(ロバストな)動態を示す一方で,集団を構成する一つ一つの細胞はランダムに振る舞っていることが明らかとなってきた.老婆心ながら「ランダム」は,「確率的」や「ストカスティック」と同義で,ある事象が一定の確率に従って起こることである.ここで注意すべきは,系全体が秩序を失う「カオス」とはまったく別の問題であることだ.集団レベルの秩序(定常状態)と細胞レベルのランダム性は,相性よく共存するのである.
6. 再生と移植:コンテクストによって挙動を変える
組織幹細胞は,定常状態(ホメオスタシス)を維持するだけでなく,組織が障害を受けた後に再生する役割も持っている.その極端な例として,別の個体(宿主)に移植したときに生着して組織の構造や機能を再構成する.造血幹細胞や皮膚の幹細胞の移植は,白血病や火傷などの治療に応用されている.哺乳類の精子幹細胞も,生殖細胞を除去した宿主の精細管内腔に移植すると,精子形成コロニーを再構成して次世代を作る機能的な精子を作ることができる46, 47).この,1994年にBrinsterらによって確立された精子幹細胞移植法は,思春期前にがんを発症して化学療法を受けた患者の妊孕性を保全したり,絶滅に瀕した動物や有用な産業動物などの遺伝資源を保存して個体を復元する手段として大きな期待がかけられている48, 49).しかし,その移植効率は決して高くないのが現状である.
精子幹細胞移植法は,造血幹細胞の場合と同様,幹細胞活性を定量的に測定するゴールドスタンダードとされている.すなわち,移植後十分な時間(多くの場合2~3か月)が経った後,精子形成を再構成したコロニー数(造血幹細胞の場合は宿主造血への寄与率)を数えることで,移植した細胞画分の幹細胞活性(ポテンシャル)を定量的に評価できる.このアッセイは,幹細胞活性を持つ細胞集団をプロスペクティブに同定することを可能とし,精子幹細胞研究に与えた貢献は計りしれない49, 50).本稿では詳述できないが,幹細胞ポテンシャルを保った精原細胞のin vitro培養——この手法の貢献もまた,計りしれない——が確立されたのも,幹細胞移植アッセイの基盤があったからこそである51, 52).
その一方,これも造血幹細胞の場合と同様に,幹細胞が移植されてからコロニーを形成するまでの間のプロセスはブラックボックスとして残されており,どのような細胞が,どのように挙動して移植後のコロニー形成や組織障害後の再生を担うのか? それは定常状態を支える幹細胞と同じ細胞なのか,異なるのか? といった未解決の諸課題が残されていた.
そこで我々は,GFRα1陽性細胞やNgn3陽性細胞をパルス標識したのちに移植して,定常状態での挙動と比較した.その結果,移植や組織障害後の再生には,GFRα1陽性細胞だけでなく,生理的な条件ではめったにホメオスタシスに寄与しないNgn3陽性細胞が大きな貢献を果たすことがわかった(図4B).しかもこのとき,GFRα1陽性細胞への逆戻りが起こっていた16, 17).Ngn3とよく似た発現を示すMiwi2陽性細胞を選択的に殺すと組織再生が遅延することも示された21).これらの結果は,同じ「幹細胞」といっても,その正体は,定常状態と再生状態という組織のコンテクスト(文脈)によって違うことを意味する25).逆にいうと,幹細胞(正確には,幹細胞ポテンシャルを有する細胞)は組織のコンテクストによって挙動を変えるのである.定常状態で自己複製するGFRα1陽性細胞と,定常状態では前駆細胞として働くがGFRα1陽性状態に戻って幹細胞として働く潜在能力を保持しているNgn3陽性細胞は,それぞれ,Chris Pottenのいう「actual stem cells(実際の幹細胞)」と「potential stem cells(潜在的な幹細胞)」の概念に一致する存在といえる(図4B)16, 53).
この,幹細胞がコンテクスト依存的に挙動を変える現象は,我々の観察16)に先立って,ショウジョウバエのオスメスの生殖幹細胞で見いだされていた54, 55).すなわち,精巣や卵巣のニッチに接している幹細胞を遺伝的に除去すると,分化に向かっていた合胞体がバラバラにちぎれて幹細胞に戻るのである.我々の研究に続いて,哺乳類の多くの組織,特に上皮組織の幹細胞が同様の過疎性を示すことが次々と明らかになってきた.組織のコンテクストに依存して挙動を変えるのは,広く組織幹細胞に共通する性質のようだ.
精子幹細胞移植は,応用が期待されているが,現状の移植効率が低いために,実用化への道のりはいまだ遠い.移植効率を向上させるためには,移植された幹細胞が精子形成を再構成するプロセスを詳細に知ることが大切になるが,それは謎に包まれていた.最近我々は,この「ブラックボックス」を開くべく,移植された未分化型精原細胞の宿主精細管内での振る舞いを詳細に解析した.その結果に基づいて,未分化型精原細胞,特にNgn3陽性の「潜在的な幹細胞」の挙動を変え,移植効率を5–10倍上げることに成功した56).精子幹細胞移植技術の実用化に向けて少しでも貢献できれば,うれしい限りである.
7. 組織のルール:個々のランダムな挙動が集団の安定性をもたらす
このように,精細管基底コンパートメントのオープンニッチで,精子幹細胞が「気ままに」振る舞っているようすがわかってきた.同じところにとどまっておらず動き回り,分裂パターンもちゃんと決まっていないし,つながったり千切れたりして常に姿を変えている.分化に向かったと思っても逆戻りできる能力はしばらく失わず,組織障害や移植のコンテクストでは自己複製を始める.しかし,ひとたび集団レベルでみると,精子幹細胞は実に「きちっと」している.定常状態では幹細胞(GFRα1陽性細胞)の数は安定していて,総数(正確には密度=精細管長さあたりの数)やAs, Apr, Aalの比率は,2メートル近い精細管の全長にわたって変わらないし,個体による差もほとんどない(前述の直精細管の領域は例外である).薬剤を投与するなどして幹細胞の数が減った状態から再生するとき,幹細胞の数は増えるが,本来の数にちゃんと戻って安定する16).
どうやら,組織には幹細胞密度を一定に保つ仕組みがあって,幹細胞はそのルールの範囲内で自由に(ストカスティック=確率的に)振る舞っているようだ.幹細胞密度を一定に保つルールを組み込んだ単純な数理モデルが,複雑でバラバラな幹細胞の挙動を高い精度で予測できる事実9, 37, 45)は,この考えを強く支持する.では,オープンニッチで,決まった「指定席」を持たずに動き回っている幹細胞の密度を一定に保つ仕組みとして,どのようなものが考えられるのか?
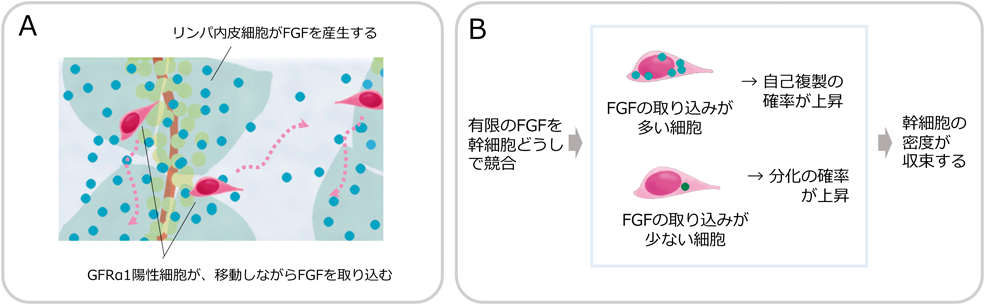
最近我々は,その答えとなりうるメカニズムを提唱した(図8)37, 57).基底コンパートメントを外から包むリンパ内皮細胞が分泌したFGF(FGF4, 5, 8)を,幹細胞が動き回りながら取り込むことによって,自己複製が促進され分化が抑制される.分泌されるFGFの量が限られているため,幹細胞の密度は環境に存在するFGF量でまかなえる値におのずから収束する,というモデルである.幹細胞が増殖因子を競合することからmitogen competitionモデルと呼んでいる.変異体を使ってFGFの量をさまざまに変化させるとそれに比例して幹細胞の密度が変化するという観察結果や,この考え方に基づく数理モデルが障害後の再生過程を定量的に予測できることも,mitogen competitionモデルを支持する.一方,未分化型精原細胞はGDNF, Wntやレチノイン酸による制御も受けている.間質のマクロファージが幹細胞制御に関わっている58)ことや,セルトリ細胞で機能するNotchシグナルを変化させると幹細胞密度が変化する59)ことも知られており,幹細胞密度制御に他の要素が関わっていることは間違いない.
mitogen competitionモデルでどこまで説明できるのか? FGF以外の因子についてはどうなのか? 他のメカニズムとどう関わるのか? 他の組織幹細胞ではどうか?などなど,オープンニッチにおける幹細胞制御についての重要な問題は,今後の検証に委ねられることになる.しかしながら,根本の原理は案外mitogen competitionモデルのような単純なものかもしれない.「天網恢恢疎にして漏らさず」という言葉があるが,全体を大づかみに拘束するルールがあって,その中で個々の細胞が自由に挙動すると,おのずから秩序が生まれる.自己組織化である.その結果,摂動を受けても何食わぬ顔をしてしなやかに対応できる,強靭なシステムが実現するのではないだろうか.
マウス精子幹細胞研究は現在,深く広く急速に発展している.これは,シングルセルトランスクリプトーム解析によるところが大きい.トランスクリプトミクスを中心とした単一細胞オミックス研究は,生物学,特に幹細胞生物学や発生生物学に革命をもたらしている.未分化型精原細胞についても,その不均一性がかつてない精度で明らかにされつつあり,GFRα1陽性細胞が遺伝子発現の異なる状態にある細胞からなる不均一な集団であることが明らかとなってきている20, 60).移植や再生のコンテクストでは,Ngn3陽性状態からGFRα1陽性状態への逆戻りが起こる.では,定常状態のコンテクストでも,GFRα1陽性細胞集団の中で同様の現象が起こっているのか,などは興味深い問題である.さらに,シングルセル解析の結果を細胞形態(AsかAprかAalか?)や組織内の位置(血管や間質との関係)と結びつけることで,オープンニッチと幹細胞動態の関係がより鮮明になることが期待される.単一細胞オミックスを組織内の位置情報や形態情報とひもづけることは,現在多くの研究者が挑んでいる課題で,技術的に解決されるのは時間の問題であろう.単一細胞オミックスは,ヒトなど,遺伝子改変による遺伝学的アプローチができなかった生物種を解析することができる,かつてないツールでもある.生物種の壁を超えた精子幹細胞の理解が進むことも楽しみである.
一方,シングルセル解析は,原理的にスナップショット解析である.統計解析によって,その瞬間の細胞の状態がどちらに向かっているかという「微分係数」の情報を得ることはできる.しかし,自己複製や分化,組織ホメオスタシスなど,数日から数週間,さらには月から年の時間スケールで起こる現象を説明することはできない.本稿で述べてきたようなパルス標識やライブイメージングといった「泥臭い」解析法,あるいは細胞履歴を記録できる「DNAバーコード法」61, 62)などを,単一細胞オミックスと組み合わせることが,組織幹細胞の理解のためにいっそう重要となるだろう.
最後に,本稿では十分述べられなかった精子幹細胞に関する大切な問いを二つほどあげたい.一つ目は,精細管の微小環境の周期的時間変化と,精子幹細胞やそこから生まれた分化細胞の振る舞いが時間的・空間的に制御される仕組みである.歴史的に「精細管周期」や「精子形成の波」として認識されてきたこの現象は,何はともあれ美しい.ここから明らかになることが期待される組織構築の原理は,精巣の精子形成にとどまらず,動物組織の構築やホメオスタシスを考える上で重要な洞察を与えることだろう.二つ目は,次世代に遺伝情報を伝えるという生殖細胞のミッションと,精子幹細胞のストカスティックな挙動の関連である.ゲノムに生じる新規の突然変異の頻度は,ヒトの場合1世代あたり数十塩基であるが,その80~90%がオス(父親)の生殖細胞で生じる63, 64).少し大胆にいうと,オス生殖細胞が大部分の時間を過ごす精子幹細胞の動態は,ゲノムで生じた変化が次世代に伝わるプレフィルターとして機能すると考えられないだろうか.突然変異を持つ幹細胞のクローンが広がれば子孫に伝わる確率は上がるし,そのクローンが早期に消滅したら突然変異が次世代に伝わる確率はうんと小さくなる.実際,幹細胞に生じた突然変異が次世代に伝わって遺伝病を生じる確率が父親の年齢とともに加速度的に上昇すると考えられている疾患群があり,幹細胞動態との関連が注目されている65).
精子幹細胞は,生物学的に重要な役割を果たしている.その研究が今後ますます面白く発展して,理解が深まることを期待している.
生物学が大きな転換期を迎えている今,生物に対して何を問うか,どのように理解するか,という根本を考え直すときが来ていると感じます.今まで誰も見たことがない生殖細胞の姿を,少しでも垣間みられるのを楽しみに,このエキサイティングな時代を楽しんでいきたいと思っています.拙稿を読んでいただき,生殖細胞や精子幹細胞の研究は面白いなと,少しでも思っていただけたらこれに勝る喜びはありません.
謝辞Acknowledgments
本総説の執筆を与えていただき感謝します.本稿で紹介した我々のグループの成果は,現所属の基礎生物学研究所生殖細胞研究部門,および2008年まで所属した京都大学大学院医学研究科腫瘍生物学講座で,多くの共同研究者とともに行った研究から得られたものです.また,これらの研究は文部科学省(MEXT),日本学術振興会(JSPS),科学技術振興機構(JST),日本医療研究開発機構(AMED)などのサポートにより行われました.研究グループに参画いただいた方々,国内外の共同研究者の方々,ファンディングソースの方々はじめ,関わっていただいたすべての方に感謝します.
引用文献References
1) Spradling, A., Fuller, M.T., Braun, R.E., & Yoshida, S. (2011) Germline stem cells. Cold Spring Harb. Perspect. Biol., 3, a002642.
2) Russell, L., Ettlin, R., Sinha Hikim, A., & Clegg, E.(1990) Histological and Histopathological Evaluation of the Testis, 1st ed., Cache River Press, Clearwater, Fl.
3) Yoshida, S. (2018) Open niche regulation of mouse spermatogenic stem cells. Dev. Growth Differ., 60, 542–552.
4) Hilton, B.T. & Turner, T.T. (1993) The seminiferous tubular microenvironment. in Cell and Molecular Biology of the Testis (Desjardins, C. & Ewing, L.L. eds.), pp. 238–265, Oxford University Press, New York.
5) Smith, B.E. & Braun, R.E. (2012) Germ cell migration across Sertoli cell tight junctions. Science, 338, 798–802.
6) Imura-Kishi, K., Uchida, A., Tsunekawa, N., Suzuki, H., Takase, H.M., Hirate, Y., Kanai-Azuma, M., Hiramatsu, R., Kurohmaru, M., & Kanai, Y. (2021) Low retinoic acid levels mediate regionalization of the Sertoli valve in the terminal segment of mouse seminiferous tubules. Sci. Rep., 11, 1110.
7) de Rooij, D.G. & Russell, L.D. (2000) All you wanted to know about spermatogonia but were afraid to ask. J. Androl., 21, 776–798.
8) Yoshida, S. (2019) Heterogeneous, dynamic, and stochastic nature of mammalian spermatogenic stem cells. Curr. Top. Dev. Biol., 135, 245–285.
9) Hara, K., Nakagawa, T., Enomoto, H., Suzuki, M., Yamamoto, M., Simons, B.D., & Yoshida, S. (2014) Mouse spermatogenic stem cells continually interconvert between equipotent singly isolated and syncytial states. Cell Stem Cell, 14, 658–672.
10) Suzuki, H., Sada, A., Yoshida, S., & Saga, Y. (2009) The heterogeneity of spermatogonia is revealed by their topology and expression of marker proteins including the germ cell-specific proteins Nanos2 and Nanos3. Dev. Biol., 336, 222–231.
11) La, H.M. & Hobbs, R.M. (2019) Mechanisms regulating mammalian spermatogenesis and fertility recovery following germ cell depletion. Cell. Mol. Life Sci., 76, 4071–4102.
12) Lord, T. & Oatley, J.M. (2017) A revised Asingle model to explain stem cell dynamics in the mouse male germline. Reproduction, 154, R55–R64.
13) de Rooij, D.G. (2017) The nature and dynamics of spermatogonial stem cells. Development, 144, 3022–3030.
14) Suzuki, S., Diaz, V.D., & Hermann, B.P. (2019) What has single-cell RNA-seq taught us about mammalian spermatogenesis? Biol. Reprod., 101, 617–634.
15) Yoshida, S., Takakura, A., Ohbo, K., Abe, K., Wakabayashi, J., Yamamoto, M., Suda, T., & Nabeshima, Y. (2004) Neurogenin3 delineates the earliest stages of spermatogenesis in the mouse testis. Dev. Biol., 269, 447–458.
16) Nakagawa, T., Nabeshima, Y., & Yoshida, S. (2007) Functional identification of the actual and potential stem cell compartments in mouse spermatogenesis. Dev. Cell, 12, 195–206.
17) Nakagawa, T., Sharma, M., Nabeshima, Y., Braun, R.E., & Yoshida, S. (2010) Functional hierarchy and reversibility within the murine spermatogenic stem cell compartment. Science, 328, 62–67.
18) Ikami, K., Tokue, M., Sugimoto, R., Noda, C., Kobayashi, S., Hara, K., & Yoshida, S. (2015) Hierarchical differentiation competence in response to retinoic acid ensures stem cell maintenance during mouse spermatogenesis. Development, 142, 1582–1592.
19) Gely-Pernot, A., Raverdeau, M., Celebi, C., Dennefeld, C., Feret, B., Klopfenstein, M., Yoshida, S., Ghyselinck, N.B., & Mark, M. (2012) Spermatogonia differentiation requires retinoic acid receptor γ. Endocrinology, 153, 438–449.
20) La, H.M., Makela, J.A., Chan, A.L., Rossello, F.J., Nefzger, C.M., Legrand, J.M.D., De Seram, M., Polo, J.M., & Hobbs, R.M. (2018) Identification of dynamic undifferentiated cell states within the male germline. Nat. Commun., 9, 2819.
21) Carrieri, C., Comazzetto, S., Grover, A., Morgan, M., Buness, A., Nerlov, C., & O’Carroll, D. (2017) A transit-amplifying population underpins the efficient regenerative capacity of the testis. J. Exp. Med., 214, 1631–1641.
22) Chakraborty, P., Buaas, F.W., Sharma, M., Snyder, E., de Rooij, D.G., & Braun, R.E. (2014) LIN28A marks the spermatogonial progenitor population and regulates its cyclic expansion. Stem Cells, 32, 860–873.
23) Sada, A., Suzuki, A., Suzuki, H., & Saga, Y. (2009) The RNA-binding protein NANOS2 is required to maintain murine spermatogonial stem cells. Science, 325, 1394–1398.
24) Chan, F., Oatley, M.J., Kaucher, A.V., Yang, Q.E., Bieberich, C.J., Shashikant, C.S., & Oatley, J.M. (2014) Functional and molecular features of the Id4+ germline stem cell population in mouse testes. Genes Dev., 28, 1351–1362.
25) Yoshida, S., Nabeshima, Y., & Nakagawa, T. (2007) Stem cell heterogeneity: Actual and potential stem cell compartments in mouse spermatogenesis. Ann. N. Y. Acad. Sci., 1120, 47–58.
26) Yoshida, S. (2020). Mouse spermatogenesis reflects the unity and diversity of tissue stem cell niche systems. Cold Spring Harb. Perspect. Biol., 12, e036186.
27) Stine, R.R. & Matunis, E.L. (2013) Stem cell competition: Finding balance in the niche. Trends Cell Biol., 23, 357–364.
28) Morrison, S.J. & Spradling, A.C. (2008) Stem cells and niches: Mechanisms that promote stem cell maintenance throughout life. Cell, 132, 598–611.
29) Inaba, M., Yamashita, Y.M., & Buszczak, M. (2016) Keeping stem cells under control: New insights into the mechanisms that limit niche-stem cell signaling within the reproductive system. Mol. Reprod. Dev., 83, 675–683.
30) Sato, T., Aiyama, Y., Ishii-Inagaki, M., Hara, K., Tsunekawa, N., Harikae, K., Uemura-Kamata, M., Shinomura, M., Zhu, X.B., Maeda, S., et al. (2011) Cyclical and patch-like GDNF distribution along the basal surface of Sertoli cells in mouse and hamster testes. PLoS One, 6, e28367.
31) Sharma, M. & Braun, R.E. (2018) Cyclical expression of GDNF is required for spermatogonial stem cell homeostasis. Development, 145, dev151555.
32) Tokue, M., Ikami, K., Mizuno, S., Takagi, C., Miyagi, A., Takada, R., Noda, C., Kitadate, Y., Hara, K., Mizuguchi, H., et al. (2017) SHISA6 confers resistance to differentiation-promoting Wnt/β-catenin signaling in mouse spermatogenic stem cells. Stem Cell Reports, 8, 561–575.
33) Takase, H.M. & Nusse, R. (2016) Paracrine Wnt/β-catenin signaling mediates proliferation of undifferentiated spermatogonia in the adult mouse testis. Proc. Natl. Acad. Sci. USA, 113, E1489–E1497.
34) Vernet, N., Dennefeld, C., Rochette-Egly, C., Oulad-Abdelghani, M., Chambon, P., Ghyselinck, N.B., & Mark, M. (2006) Retinoic acid metabolism and signaling pathways in the adult and developing mouse testis. Endocrinology, 147, 96–110.
35) Sugimoto, R., Nabeshima, Y., & Yoshida, S. (2012) Retinoic acid metabolism links the periodical differentiation of germ cells with the cycle of Sertoli cells in mouse seminiferous epithelium. Mech. Dev., 128, 610–624.
36) Endo, T., Freinkman, E., de Rooij, D.G., & Page, D.C. (2017) Periodic production of retinoic acid by meiotic and somatic cells coordinates four transitions in mouse spermatogenesis. Proc. Natl. Acad. Sci. USA, 114, E10132–E10141.
37) Kitadate, Y., Jörg, D.J., Tokue, M., Maruyama, A., Ichikawa, R., Tsuchiya, S., Segi-Nishida, E., Nakagawa, T., Uchida, A., Kimura-Yoshida, C., et al. (2019) Competition for mitogens regulates spermatogenic stem cell homeostasis in an open niche. Cell Stem Cell, 24, 79–92.e76.
38) Makela, J.A. & Hobbs, R.M. (2019) Molecular regulation of spermatogonial stem cell renewal and differentiation. Reproduction, 158, R169–R187.
39) Leblond, C.P. & Clermont, Y. (1952) Definition of the stages of the cycle of the seminiferous epithelium in the rat. Ann. N. Y. Acad. Sci., 55, 548–573.
40) Perey, B.Y.C. & Leblond, C.P. (1961). Dev. Dyn., 108, 47–77.
41) Yoshida, S. (2016) From cyst to tubule: Innovations in vertebrate spermatogenesis. Wiley Interdiscip. Rev. Dev. Biol., 5, 119–131.
42) Huckins, C. (1971) The spermatogonial stem cell population in adult rats. I. Their morphology, proliferation and maturation. Anat. Rec., 169, 533–557.
43) Oatley, J.M. & Brinster, R.L. (2008) Regulation of spermatogonial stem cell self-renewal in mammals. Annu. Rev. Cell Dev. Biol., 24, 263–286.
44) Klein, A.M. & Simons, B.D. (2011) Universal patterns of stem cell fate in cycling adult tissues. Development, 138, 3103–3111.
45) Klein, A.M., Nakagawa, T., Ichikawa, R., Yoshida, S., & Simons, B.D. (2010) Mouse germ line stem cells undergo rapid and stochastic turnover. Cell Stem Cell, 7, 214–224.
46) Brinster, R.L. & Zimmermann, J.W. (1994) Spermatogenesis following male germ-cell transplantation. Proc. Natl. Acad. Sci. USA, 91, 11298–11302.
47) Brinster, R.L. & Avarbock, M.R. (1994) Germline transmission of donor haplotype following spermatogonial transplantation. Proc. Natl. Acad. Sci. USA, 91, 11303–11307.
48) Brinster, R.L. (2007) Male germline stem cells: From mice to men. Science, 316, 404–405.
49) Brinster, R.L. (2002) Germline stem cell transplantation and transgenesis. Science, 296, 2174–2176.
50) Nagano, M., Avarbock, M.R., & Brinster, R.L. (1999) Pattern and kinetics of mouse donor spermatogonial stem cell colonization in recipient testes. Biol. Reprod., 60, 1429–1436.
51) Kanatsu-Shinohara, M., Ogonuki, N., Inoue, K., Miki, H., Ogura, A., Toyokuni, S., & Shinohara, T. (2003) Long-term proliferation in culture and germline transmission of mouse male germline stem cells. Biol. Reprod., 69, 612–616.
52) Kubota, H., Avarbock, M.R., & Brinster, R.L. (2004) Growth factors essential for self-renewal and expansion of mouse spermatogonial stem cells. Proc. Natl. Acad. Sci. USA, 101, 16489–16494.
53) Potten, C.S. & Loeffler, M. (1990) Stem cells: Attributes, cycles, spirals, pitfalls and uncertainties. Lessons for and from the crypt. Development, 110, 1001–1020.
54) Brawley, C. & Matunis, E. (2004) Regeneration of male germline stem cells by spermatogonial dedifferentiation in vivo. Science, 304, 1331–1334.
55) Kai, T. & Spradling, A. (2004) Differentiating germ cells can revert into functional stem cells in Drosophila melanogaster ovaries. Nature, 428, 564–569.
56) Nakamura, Y., Jörg, D.J., Kon, Y., Simons, B.D., & Yoshida, S. (2021) Transient suppression of transplanted spermatogonial stem cell differentiation restores fertility in mice. Cell Stem Cell (published on line, April 12, 2021).
57) Jörg, D.J., Kitadate, Y., Yoshida, S., & Simons, B.D. (2021) Stem cell populations as self-renewing many-particle systems. Annu. Rev. Condens. Matter Phys., 12, 135–153.
58) DeFalco, T., Potter, S.J., Williams, A.V., Waller, B., Kan, M.J., & Capel, B. (2015) Macrophages contribute to the spermatogonial niche in the adult testis. Cell Rep., 12, 1107–1119.
59) Garcia, T.X., Farmaha, J.K., Kow, S., & Hofmann, M.C. (2014) RBPJ in mouse Sertoli cells is required for proper regulation of the testis stem cell niche. Development, 141, 4468–4478.
60) Green, C.D., Ma, Q., Manske, G.L., Shami, A.N., Zheng, X., Marini, S., Moritz, L., Sultan, C., Gurczynski, S.J., Moore, B.B., et al. (2018) A comprehensive roadmap of murine spermatogenesis defined by single-cell RNA-seq. Dev. Cell, 46, 651–667.e610.
61) McKenna, A. & Gagnon, J.A. (2019) Recording development with single cell dynamic lineage tracing. Development, 146, dev169730.
62) Masuyama, N., Mori, H., & Yachie, N. (2019) DNA barcodes evolve for high-Resolution cell lineage tracing. Curr. Opin. Chem. Biol., 52, 63–71.
63) Jonsson, H., Sulem, P., Kehr, B., Kristmundsdottir, S., Zink, F., Hjartarson, E., Hardarson, M.T., Hjorleifsson, K.E., Eggertsson, H.P., Gudjonsson, S.A., et al. (2017) Parental influence on human germline de novo mutations in 1,548 trios from Iceland. Nature, 549, 519–522.
64) Roach, J.C., Glusman, G., Smit, A.F., Huff, C.D., Hubley, R., Shannon, P.T., Rowen, L., Pant, K.P., Goodman, N., Bamshad, M., et al. (2010) Analysis of genetic inheritance in a family quartet by whole-genome sequencing. Science, 328, 636–639.
65) Goriely, A. & Wilkie, A.O. (2012) Paternal age effect mutations and selfish spermatogonial selection: Causes and consequences for human disease. Am. J. Hum. Genet., 90, 175–200.
著者紹介Author Profile
 吉田 松生(よしだ しょうせい)
吉田 松生(よしだ しょうせい)自然科学研究機構基礎生物学研究所生殖細胞研究部門教授.博士(医学).
略歴1967年愛知県生まれ,91年東京大学医学部卒業,95年博士(医学),同年国立精神・神経センター研究員,97年大阪大学細胞生体工学センター助手,98年京都大学大学院医学研究科助手(2007年助教),08年より現職.
研究テーマと抱負マウス精子幹細胞の実体・動態・制御を,細胞から組織の階層で理解することを目指して来た.今後は,これらを実現する分子メカニズムと,次世代に遺伝情報を伝える生殖細胞のミッションに迫る研究を展開したい.
ウェブサイトhttp://www.nibb.ac.jp/germcell/
趣味昆虫採集(休業),囲碁(弱い).