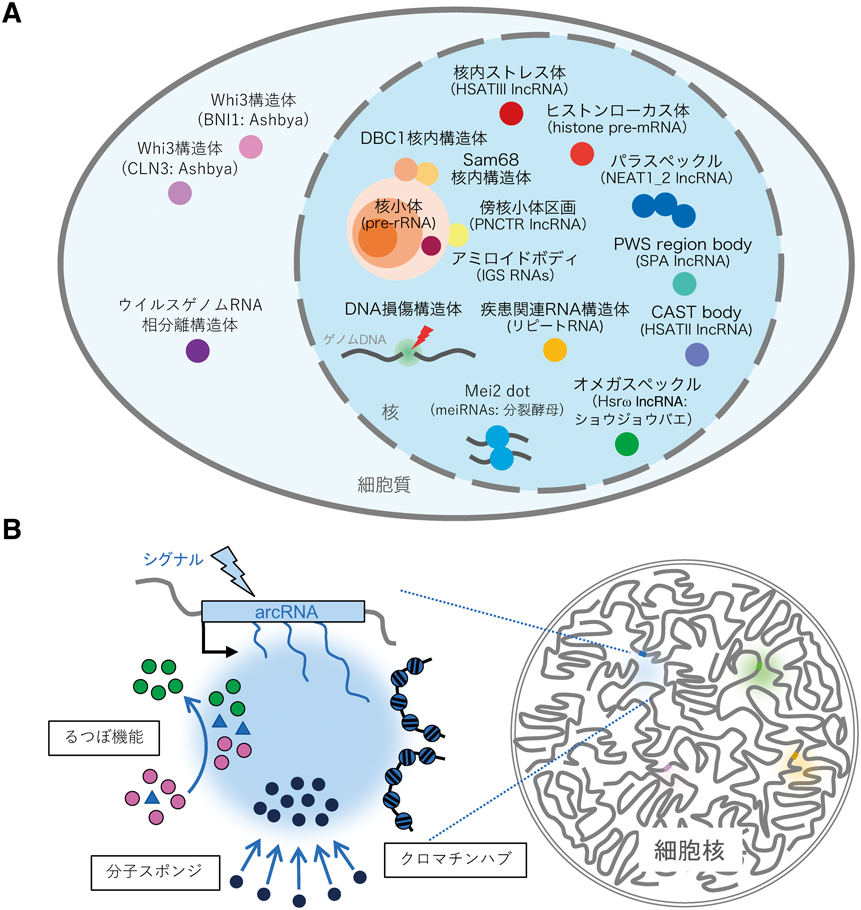
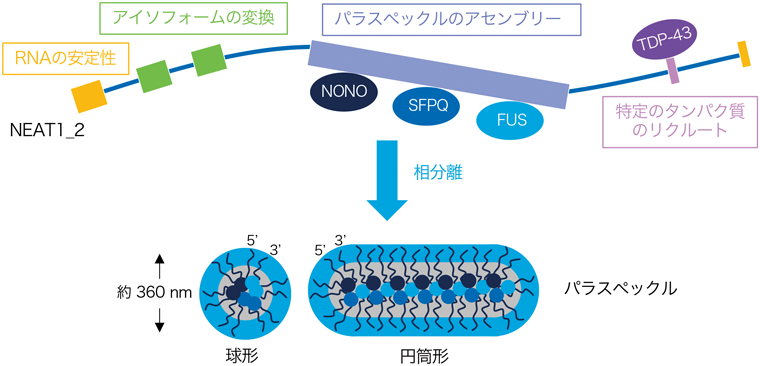
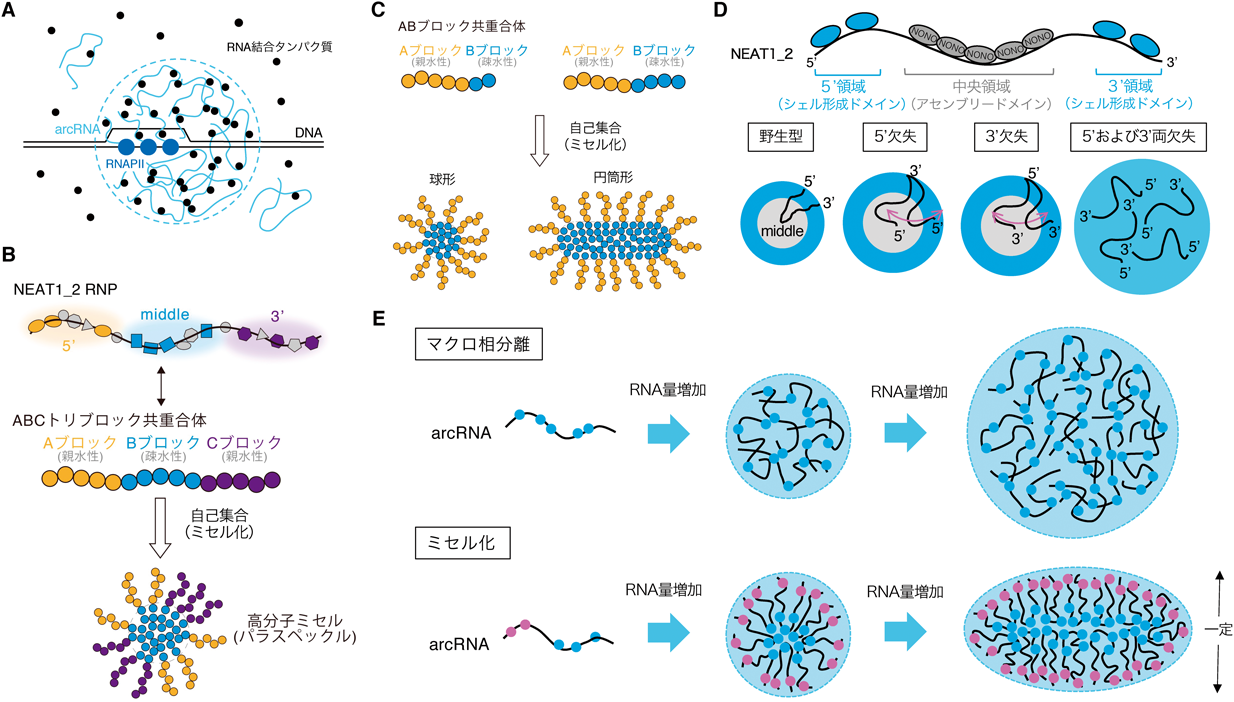
RNAが形作る相分離構造体Phase-separated biomolecular condensates constructed by RNAs
大阪大学大学院生命機能研究科細胞ネットワーク講座RNA生体機能研究室RNA Biofunction, Graduate School of Frontier Biosciences, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘1–3 ◇ 1–3 Yamadaoka, Suita, Osaka 565–0871, Japan