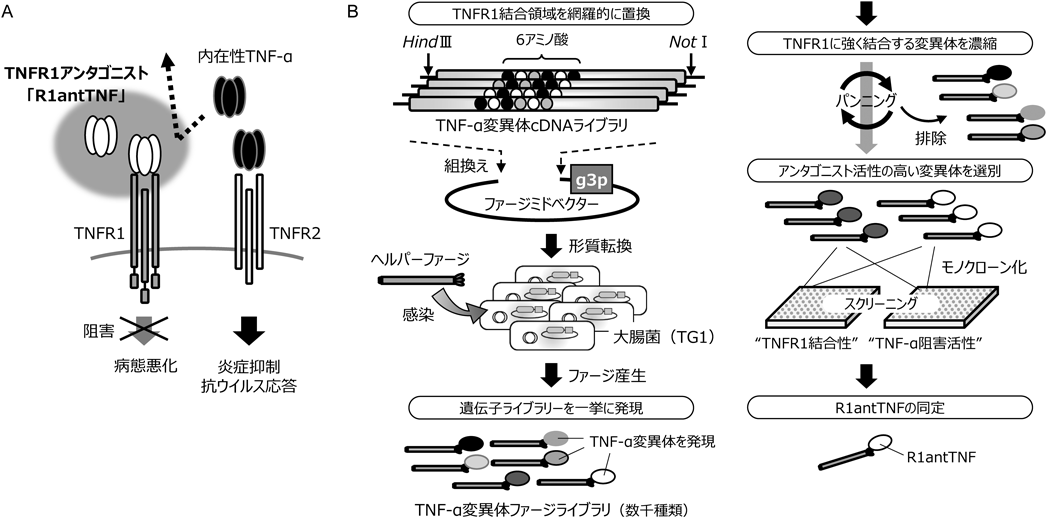
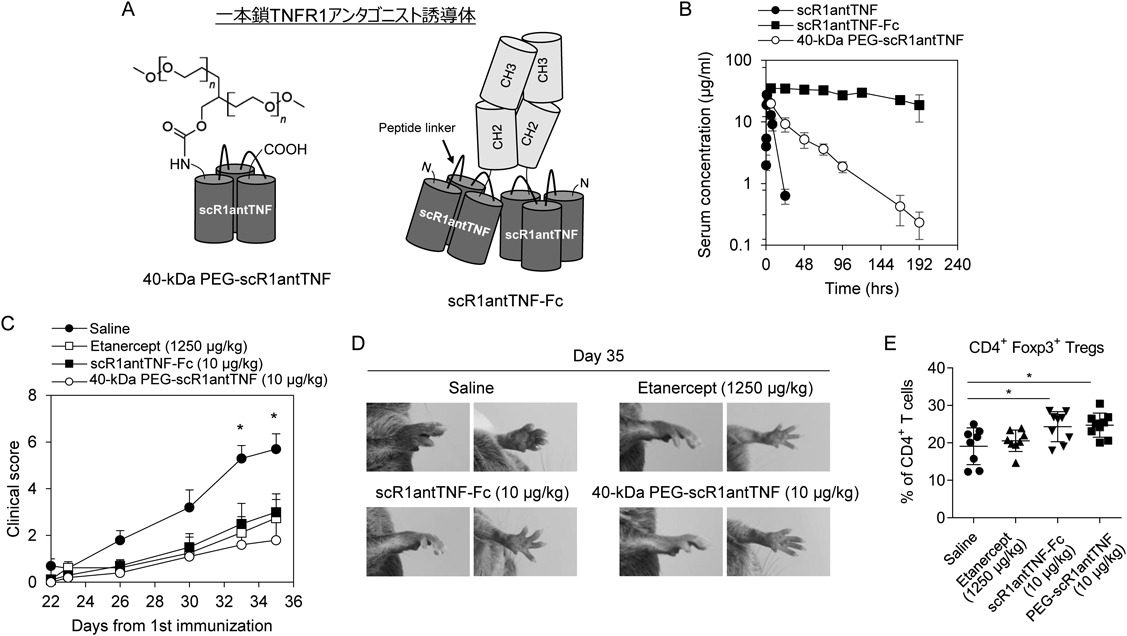
免疫疾患治療薬を目指した1型TNF受容体選択的アンタゴニストの創製と構造最適化Development of TNFR1-selective antagonistic TNF-α mutant as new biologics for treatment of immunological disorders
神戸学院大学薬学部生体機能制御学研究室Laboratory of Cellular and Molecular Physiology, The Faculty of Pharmaceutical Sciences, Kobe Gakuin University ◇ 〒650–8586 兵庫県神戸市中央区港島1–1–3 ◇ 1–1–3 Minatojima, Chuo-ku, Kobe, Hyogo 650–8586, Japan