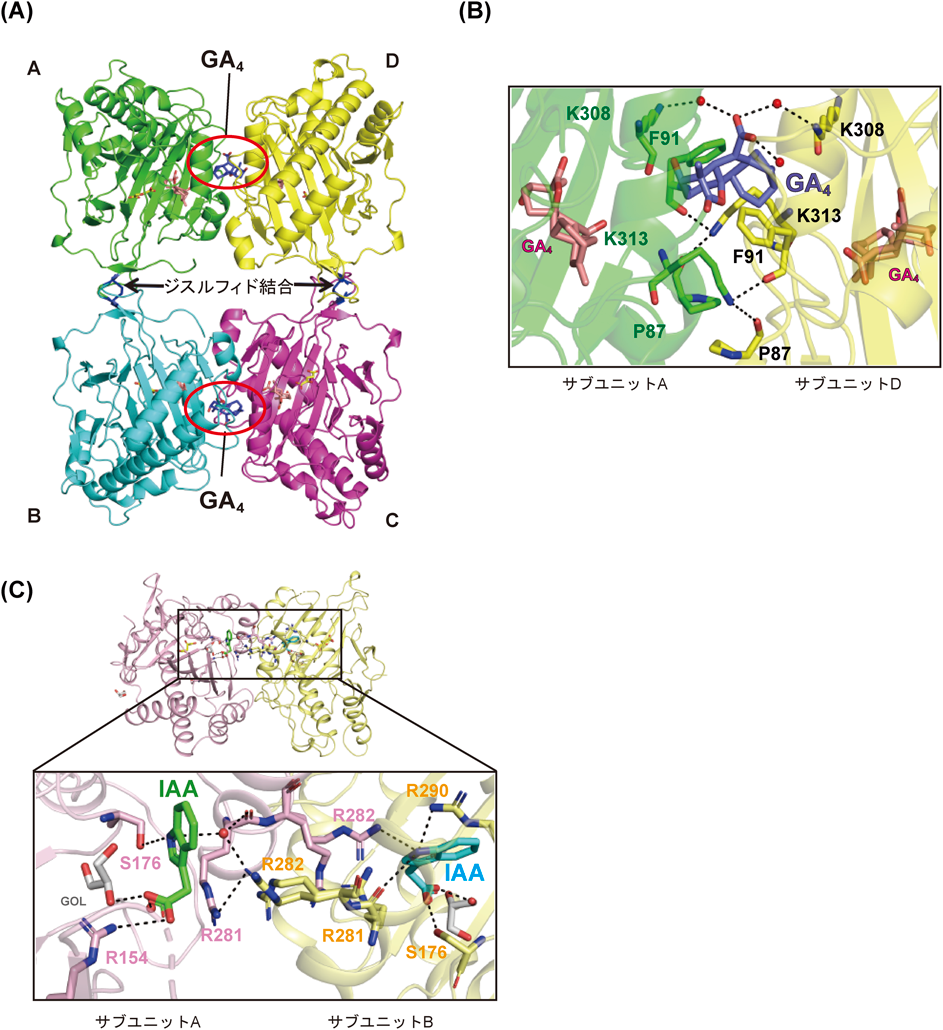
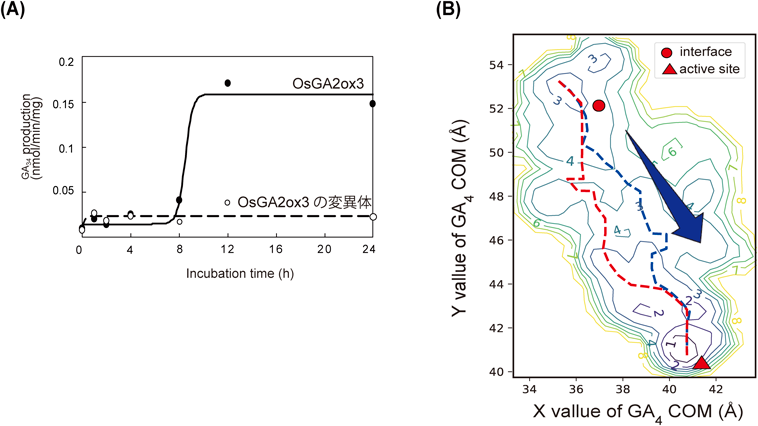
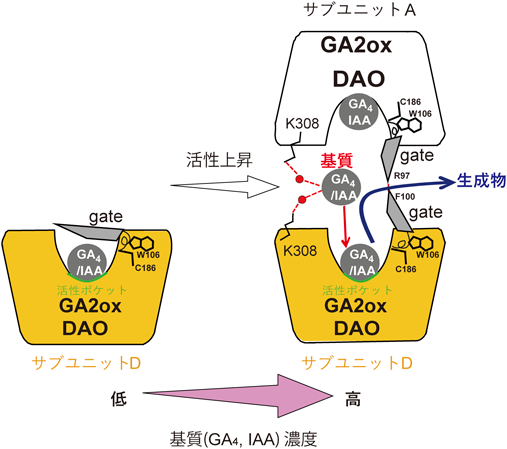
植物ホルモン代謝酵素の活性調節機構~モノーが提唱したアロステリック制御メカニズムの一端を解明~Regulatory mechanism of phytohormone metabolic enzymes ~Elucidation of a part of the allosteric control mechanism proposed by Monod~
名古屋大学生物機能開発利用研究センター生物産業創出研究室Bioscience and biotechnology Center, Nagoya University ◇ 〒464–8601 愛知県名古屋市千種区不老町 ◇ Furo, Chikusa, Nagoya, Aichi 464–8601, Japan