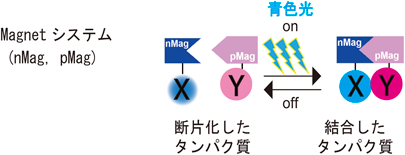
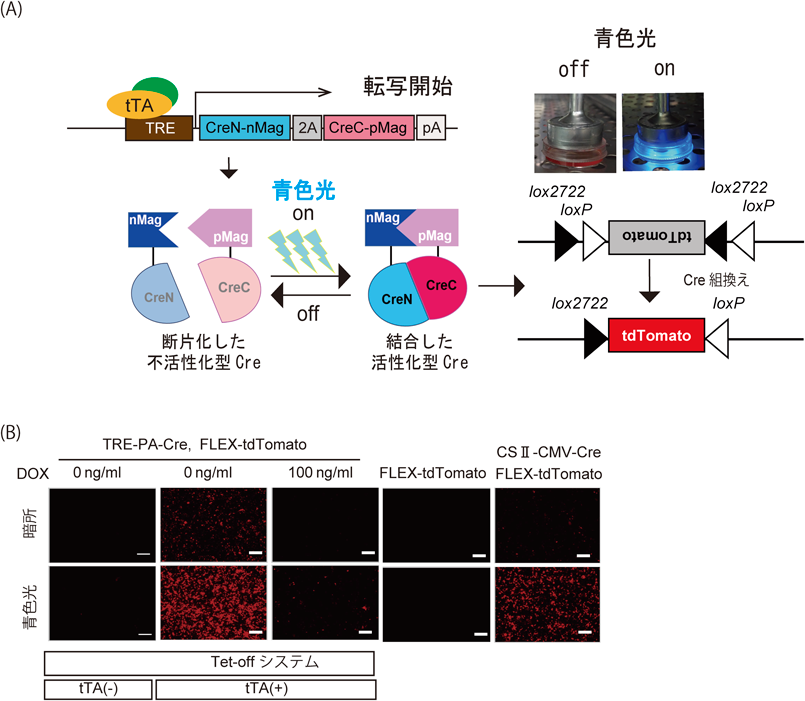
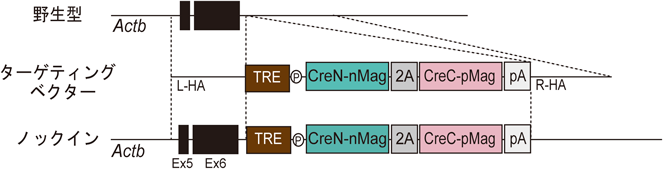
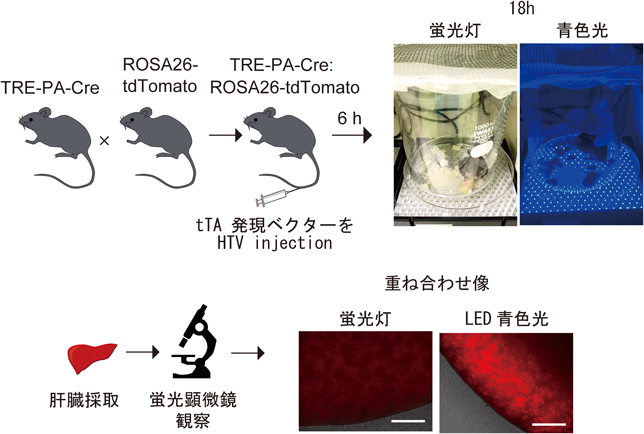
tTA依存性光制御Creマウスの開発Development of tTA-dependent photoactivatable Cre recombinase knock-in mouse
岡山大学学術研究院医歯薬学域(医学系)組織機能修復学分野Department of Regenerative Science, Okayama University Graduate School of Medicine, Dentistry and Pharmaceutical Sciences ◇ 〒700–8558 岡山県岡山市北区鹿田町2–5–1 ◇ 2–5–1 Shikata-cho, Kita-ku, Okayama 700–8558, Japan