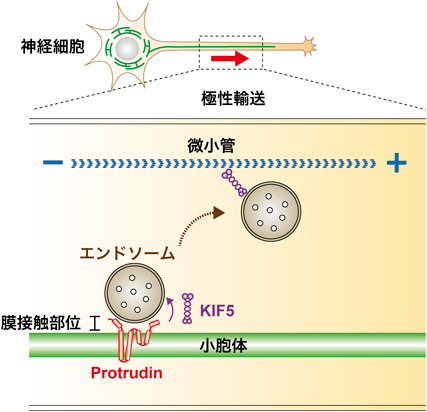
神経細胞は極性を有し,2つの異なる部分,すなわち細胞体樹状突起と軸索からなる.軸索に沿った突起先端へのエンドソーム輸送は,ターゲット細胞方向への軸索伸長や神経伝達物質の輸送に重要な役割を果たしている.Protrudin(プロトルーディン)は小胞体タンパク質で,もともとエンドソームの極性輸送を制御し,神経突起伸長を促進するタンパク質として同定された1).Protrudin結合タンパク質のvesicle-associated membrane protein-associated protein(VAP)やkinesin-related protein 5(KIF5)もエンドソーム輸送に寄与する2, 3).このProtrudin依存的エンドソーム輸送は,小胞体とエンドソームの間の膜接触部位で促進される4).
膜接触部位とは,小胞体と他のオルガネラ膜が近接して並置し繋留されている部位で,そのマイクロドメインで分子情報が交換されるため細胞内シナプスとも呼ばれている.真核細胞のほとんどの細胞内オルガネラは,膜接触部位を介して小胞体とコミュニケーションをとっている.膜接触部位を介したオルガネラ間コミュニケーションの主な機能として,脂質輸送やカルシウムイオン調節やオルガネラ動態制御が知られている.
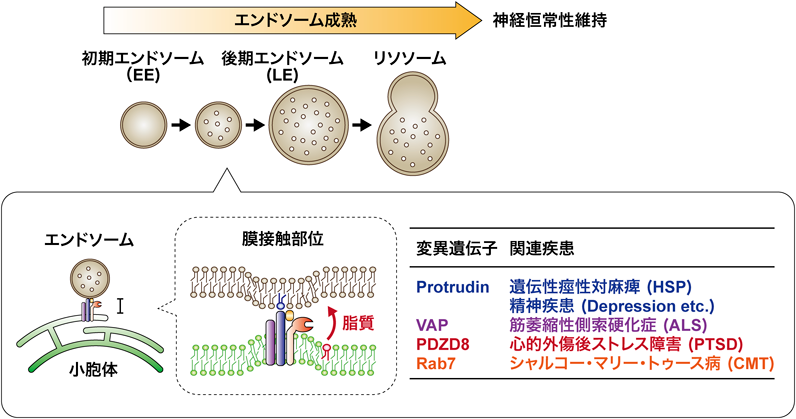
近年,軸索変性症の遺伝性痙性対麻痺(hereditary spastic paraplegia:HSP)の関連タンパク質が,小胞体エンドソーム間の膜接触部位においてエンドソーム成熟に寄与していることが示唆された5).エンドソーム成熟とは,初期エンドソーム(EE)から後期エンドソーム(LE)への変換とその後のリソソームとの融合を含む,連続的な過程を指し,エンドソームの融合と分裂が繰り返されることで進行する.そのエンドソーム成熟の制御機構はよくわかっていなかったが,最近,小胞体エンドソーム間膜接触部位における脂質輸送複合体が,エンドソーム成熟を促進することが明らかになった6).それは,PDZD8などを含むProtrudin複合体が,小胞体とエンドソームの間の繋留に働き,さらに小胞体からエンドソームへの脂質輸送を媒介し,その結果エンドソーム成熟が促進される,という機構である.PDZD8は酵母ERMES複合体サブユニットMmm1(後述)の哺乳類パラログであるが7–10),われわれはPDZD8の脂質輸送活性を世界に先駆けて明らかにした6).
本稿では,Protrudin-PDZD8-VAP-Rab7複合体の機能と機構に焦点を当てる.特に神経細胞において,エンドソームを小胞体に繋留し,そこで脂質輸送を媒介し,エンドソーム成熟を促進する働きについて述べる.またエンドソーム成熟の生理的役割,すなわちProtrudin-PDZD8-VAP-Rab7複合体による脂質輸送活性が,神経極性と神経恒常性の維持に寄与していることを概説する11).
2. Protrudinによるエンドソーム極性輸送と神経突起伸長
Protrudinはもともと機能不明のFK506 binding protein 38(FKBP38)の結合タンパク質として同定された12).FKBP38は小胞体とミトコンドリア間をシャトルする膜タンパク質で,Bcl-2やBcl-xLをミトコンドリアにリクルートし,アポトーシスを抑制する12, 13).FKBP38の欠損マウスは神経管閉鎖不全を呈し出生直後に死亡する14).またFKBP38はSonic hedgehog(Shh)抑制活性を有し,神経発生に必須のタンパク質である15).FKBP38は,カルシウム依存的にpeptidylprolyl isomerase(PPIase)活性が現れるシャペロンタンパク質である16).
Protrudinは,培養細胞に過剰発現させると細胞膜の形態を著しく変化させ長い突起を形成するため,「突起が伸びる(protrude)」の意味から「Protrudin」と名付けられた1).Protrudinは小胞体膜タンパク質で,さまざまな機能ドメイン,すなわちRab11結合ドメイン(Rab11 binding domain:RBD11),2つの膜貫通(trans membrane:TM)ドメイン,ヘアピン(hairpin:HP)ドメイン,低複雑領域(low complexity region:LCR),two phenylalanine in an acidic tract(FFAT)モチーフ,coiled-coil(CC)ドメイン,Fab1, YOTB, Vac1, and EEA1(FYVE)ドメインを有している.これらの構造的な特徴は,Protrudinがエンドソーム輸送や小胞体構造調節などを含む,多彩なオルガネラ動態の制御機能を有していることを裏づけている.
Rab GTPaseは,エンドサイトーシス経路におけるオルガネラのアイデンティティを決定する主要な制御因子で,オルガネラマーカーにもなっている17–19).EEからLEへの変換はRab5結合からRab7結合へのスイッチを伴い,一方でリサイクリングエンドソーム(RE)にはRab11が結合している.GTP結合型のRab11は,極性細胞の頂端部から基底外側部へのREの極性輸送を促進し,この方向は神経細胞では軸索から細胞体樹状突起方向に相当する.一方でGTP結合型のRab7は,神経細胞の軸索先端方向へのLEの極性輸送を促進する.ProtrudinはRBD11でGDP結合型の不活性型Rab11と結合し1),またLCRでGTP結合型の活性型Rab7とも結合する4).よってProtrudinはREの極性輸送を抑制する一方でLEの極性輸送を促進し,エンドソーム輸送のハブとして機能していると示唆される.これらの機構によって,Protrudinは膜成分を含んだエンドソームを軸索先端方向に輸送し,その結果,極性を有する神経突起伸長を促進する.
さらにProtrudinは微小管依存性モータータンパク質のKIF5と相互作用し,微小管に沿ったプラス端方向への積み荷(カーゴ)の順行性輸送を促進する3).近年,小胞体エンドソーム膜接触部位において,ProtrudinがエンドソームにKIF5を付与し,さらにそれが微小管に受け渡されて極性輸送が促進される,という極性輸送の詳細な機構が明らかになった(図1)4).
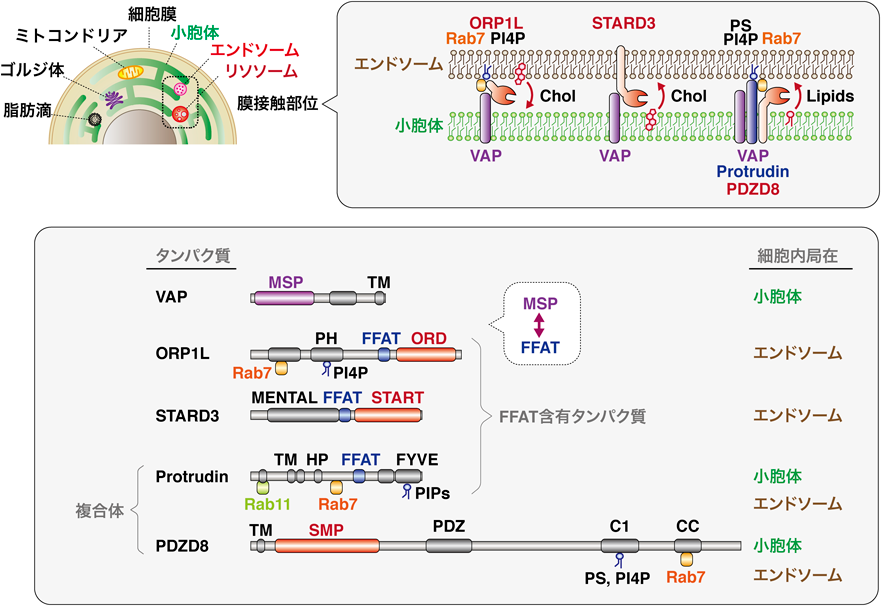
またProtrudin結合タンパク質としてVAPが同定された2).VAPのmajor sperm protein(MSP)ドメインがProtrudinのFFATモチーフと結合する.VAPは膜接触部位において脂質輸送に関与することがよく知られている20–23).ProtrudinのFFATモチーフの変異によって,ProtrudinとVAPの結合およびProtrudinによる突起形成能が低下する.またPC12細胞におけるVAPのノックダウンで,Protrudinの局在が異常になりNGF(nerve growth factor)誘導性の神経突起伸長が抑制される.よってProtrudinによるエンドソーム輸送には,VAPとの結合が必須であることが示された.
またProtrudinのmRNAの前駆体は選択的スプライシングを受け,成熟転写産物としてProtrudin-L(long)とProtrudin-S(short)という2つの異なるアイソフォームが産生される24).Protrudin-Sは哺乳類組織でユビキタスに発現しているが,Protrudin-Lは神経細胞に特異的に高発現している.Protrudin-LはProtrudin-Sに比べて,VAPとの結合を仲介するFFATモチーフの近傍に7アミノ酸の余分な配列を含んでおり,それに伴いProtrudin-LはProtrudin-Sに比べてVAPとより強く結合する.そしてProtrudin-LはProtrudin-Sに比べて,神経突起伸長活性が高い.この神経特異的アイソフォームであるProtrudin-Lの産生には,精神疾患に関連があるスプライシング制御因子のSRRM4が関与している25).
3. 小胞体エンドソーム膜接触部位におけるエンドソーム成熟
エンドソームは基本的な細胞活動において重要な役割を担っている.エンドサイトーシスの際に形質膜が陥入して形成されるEEは,LEへと変換される.LEは複数のintraluminal vesicles(ILVs)を含んでいるが,これはLE膜の内腔側への陥入に由来するもので,ゆえにLEはmultivesicular bodies(MVBs)とも呼ばれている26).エンドソーム成熟とは,EEがLEに変換されてリソソームと融合する一連の過程を指し,最終的にリソソームはエンドサイトーシスされた物質を分解し,新たな物質の材料とする再利用に向かわせる.エンドソーム成熟は連続的に進行する過程で,この一連の流れにある小胞を総称してエンドリソソーム(endolysosomes:LyLEs)と呼ぶ27).このエンドサイトーシス機構の分解系経路に加えて,EEのまた別の一群はリサイクリング経路に送られる.このリサイクリング経路では,EEはREに変換され,含有する物質を形質膜へと戻す.一方LEのまた別の一群はエキソサイトーシス経路へと送られ,含有するILVをextracellular vesicle(EV)として細胞外に放出する.このEVはエクソソーム(exosome)とも呼ばれていて,細胞間コミュニケーションにおいて重要な役割を果たしている28).
エンドソーム成熟における膜動態は,エンドソームの分裂と融合に起因する5, 29, 30).LEの輸送と同様に,LEの分裂と融合も,小胞体エンドソーム膜接触部位における脂質輸送に依存する31, 32).しかし膜接触部位で小胞体とエンドソームを繋留する因子や,小胞体からエンドソームへの脂質輸送の機構については,最近まであまりわかっていなかった26, 33–36).
4. 小胞体エンドソーム膜接触部位と軸索変性症との関連
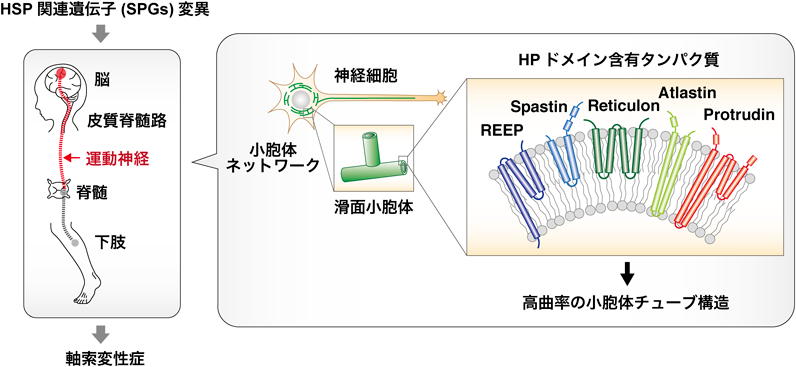
軸索変性症は神経変性疾患の一種で,神経細胞の軸索の損傷によって引き起こされる.哺乳類の神経系において最も長い軸索は,随意運動を担う神経回路である皮質脊髄路に存在する.HSPは,皮質脊髄路の運動神経が変性する軸索変性症である37).Protrudin遺伝子(ZFYVE27)の変異は,HSPの原因の1つとして知られている38–43).HSP関連タンパク質として,Protrudin以外にもspastin, REEPs, reticulons, atlastinsなどを含む多くが同定されている38, 40, 44, 45).異なる種類のHSP患者の変異遺伝子は,spastic paraplegia genes(SPGs)に通し番号がついた名前で呼ばれていて,ProtrudinにもSPG33という別名がついている.HSPの主な臨床的特徴は進行性の下肢の痙攣と麻痺で,これは皮質脊髄路の運動神経の長い軸索が変性することに起因する.Protrudinはspastin(SPG4)と結合することが知られていた38).一方,プリオンプロモーターを利用した神経特異的Protrudinトランスジェニックマウスの脳のプロテオミクス解析で,Protrudin結合タンパク質として複数のHSP関連タンパク質が同定された.その中には,myelin proteolipid protein 1(SPG2),atlastin 1(SPG3A),REEP1(SPG31),REEP5, KIF5A(SPG10),KIF5B, KIF5C, reticulons 1, 3, 4(reticulon 2であるSPG12と類似)が含まれていた40).これらのさまざまなHSP関連タンパク質の多くは,HPドメインを有している.HPドメインは疎水性のくさび形構造をしており,小胞体膜の細胞質側に挿入されることにより脂質二重膜を湾曲させ,曲率の高いチューブ構造の形成に寄与する46–49).よってHSP関連の軸索変性症では,小胞体膜の構造異常により滑面小胞体のネットワークに不全を来し,それにより小胞体ストレス感受性が亢進する(図2)40).したがってProtrudin遺伝子の変異によって起こるHSPは,小胞体膜に変異タンパク質が蓄積して小胞体ストレスが誘導されるという,ドミナントネガティブ効果に起因すると考えられる.
またHSP関連遺伝子であるspastinとREEP1に変異を持つ神経細胞で,LEの異常な肥大化とリソソームの機能不全が見いだされ,それは小胞体エンドソーム膜接触部位の不全の結果であると報告された5, 50).詳細は後述するが,Protrudinの欠損やPDZD8の欠損でも異常な形態のLEが現れ,また神経極性の不全と軸索変性が認められた6).これらの知見により,一連のHSP関連タンパク質が,小胞体エンドソーム膜接触部位におけるエンドソーム成熟の制御に関わっていることが示唆された.
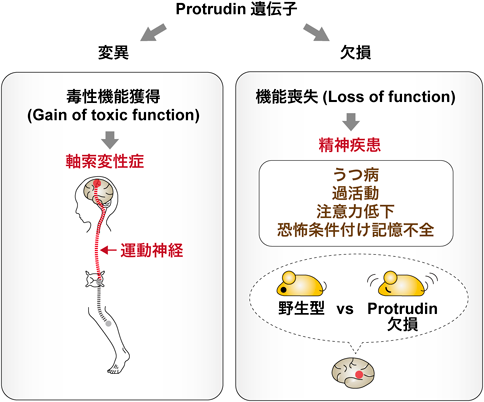
一方最近の研究で,Protrudin欠損マウスの包括的行動バッテリー解析により,Protrudinの神経系の生理的な役割が明らかになった51).Protrudin欠損マウスはHSP様の兆候は示さず,代わりにうつ病様の行動や,過活動や,注意力低下や,恐怖条件づけ記憶の不全が認められた.したがって,Protrudin遺伝子の変異では毒性機能獲得(gain of toxic function)により軸索変性症を発症するが,一方でProtrudin遺伝子のホモ欠損では機能喪失(loss of function)により精神疾患様の表現型を呈する.これらの知見より,Protrudinは正常な神経の発生や行動に必須の役割を果たしていることが示唆された(図3).
5. 小胞体エンドソーム膜接触部位におけるProtrudin-PDZD8-VAP複合体
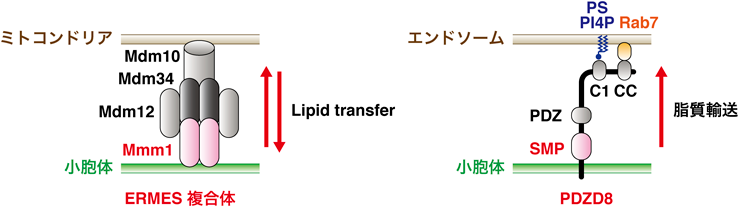
小胞体エンドソーム膜接触部位でProtrudinと協調的に働くタンパク質を同定するために,野生型とProtrudin欠損マウスの脳抽出物の膜分画を用いてディファレンシャルプロテオミクス解析が行われた.その結果,Protrudinの重要な結合分子であるVAP-AやVAP-Bに加えて,新たにPDZD8が同定された6).またその複合体にはRab7も含まれていた.同様の結果が他のグループからも報告され,PDZD8の結合タンパク質としてProtrudinが同定された52).PDZD8は酵母Mmm1の哺乳類パラログで,ER mitochondrial encounter structure(ERMES)複合体のサブユニットの1つである.ERMES複合体は小胞体とミトコンドリアの相互作用を仲介し,synaptotagmin-like mitochondrial lipid–binding protein(SMP)ドメイン依存的な脂質輸送によりリン脂質の生合成に働く(図4)7–9).PDZD8の機能として,神経細胞における小胞体ミトコンドリア間繋留とカルシウム動態制御に働いていることが知られていたが10),脂質輸送活性の有無については最近われわれが明らかにするまで不明であった6).ProtrudinとPDZD8の関係性の1つとして,小胞体膜上で複合体を形成しており,どちらか一方が欠損するともう一方のタンパク質が分解し,相互にタンパク質安定性に働く.
超解像顕微鏡を用いた蛍光免疫染色イメージング解析により,Protrudin同様にPDZD8も小胞体エンドソーム膜接触部位に局在することが明らかになった.また小胞体エンドソーム膜接触部位の数はProtrudinまたはPDZD8の発現抑制により顕著に減少し,さらにProtrudinとPDZD8両方の発現抑制では膜接触部位の減少の相乗効果が認められた.
PDZD8はCCドメインを介して,LEに局在するGTP結合型Rab7とも相互作用する4, 6, 53, 54).また他のグループは,Protrudin-PDZD8複合体が小胞体とエンドソームとミトコンドリアの3つのオルガネラの相互作用に働いていると示唆している52).しかしその生理的な意義についてはさらなる研究が必要である.
膜接触部位は,主に脂質輸送やカルシウム動態やオルガネラ動態の制御に働いている.PDZD8はSMPドメインを持っていて,このドメインは脂質輸送活性を有するtubular lipid-binding protein(TULIP)スーパーファミリーに属する.さらにPDZD8の酵母パラログMmm1は,ERMES複合体において脂質輸送を仲介する7–9, 55, 56).しかしPDZD8が脂質輸送活性を有するかは不明であった.そこでわれわれは,fluorescence resonance energy transfer(FRET)を利用したリポソームアッセイを用いて,PDZD8の脂質輸送活性を調べた.このリポソームFRETアッセイでは,ドナーリポソームにrhodamineラベル脂質とNBD(7-nitrobenz-2-oxa-1,3-diazole-4-yl)ラベル脂質を混ぜておくが,この状態ではFRETによりNBDの蛍光は消光している.そこに脂質輸送タンパク質を添加するとドナーリポソームから脂質が抽出され分散するため,FRETが解消してNBDの蛍光が検出される.この実験系により,PDZD8によってphosphatidic acid(PA),phosphatidylserine(PS),phosphatidylethanolamine(PE),phosphatidylcholine(PC)を含むリン脂質やセラミドやコレステロールがドナー膜から抽出されることが明らかになった6).
PDZD8による脂質輸送の作用機序について,PDZD8のC1ドメインはPSとPI(4)Pに優先的に結合する.PDZD8の作用機序はextended synaptotagmin(E-Syt)と類似していると予想されるため,PDZD8はC1ドメインとPSやPI(4)Pとの結合を介して,小胞体とエンドソームの繋留を促進すると推測される.またPDZD8のCCドメインはGTP結合型Rab7とも結合し,小胞体とLEの繋留促進に働く4, 54).培養神経細胞でPDZD8を発現抑制すると,PSの細胞内分布が変化するが,PDZD8による脂質輸送の生理的な役割については,今後さらなる解析が必要である.
7. 小胞体エンドソーム膜接触部位における脂質輸送
膜接触部位における脂質輸送機構は活発に研究されており,複数の膜間繋留因子や脂質輸送タンパク質が同定されている.小胞体エンドソーム膜接触部位についてもいくつかの関連因子が同定されている(図5).VAPは小胞体タンパク質で,小胞体と他のオルガネラとの繋留に寄与し,脂質輸送のカギとなる働きをしている.VAPはMSPドメインを介してFFATモチーフを持つ複数のタンパク質と相互作用する2, 57–59).VAP-BのMSPドメインの変異は筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS)の優性形質の原因であり,別名ALS8とも呼ばれている60).膜接触部位に局在しFFATモチーフを有するタンパク質としては,oxysterol binding protein(OSBP)-related proteins(ORPs),steroidogenic acute regulatory protein(StAR)-related lipid transfer(START)domain-containing proteins, phosphatidylinositol transporter protein(PITP)domain-containing proteins, Sec14-like proteinsなどが知られている.そして小胞体エンドソーム膜接触部位に関しては,OSBPやORPがステロールやイノシトールリン脂質などを輸送することが知られている.OSBPはVAPやPI(4)Pと協調して,エンドソームの分裂制御に働く35).ORP1LはVAPやRab7と協調的に,エンドソームから小胞体にコレステロールを輸送する61, 62).またORP5はNPC1と協調的に,LyLEからのコレステロール輸送に働く63).STARTドメインを含むSTARD3は,LE膜に分布し,VAPと協調して小胞体からエンドソームへのコレステロール輸送に働く64, 65).またVPS13Cは若年性パーキンソン病に関連しており,VAPやRab7と協調的に小胞体とエンドソームを繋留し,脂質輸送に働く66–68).
最近,PDZD8がSMPドメインを有し脂質輸送に働き,FFAT含有タンパク質のProtrudinやVAPやLEタンパク質のRab7と複合体を形成していることが明らかになった.そしてProtrudin-PDZD8-VAP複合体はLyLEを小胞体に繋留し,小胞体からLyLEへの脂質輸送を促進する(図5).ProtrudinのFYVEドメインは非典型的で,PI(3)Pとの結合に必須のアミノ酸配列が保存されておらず,PI(4,5)P2やPI(3,4)P2やPI(3,4,5)P3と結合する69).さらにRab7はProtrudinとPDZD8の両方と相互作用する.Protrudin, VAP, PDZD8, Rab7はいずれも神経系疾患に関与している.Protrudinの遺伝子変異は軸索変性症HSPに関係し38, 40),Protrudin欠損マウスは精神疾患様の表現型を呈する51).VAPはALSの原因になる60).またPDZD8遺伝子はposttraumatic stress disorder(PTSD)のリスク因子として知られている70).そしてRab7の遺伝子変異は軸索変性症のCharcot-Marie-Tooth disease(CMT)の原因となる71, 72).よってProtrudin-PDZD8-VAP-Rab7複合体は,神経系の働きに重要な役割を果たしていることが示唆される(図6).
8. エンドソーム成熟と神経極性および神経恒常性維持との関連
ProtrudinとPDZD8の発現レベルは他の組織に比べて脳で高いため,Protrudin-PDZD8複合体は神経系に選択的な機能を有することが示唆される.ProtrudinやPDZD8をマウス初代神経細胞で発現抑制すると異常に肥大化したLE,すなわち異常巨大空胞(abnormal large vacuoles:ALVs)が出現する6).PDZD8の発現抑制で現れるこの表現型は,野生型PDZD8のcDNAを導入すると回復するが,脂質輸送能がないSMPドメイン欠損変異体PDZD8(ΔSMP)のcDNAを導入しても回復しない.さらに,内在性PDZD8存在下でPDZD8(ΔSMP)を過剰発現してもALVが出現するため,PDZD8(ΔSMP)は正常なエンドソーム分裂に対してドミナントネガティブ効果を及ぼすと考えられる.このALVは異常なラメラ構造を含んでおり,この表現型はspastinやREEP1の変異マウス由来神経細胞で認められる構造ときわめて類似している5).ちなみにこのspastinやREEP1のHSP関連変異を有する神経細胞では,リソソームにも異常が生じる.
PDZD8を発現抑制した神経細胞では,軸索長が短くなり,細胞体樹状突起の面積が増大することから,細胞極性の不全が示唆され,これはProtrudin欠損マウス由来神経細胞で認められる表現型と類似している24).よってProtrudin-PDZD8複合体は,神経細胞の極性確立に必須であると示唆される.さらに神経細胞でProtrudinやPDZD8を発現抑制すると,軸索が細くなり,また微小管からTau1が解離し,軸索変性の特徴73)と一致した.これらの結果より,Protrudin-PDZD8系は,神経細胞を軸索変性から保護し,神経恒常性維持に必須の働きをしていることが明らかになった(図6)6).
本稿では,神経細胞のエンドソーム成熟における,小胞体エンドソーム膜接触部位の機能と機構について概説した.そこで中心的な役割を果たしているProtrudinは,特に神経細胞におけるエンドソーム動態や小胞体構造の制御に関与している.そしてProtrudinは小胞体エンドソーム膜接触部位でPDZD8やVAPやRab7と複合体を形成し,小胞体エンドソーム間で脂質を輸送し,その結果エンドソーム成熟を促進し,神経恒常性維持に働く.しかしこのProtrudin-PDZD8-VAP-Rab7複合体による脂質輸送の機構には不明点も多く残されており,さらなる研究が必要である.
謝辞Acknowledgments
ポスドクのときに始めたFKBP38の研究から偶然Protrudinを発見し,Science誌に報告して以来15年以上経つ.その間,心躍る発見もあったが,思うように研究が進まず苦しむことも多かった.しかし今やProtrudin複合体は小胞体エンドソーム膜接触部位における重要な分子と認知されるようになり,世界に通用する研究に発展している.これまでご指導いただいた九大の中山敬一先生をはじめ,プロジェクトに参加して下さった多くの院生や学生や共同研究者のみなさまに,心より感謝申し上げたい.
Abbreviations
- ALS
- amyotrophic lateral sclerosis(筋萎縮性側索硬化症)
- ALV
- abnormal large vacuole(異常巨大空胞)
- CC
- coiled-coil
- CMT
- Charcot-Marie-Tooth disease(シャルコー・マリー・トゥース病)
- EE
- early endosome(初期エンドソーム)
- ERMES
- ER mitochondrial encounter structure
- E-Syt
- extended synaptotagmin
- EV
- extracellular vesicle(細胞外小胞)
- FFAT
- two phenylalanine in an acidic tract
- FRET
- fluorescence resonance energy transfer(蛍光共鳴エネルギー移動)
- FYVE
- Fab1, YOTB, Vac1, and EEA1
- HP
- hairpin(ヘアピン)
- HSP
- hereditary spastic paraplegia(遺伝性痙性対麻痺)
- ILV
- intraluminal vesicle(腔内膜小胞)
- KIF5
- kinesin-related protein 5
- LCR
- low complexity region(低複雑領域)
- LE
- late endosome(後期エンドソーム)
- LyLE
- endolysosome(エンドリソソーム)
- MSP
- major sperm protein
- MVB
- multivesicular body(多胞体)
- ORP
- OSBP–related protein
- OSBP
- oxysterol binding protein
- PA
- phosphatidic acid(ホスファチジンサン)
- PC
- phosphatidylcholine(ホスファチジルコリン)
- PE
- phosphatidylethanolamine(ホスファチジルエタノールアミン)
- PIP
- phosphoinositide(イノシトールリン脂質)
- PITP
- phosphatidylinositol transporter protein
- PPIase
- peptidylprolyl isomerase
- PS
- phosphatidylserine(ホスファチジルセリン)
- PTSD
- posttraumatic stress disorder(心的外傷後ストレス障害)
- RBD11
- Rab11 binding domain
- RE
- recycling endosome(リサイクリングエンドソーム)
- Shh
- Sonic hedgehog
- SMP
- synaptotagmin-like mitochondrial lipid–binding protein
- SPG
- spastic paraplegia gene(遺伝性痙性対麻痺関連遺伝子)
- StAR
- steroidogenic acute regulatory protein
- START
- StAR–related lipid transfer
- TM
- trans membrane(膜貫通)
- TULIP
- tubular lipid-binding protein
- VAP
- vesicle-associated membrane protein-associated protein
引用文献References
1) Shirane, M. & Nakayama, K.I. (2006) Protrudin induces neurite formation by directional membrane trafficking. Science, 314, 818–821.
2) Saita, S., Shirane, M., Natume, T., Iemura, S., & Nakayama, K.I. (2009) Promotion of neurite extension by protrudin requires its interaction with vesicle-associated membrane protein-associated protein. J. Biol. Chem., 284, 13766–13777.
3) Matsuzaki, F., Shirane, M., Matsumoto, M., & Nakayama, K.I. (2011) Protrudin serves as an adaptor molecule that connects KIF5 and its cargoes in vesicular transport during process formation. Mol. Biol. Cell, 22, 4602–4620.
4) Raiborg, C., Wenzel, E.M., Pedersen, N.M., Olsvik, H., Schink, K.O., Schultz, S.W., Vietri, M., Nisi, V., Bucci, C., Brech, A., et al. (2015) Repeated ER-endosome contacts promote endosome translocation and neurite outgrowth. Nature, 520, 234–238.
5) Allison, R., Edgar, J.R., Pearson, G., Rizo, T., Newton, T., Gunther, S., Berner, F., Hague, J., Connell, J.W., Winkler, J., et al. (2017) Defects in ER-endosome contacts impact lysosome function in hereditary spastic paraplegia. J. Cell Biol., 216, 1337–1355.
6) Shirane, M., Wada, M., Morita, K., Hayashi, N., Kunimatsu, R., Matsumoto, Y., Matsuzaki, F., Nakatsumi, H., Ohta, K., Tamura, Y., et al. (2020) Protrudin and PDZD8 contribute to neuronal integrity by promoting lipid extraction required for endosome maturation. Nat. Commun., 11, 4576.
7) Kornmann, B., Currie, E., Collins, S.R., Schuldiner, M., Nunnari, J., Weissman, J.S., & Walter, P. (2009) An ER-mitochondria tethering complex revealed by a synthetic biology screen. Science, 325, 477–481.
8) Kopec, K.O., Alva, V., & Lupas, A.N. (2010) Homology of SMP domains to the TULIP superfamily of lipid-binding proteins provides a structural basis for lipid exchange between ER and mitochondria. Bioinformatics, 26, 1927–1931.
9) AhYoung, A.P., Jiang, J., Zhang, J., Khoi Dang, X., Loo, J.A., Zhou, Z.H., & Egea, P.F. (2015) Conserved SMP domains of the ERMES complex bind phospholipids and mediate tether assembly. Proc. Natl. Acad. Sci. USA, 112, E3179–E3188.
10) Hirabayashi, Y., Kwon, S.K., Paek, H., Pernice, W.M., Paul, M.A., Lee, J., Erfani, P., Raczkowski, A., Petrey, D.S., Pon, L.A., et al. (2017) ER-mitochondria tethering by PDZD8 regulates Ca2+ dynamics in mammalian neurons. Science, 358, 623–630.
11) Shirane, M. (2020) Lipid transfer-dependent endosome maturation mediated by protrudin and PDZD8 in neurons. Front. Cell Dev. Biol., 8, 615600.
12) Shirane, M. & Nakayama, K.I. (2003) Inherent calcineurin inhibitor FKBP38 targets Bcl-2 to mitochondria and inhibits apoptosis. Nat. Cell Biol., 5, 28–37.
13) Saita, S., Shirane, M., & Nakayama, K.I. (2013) Selective escape of proteins from the mitochondria during mitophagy. Nat. Commun., 4, 1410.
14) Shirane, M., Ogawa, M., Motoyama, J., & Nakayama, K.I. (2008) Regulation of apoptosis and neurite extension by FKBP38 is required for neural tube formation in the mouse. Genes Cells, 13, 635–651.
15) Saita, S., Shirane, M., Ishitani, T., Shimizu, N., & Nakayama, K.I. (2014) Role of the ANKMY2-FKBP38 axis in regulation of the Sonic hedgehog (Shh) signaling pathway. J. Biol. Chem., 289, 25639–25654.
16) Edlich, F., Weiwad, M., Erdmann, F., Fanghanel, J., Jarczowski, F., Rahfeld, J.U., & Fischer, G. (2005) Bcl-2 regulator FKBP38 is activated by Ca2+/calmodulin. EMBO J., 24, 2688–2699.
17) Zerial, M. & McBride, H. (2001) Rab proteins as membrane organizers. Nat. Rev. Mol. Cell Biol., 2, 107–117.
18) Stenmark, H. (2009) Rab GTPases as coordinators of vesicle traffic. Nat. Rev. Mol. Cell Biol., 10, 513–525.
19) Wandinger-Ness, A. & Zerial, M. (2014) Rab proteins and the compartmentalization of the endosomal system. Cold Spring Harb. Perspect. Biol., 6, a022616.
20) Helle, S.C., Kanfer, G., Kolar, K., Lang, A., Michel, A.H., & Kornmann, B. (2013) Organization and function of membrane contact sites. Biochim. Biophys. Acta, 1833, 2526–2541.
21) Phillips, M.J. & Voeltz, G.K. (2016) Structure and function of ER membrane contact sites with other organelles. Nat. Rev. Mol. Cell Biol., 17, 69–82.
22) Salvador-Gallego, R., Hoyer, M.J., & Voeltz, G.K. (2017) Snapshot: Functions of endoplasmic reticulum membrane contact sites. Cell, 171, 1224–1224.
23) Wu, H., Carvalho, P., & Voeltz, G.K. (2018) Observation of alkaline earth complexes M(CO)8 (M=Ca, Sr, or Ba) that mimic transition metals. Science, 361, 912–916.
24) Ohnishi, T., Shirane, M., Hashimoto, Y., Saita, S., & Nakayama, K.I. (2014) Identification and characterization of a neuron-specific isoform of protrudin. Genes Cells, 19, 97–111.
25) Ohnishi, T., Shirane, M., & Nakayama, K.I. (2017) SRRM4-dependent neuron-specific alternative splicing of protrudin transcripts regulates neurite outgrowth. Sci. Rep., 7, 41130.
26) Huotari, J. & Helenius, A. (2011) Endosome maturation. EMBO J., 30, 3481–3500.
27) Hong, Z., Pedersen, N.M., Wang, L., Torgersen, M.L., Stenmark, H., & Raiborg, C. (2017) PtdIns3P controls mTORC1 signaling through lysosomal positioning. J. Cell Biol., 216, 4217–4233.
28) Colombo, M., Raposo, G., & Thery, C. (2014) Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annu. Rev. Cell Dev. Biol., 30, 255–289.
29) Rowland, A.A., Chitwood, P.J., Phillips, M.J., & Voeltz, G.K. (2014) ER contact sites define the position and timing of endosome fission. Cell, 159, 1027–1041.
30) Hoyer, M.J., Chitwood, P.J., Ebmeier, C.C., Striepen, J.F., Qi, R.Z., Old, W.M., & Voeltz, G.K. (2018) A novel class of ER membrane proteins regulates ER-associated endosome fission. Cell, 175, 254–265.e14.
31) Johansson, M., Lehto, M., Tanhuanpaa, K., Cover, T.L., & Olkkonen, V.M. (2005) The oxysterol-binding protein homologue ORP1L interacts with Rab7 and alters functional properties of late endocytic compartments. Mol. Biol. Cell, 16, 5480–5492.
32) Johansson, M., Rocha, N., Zwart, W., Jordens, I., Janssen, L., Kuijl, C., Olkkonen, V.M., & Neefjes, J. (2007) Activation of endosomal dynein motors by stepwise assembly of Rab7-RILP-p150Glued, ORP1L, and the receptor betalll spectrin. J. Cell Biol., 176, 459–471.
33) Kobuna, H., Inoue, T., Shibata, M., Gengyo-Ando, K., Yamamoto, A., Mitani, S., & Arai, H. (2010) Multivesicular body formation requires OSBP–related proteins and cholesterol. PLoS Genet., 6, e1001055.
34) van der Kant, R. & Neefjes, J. (2014) Small regulators, major consequences—Ca2+ and cholesterol at the endosome-ER interface. J. Cell Sci., 127, 929–938.
35) Dong, R., Saheki, Y., Swarup, S., Lucast, L., Harper, J.W., & De Camilli, P. (2016) Endosome-ER contacts control actin nucleation and retromer function through VAP-dependent regulation of PI4P. Cell, 166, 408–423.
36) Wong, Y.C., Ysselstein, D., & Krainc, D. (2018) Mitochondria-lysosome contacts regulate mitochondrial fission via RAB7 GTP hydrolysis. Nature, 554, 382–386.
37) Blackstone, C. (2012) Cellular pathways of hereditary spastic paraplegia. Annu. Rev. Neurosci., 35, 25–47.
38) Mannan, A.U., Krawen, P., Sauter, S.M., Boehm, J., Chronowska, A., Paulus, W., Neesen, J., & Engel, W. (2006) ZFYVE27 (SPG33), a novel spastin-binding protein, is mutated in hereditary spastic paraplegia. Am. J. Hum. Genet., 79, 351–357.
39) Zhang, C., Li, D., Ma, Y., Yan, J., Yang, B., Li, P., Yu, A., Lu, C., & Ma, X. (2012) Role of spastin and protrudin in neurite outgrowth. J. Cell. Biochem., 113, 2296–2307.
40) Hashimoto, Y., Shirane, M., Matsuzaki, F., Saita, S., Ohnishi, T., & Nakayama, K.I. (2014) Protrudin regulates endoplasmic reticulum morphology and function associated with the pathogenesis of hereditary spastic paraplegia. J. Biol. Chem., 289, 12946–12961.
41) Hubner, C.A. & Kurth, I. (2014) Membrane-shaping disorders: A common pathway in axon degeneration. Brain, 137, 3109–3121.
42) Powers, R.E., Wang, S., Liu, T.Y., & Rapoport, T.A. (2017) Reconstitution of the tubular endoplasmic reticulum network with purified components. Nature, 543, 257–260.
43) Fowler, P.C., Garcia-Pardo, M.E., Simpson, J.C., & O’Sullivan, N.C. (2019) NeurodegenERation: The central role for ER contacts in neuronal function and axonopathy, lessons from hereditary spastic paraplegias and related diseases. Front. Neurosci., 13, 1051.
44) Pyle, A., Smertenko, T., Bargiela, D., Griffin, H., Duff, J., Appleton, M., Douroudis, K., Pfeffer, G., Santibanez-Koref, M., Eglon, G., et al. (2015) Exome sequencing in undiagnosed inherited and sporadic ataxias. Brain, 138, 276–283.
45) Connell, J.W., Allison, R.J., Rodger, C.E., Pearson, G., Zlamalova, E., & Reid, E. (2020) ESCRT-III-associated proteins and spastin inhibit protrudin-dependent polarised membrane traffic. Cell. Mol. Life Sci., 77, 2641–2658.
46) Shibata, Y., Voeltz, G.K., & Rapoport, T.A. (2006) Rough sheets and smooth tubules. Cell, 126, 435–439.
47) Voeltz, G.K., Prinz, W.A., Shibata, Y., Rist, J.M., & Rapoport, T.A. (2006) A class of membrane proteins shaping the tubular endoplasmic reticulum. Cell, 124, 573–586.
48) Hu, J., Shibata, Y., Voss, C., Shemesh, T., Li, Z., Coughlin, M., Kozlov, M.M., Rapoport, T.A., & Prinz, W.A. (2008) Membrane proteins of the endoplasmic reticulum induce high-curvature tubules. Science, 319, 1247–1250.
49) Hu, J., Shibata, Y., Zhu, P.P., Voss, C., Rismanchi, N., Prinz, W.A., Rapoport, T.A., & Blackstone, C. (2009) A class of dynamin-like GTPases involved in the generation of the tubular ER network. Cell, 138, 549–561.
50) Lee, S., Park, H., Zhu, P.P., Jung, S.Y., Blackstone, C., & Chang, J. (2020) Hereditary spastic paraplegia SPG8 mutations impair CAV1-dependent, integrin-mediated cell adhesion. Sci. Signal., 13, eaau7500.
51) Shirane, M., Shoji, H., Hashimoto, Y., Katagiri, H., Kobayashi, S., Manabe, T., Miyakawa, T., & Nakayama, K.I. (2020) Protrudin-deficient mice manifest depression-like behavior with abnormalities in activity, attention, and cued fear-conditioning. Mol. Brain, 13, 146–163.
52) Elbaz-Alon, Y., Guo, Y., Segev, N., Harel, M., Quinnell, D.E., Geiger, T., Avinoam, O., Li, D., & Nunnari, J. (2020) PDZD8 interacts with Protrudin and Rab7 at ER-late endosome membrane contact sites associated with mitochondria. Nat. Commun., 11, 3645.
53) Chavrier, P., Parton, R.G., Hauri, H.P., Simons, K., & Zerial, M. (1990) Localization of low molecular weight GTP binding proteins to exocytic and endocytic compartments. Cell, 62, 317–329.
54) Guillen-Samander, A., Bian, X., & De Camilli, P. (2019) PDZD8 mediates a Rab7-dependent interaction of the ER with late endosomes and lysosomes. Proc. Natl. Acad. Sci. USA, 116, 22619–22623.
55) Watanabe, Y., Tamura, Y., Kawano, S., & Endo, T. (2015) Structural and mechanistic insights into phospholipid transfer by Ups1-Mdm35 in mitochondria. Nat. Commun., 6, 7922.
56) Alva, V. & Lupas, A.N. (2016) The TULIP superfamily of eukaryotic lipid-binding proteins as a mediator of lipid sensing and transport. Biochim. Biophys. Acta, 1861(8 Pt B), 913–923.
57) Kaiser, S.E., Brickner, J.H., Reilein, A.R., Fenn, T.D., Walter, P., & Brunger, A.T. (2005) Structural basis of FFAT motif-mediated ER targeting. Structure, 13, 1035–1045.
58) Loewen, C.J. & Levine, T.P. (2005) A highly conserved binding site in vesicle-associated membrane protein-associated protein (VAP) for the FFAT motif of lipid-binding proteins. J. Biol. Chem., 280, 14097–14104.
59) Huttlin, E.L., Ting, L., Bruckner, R.J., Gebreab, F., Gygi, M.P., Szpyt, J., Tam, S., Zarraga, G., Colby, G., Baltier, K., et al. (2015) The BioPlex network: A systematic exploration of the human interactome. Cell, 162, 425–440.
60) Nishimura, A.L., Mitne-Neto, M., Silva, H.C., Richieri-Costa, A., Middleton, S., Cascio, D., Kok, F., Oliveira, J.R., Gillingwater, T., Webb, J., et al. (2004) A mutation in the vesicle-trafficking protein VAPB causes late-onset spinal muscular atrophy and amyotrophic lateral sclerosis. Am. J. Hum. Genet., 75, 822–831.
61) Zhao, K. & Ridgway, N.D. (2017) Oxysterol-binding protein-related protein 1L regulates cholesterol egress from the endo-lysosomal system. Cell Rep., 19, 1807–1818.
62) Ma, X., Liu, K., Li, J., Li, H., Li, J., Liu, Y., Yang, C., & Liang, H. (2018) A non-canonical GTPase interaction enables ORP1L-Rab7-RILP complex formation and late endosome positioning. J. Biol. Chem., 293, 14155–14164.
63) Du, X., Kumar, J., Ferguson, C., Schulz, T.A., Ong, Y.S., Hong, W., Prinz, W.A., Parton, R.G., Brown, A.J., & Yang, H. (2011) A role for oxysterol-binding protein-related protein 5 in endosomal cholesterol trafficking. J. Cell Biol., 192, 121–135.
64) Alpy, F., Rousseau, A., Schwab, Y., Legueux, F., Stoll, I., Wendling, C., Spiegelhalter, C., Kessler, P., Mathelin, C., Rio, M.C., et al. (2013) STARD3 or STARD3NL and VAP form a novel molecular tether between late endosomes and the ER. J. Cell Sci., 126, 5500–5512.
65) Wilhelm, L.P., Wendling, C., Vedie, B., Kobayashi, T., Chenard, M.P., Tomasetto, C., Drin, G., & Alpy, F. (2017) STARD3 mediates endoplasmic reticulum-to-endosome cholesterol transport at membrane contact sites. EMBO J., 36, 1412–1433.
66) Lesage, S., Drouet, V., Majounie, E., Deramecourt, V., Jacoupy, M., Nicolas, A., Cormier-Dequaire, F., Hassoun, S.M., Pujol, C., Ciura, S., et al.; French Parkinson’s Disease Genetics Study (PDG); International Parkinson’s Disease Genomics Consortium (IPDGC). (2016) Loss of VPS13C function in autosomal-recessive parkinsonism causes mitochondrial dysfunction and increases PINK1/parkin-dependent mitophagy. Am. J. Hum. Genet., 98, 500–513.
67) Kumar, N., Leonzino, M., Hancock-Cerutti, W., Horenkamp, F.A., Li, P., Lees, J.A., Wheeler, H., Reinisch, K.M., & De Camilli, P. (2018) VPS13A and VPS13C are lipid transport proteins differentially localized at ER contact sites. J. Cell Biol., 217, 3625–3639.
68) Gillingham, A.K., Bertram, J., Begum, F., & Munro, S. (2019). eLife, 8.
69) Gil, J.E., Kim, E., Kim, I.S., Ku, B., Park, W.S., Oh, B.H., Ryu, S.H., Cho, W., & Heo, W.D. (2012) Phosphoinositides differentially regulate protrudin localization through the FYVE domain. J. Biol. Chem., 287, 41268–41276.
70) Bharadwaj, R.A., Jaffe, A.E., Chen, Q., Deep-Soboslay, A., Goldman, A.L., Mighdoll, M.I., Cotoia, J.A., Brandtjen, A.C., Shin, J., Hyde, T.M., et al. (2018) Genetic risk mechanisms of posttraumatic stress disorder in the human brain. J. Neurosci. Res., 96, 21–30.
71) Verhoeven, K., De Jonghe, P., Coen, K., Verpoorten, N., Auer-Grumbach, M., Kwon, J.M., FitzPatrick, D., Schmedding, E., De Vriendt, E., Jacobs, A., et al. (2003) Mutations in the small GTP-ase late endosomal protein RAB7 cause Charcot-Marie-Tooth type 2B neuropathy. Am. J. Hum. Genet., 72, 722–727.
72) McCray, B.A., Skordalakes, E., & Taylor, J.P. (2010) Disease mutations in Rab7 result in unregulated nucleotide exchange and inappropriate activation. Hum. Mol. Genet., 19, 1033–1047.
73) Morris, M., Maeda, S., Vossel, K., & Mucke, L. (2011) The many faces of tau. Neuron, 70, 410–426.
著者紹介Author Profile
 白根 道子(しらね みちこ)
白根 道子(しらね みちこ)名古屋市立大学大学院薬学研究科教授.博士(薬学).
略歴1990年大阪大学理学部卒.99年PhD(東大薬).90年ロシュ研究員,2000年学振特別研究員,03年さきがけ研究者,04年九州大学生体防御医学研究所助手,06年同准教授.17年より現職.
研究テーマと抱負細胞内オルガネラと神経精神疾患との関連機構を明らかにすることを目指している.特にオルガネラコミュニケーションを介した脂質輸送やカルシウム調節やオルガネラ動態制御に注目して研究を続けている.
ウェブサイトhttp://www.phar.nagoya-cu.ac.jp/hp/byg
趣味音楽鑑賞.