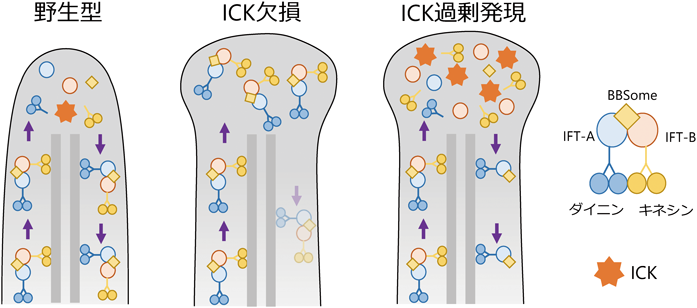
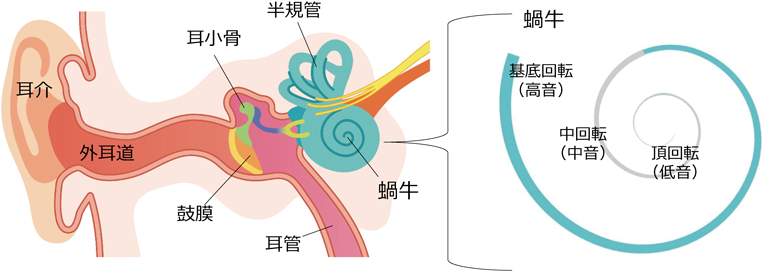
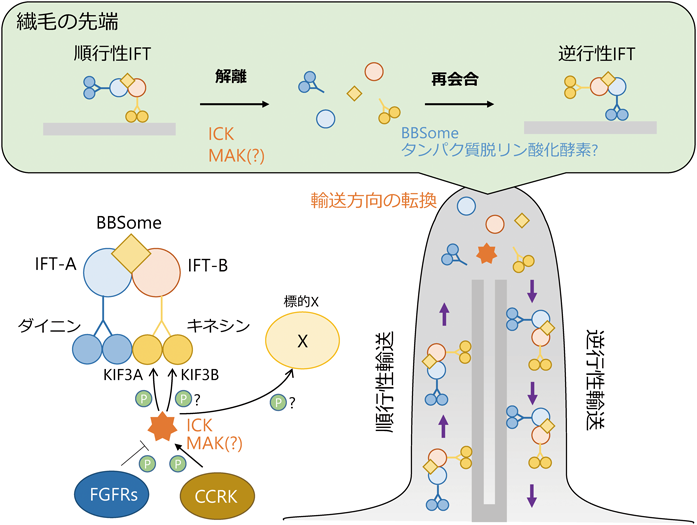
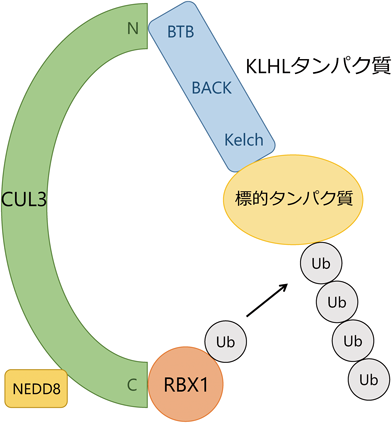
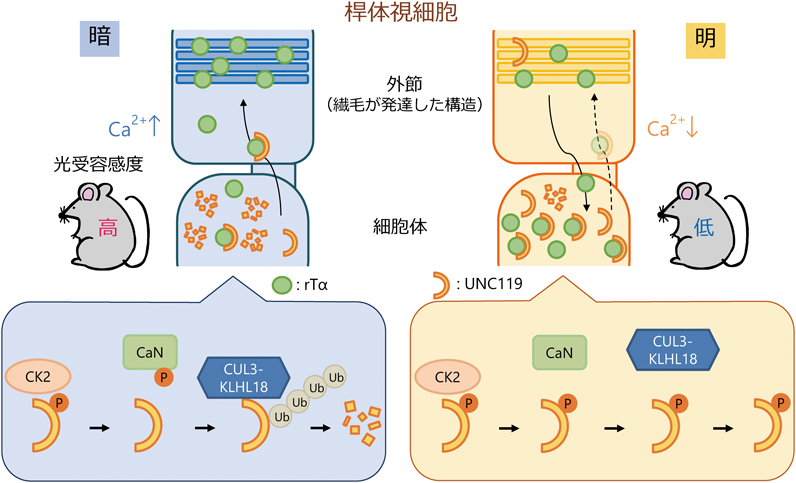
繊毛におけるタンパク質輸送制御のメカニズムと生理的意義の解析Analysis of the mechanism and physiological significance of ciliary protein trafficking
大阪大学蛋白質研究所分子発生学研究室Laboratory for Molecular and Developmental Biology, Institute for Protein Research, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘3–2 ◇ 3–2 Yamadaoka, Suita, Osaka 565–0871, Japan