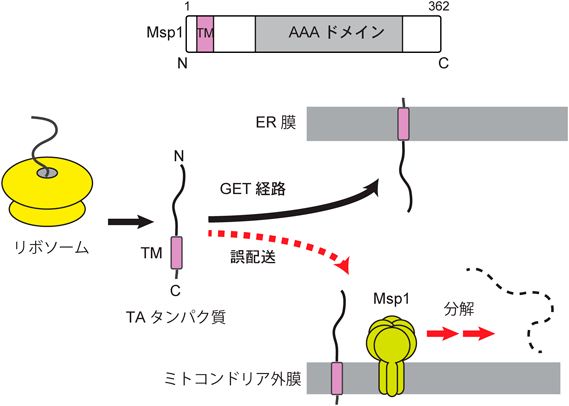
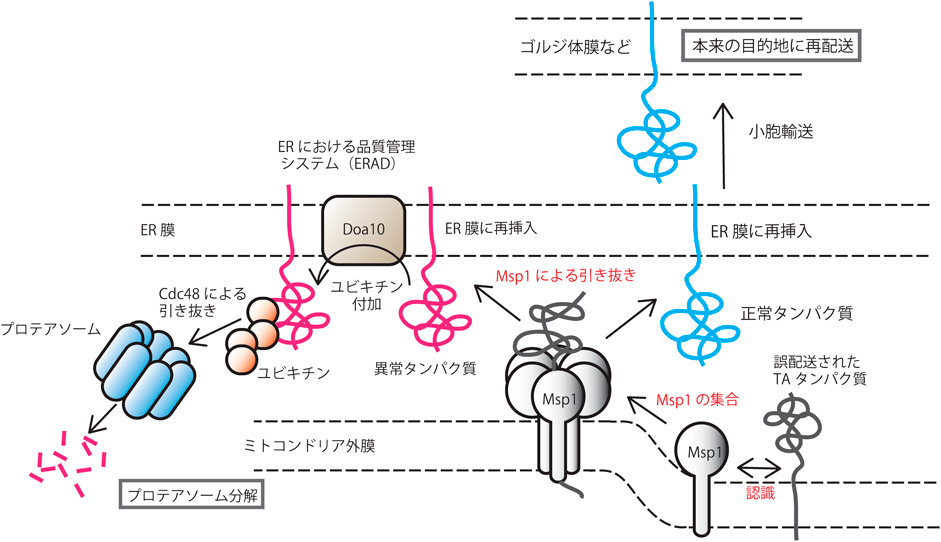
ミトコンドリアAAA-ATPアーゼMsp1による誤配送タンパク質の配送校正機構Proofreading of protein mislocalization mediated by a mitochondrial AAA-ATPase Msp1
1 九州大学大学院農学研究院Graduate School of Bioresource and Bioenvironmental Sciences, Kyushu University ◇ 〒819–0395 福岡市西区元岡744 ◇ Motooka 744, Nishi-ku, Fukuoka 819–0395, Japan
2 京都産業大学生命科学部・タンパク質動態研究所Faculty of Life Sciences and Institute of Protein Dynamics, Kyoto Sangyo University ◇ 〒603–8555 京都市北区上賀茂本山 ◇ Kamigamo-motoyama, Kita-ku, Kyoto 603–8555, Japan