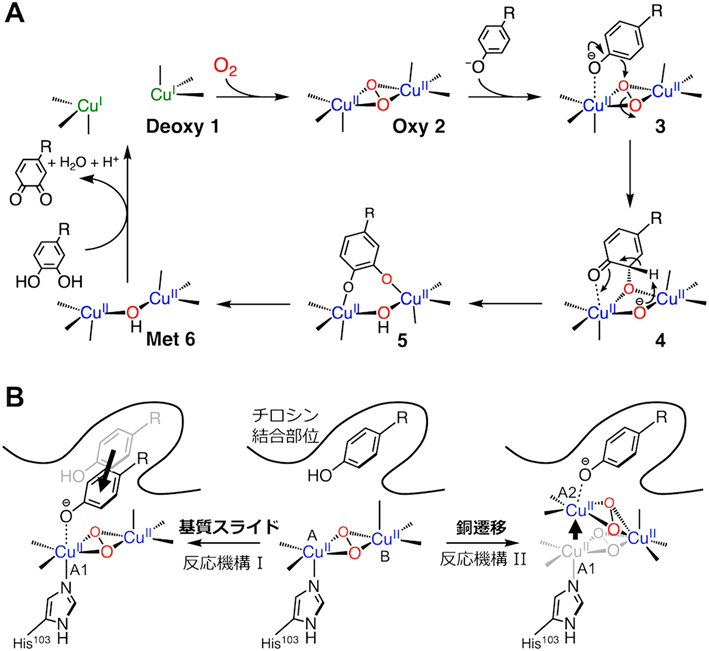
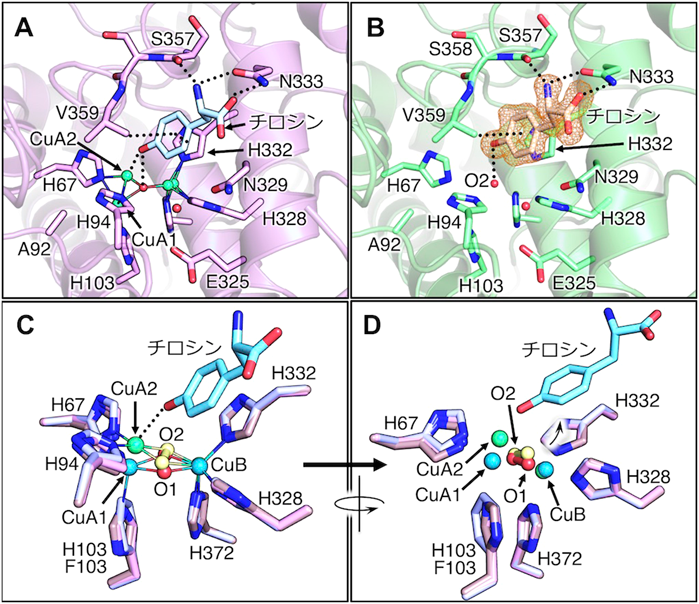
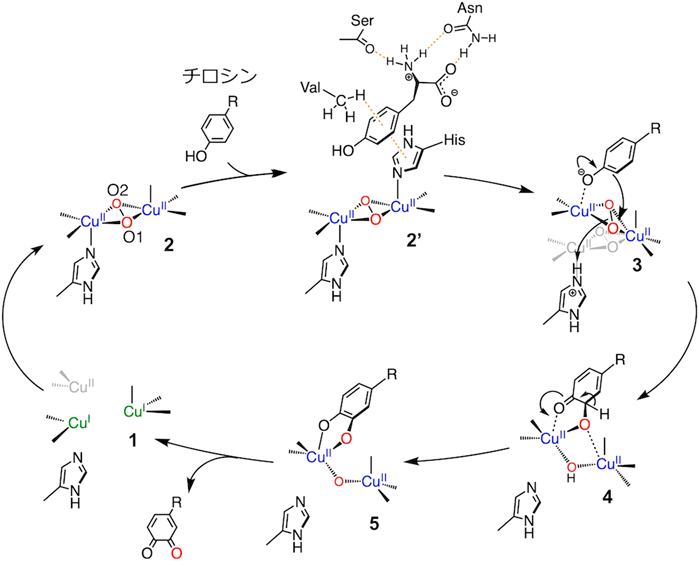
チロシナーゼ反応機構における銅活性酸素種の動的挙動Dynamic behavior of copper-oxygen species in tyrosinase mechanism
1 大阪府立大学大学院生命環境科学研究科Osaka Prefecture University, Graduate School of Life and Environmental Sciences ◇ 〒599–8531 大阪府堺市中区学園町1–1 ◇ 1–1 Gakuen-Cho, Naka-ku, Sakai-shi, Osaka 599–8531, Japan
2 大阪大学大学院工学研究科Osaka University, Graduate School of Engineering ◇ 〒565–08751 大阪府吹田市山田丘2–1 ◇ 2–1 Yamadaoka, Suita, Osaka 565–0871, Japan