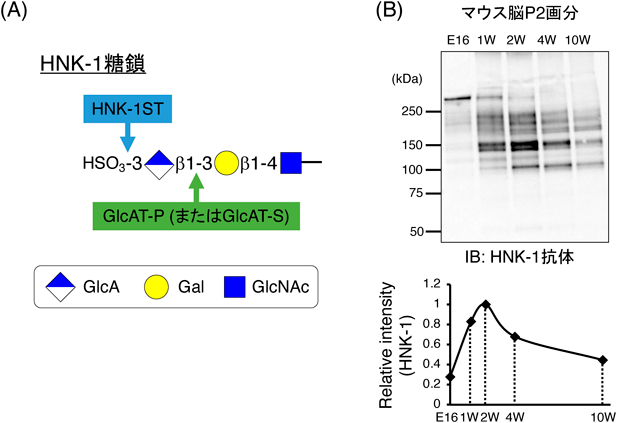
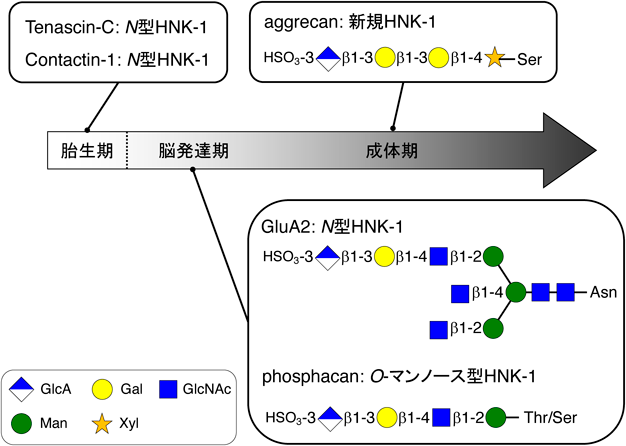
脳発達に伴う硫酸化糖鎖HNK-1の機能的役割Functional role of sulfated glycan HNK-1 during the brain-developmental stage
京都大学大学院医学研究科人間健康科学系専攻Human Health Sciences, Graduate School of Medicine, Kyoto University ◇ 〒606–8507 京都市左京区聖護院河原町53 ◇ Shogoin Kawahara-cho 53, Sakyo-ku, Kyoto 606–8507, Japan