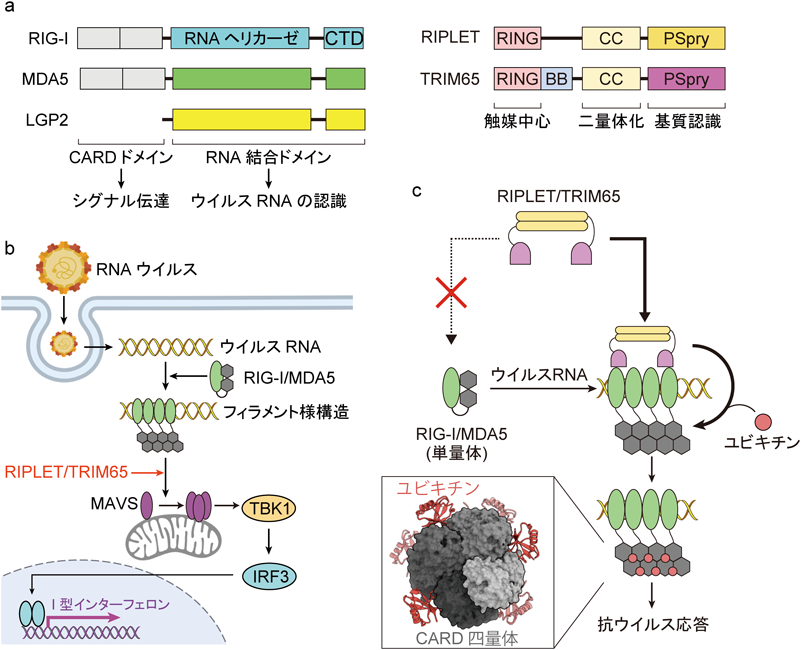
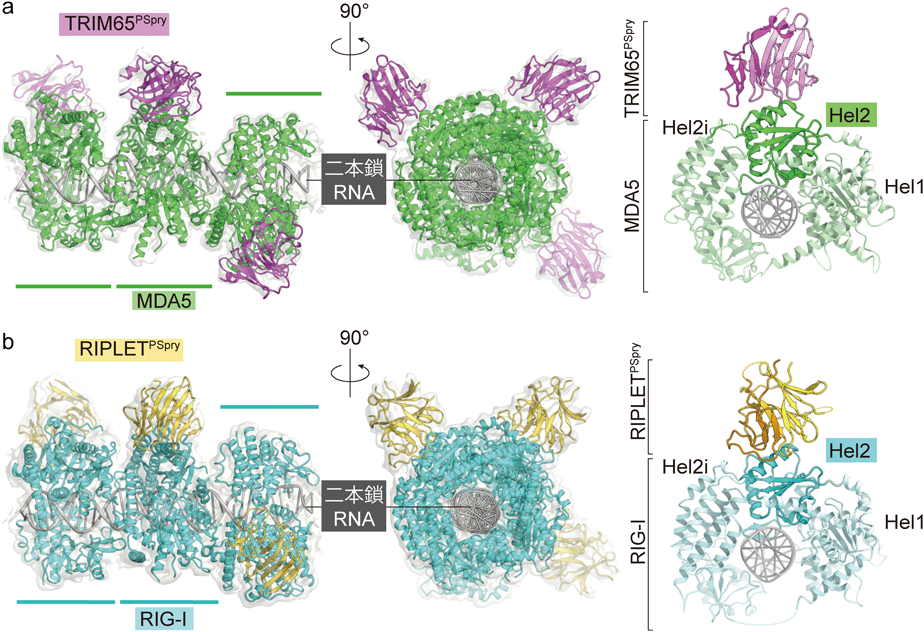
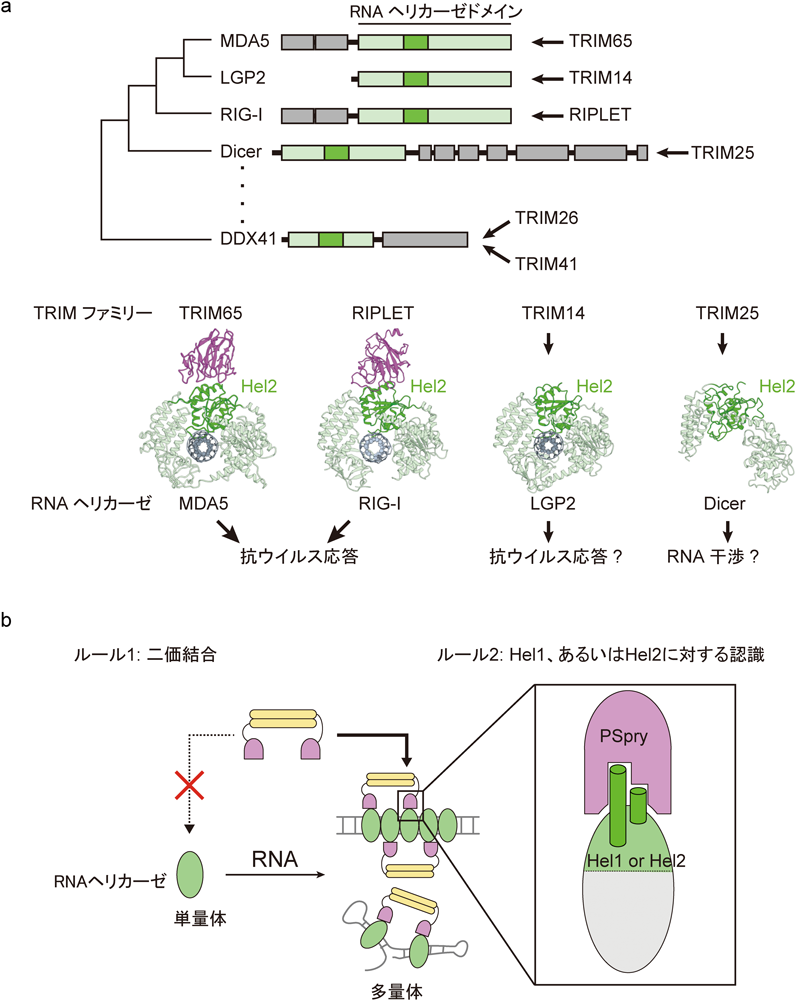
自然免疫応答を超えて進化的に保存されたRNAヘリカーゼとTRIMユビキチンリガーゼの相互作用様式Structural analysis of RIG-I-like receptors reveals ancient rules of engagement between diverse RNA helicases and TRIM ubiquitin ligases
東京大学先端科学技術研究センター構造生命科学分野Structural Biology Division, Research Center for Advanced Science and Technology, The University of Tokyo ◇ 〒153–8904 東京都目黒区駒場4–6–1 東京大学先端科学技術研究センター 4号館320室 ◇ 4–6–1 Komaba, Meguro-ku, Tokyo 153–8904, Japan