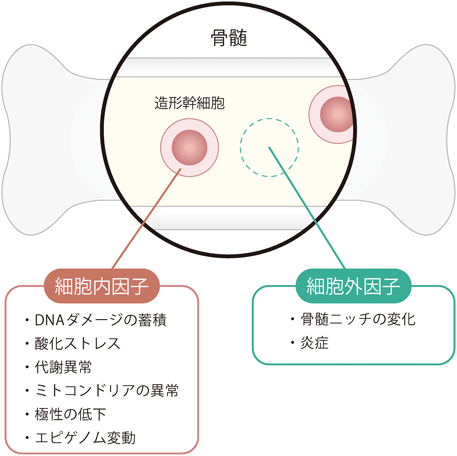
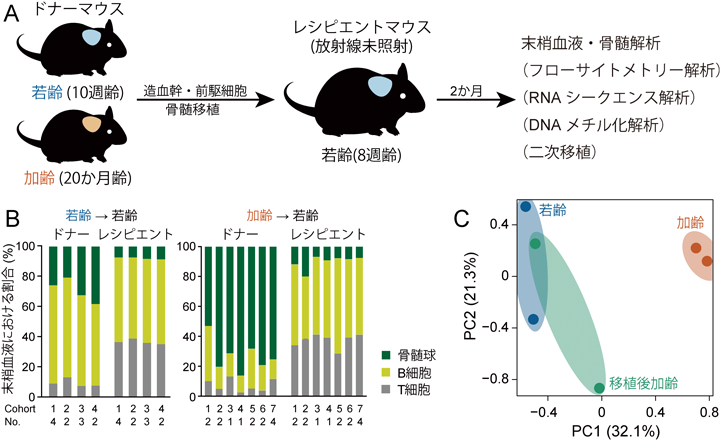
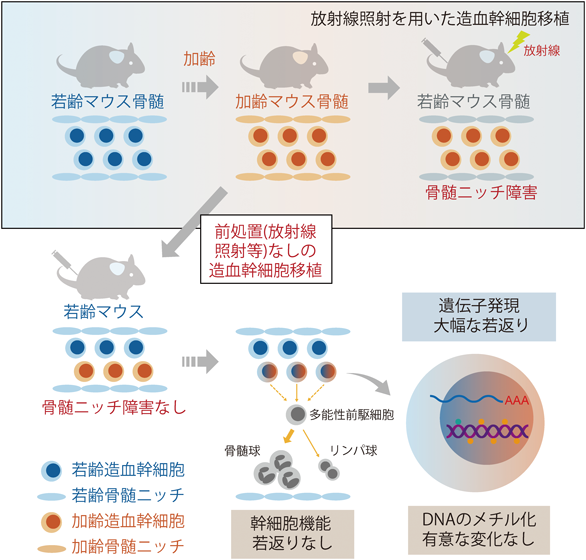
造血幹細胞のエイジングと骨髄ニッチLimited rejuvenation of aged hematopoietic stem cells in young bone marrow niche
東京大学医科学研究所幹細胞治療研究センター幹細胞分子医学分野Division of Stem Cell and Molecular Medicine, Center for Stem Cell Biology and Regenerative Medicine, The Institute of Medical Science, The University of Tokyo ◇ 〒108–8639 東京都港区白金台4–6–1 ◇ 4–6–1 Shirokanedai, Minato-ku, Tokyo 108–8639, Japan