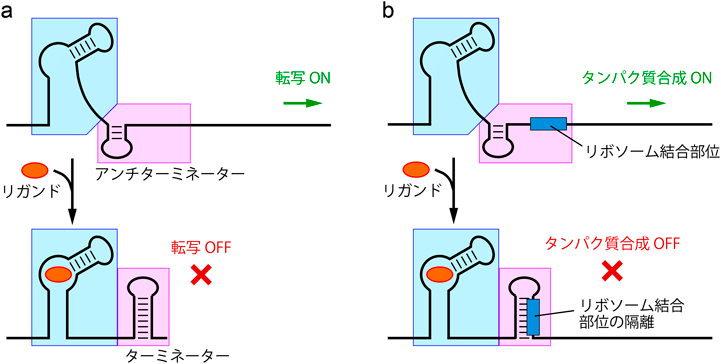
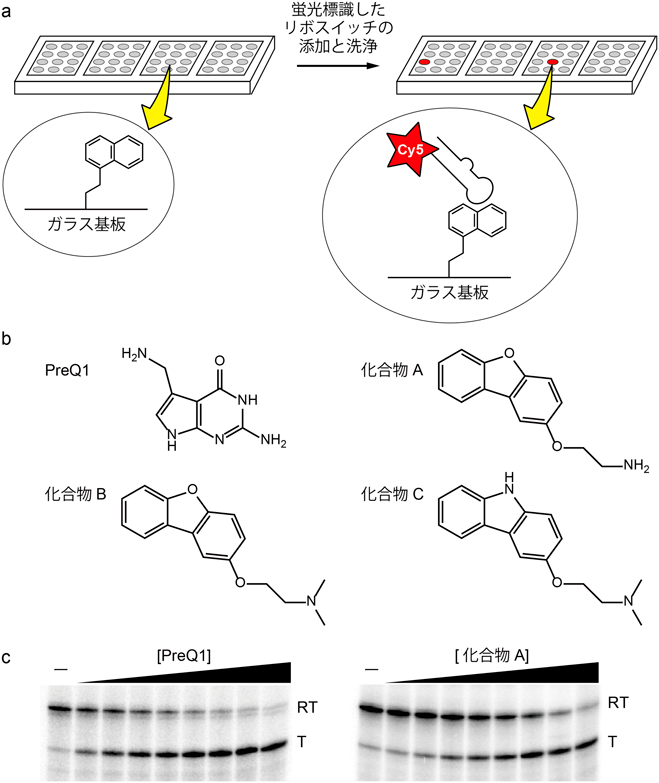
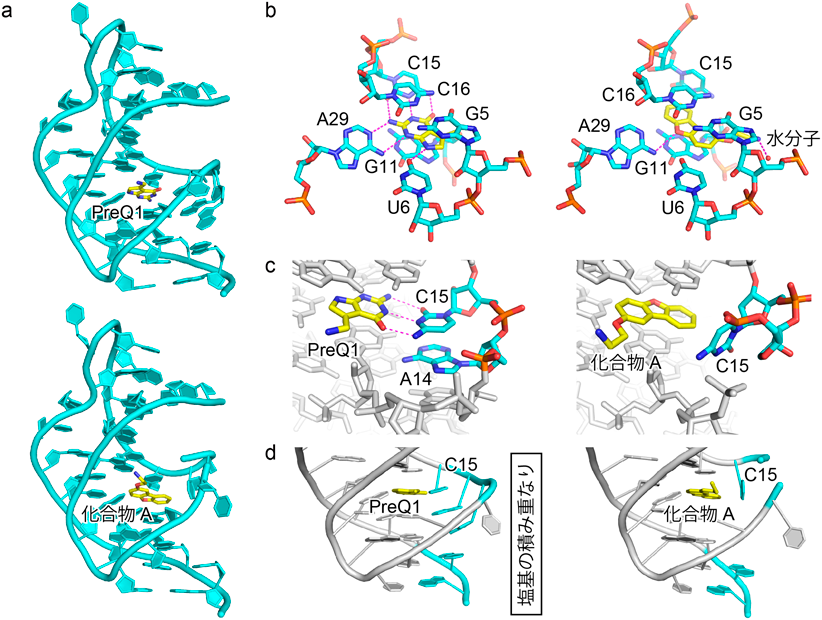
細菌RNAを標的とした新たな抗生物質候補化合物の創製と評価Discovery and evaluation of novel candidates of antibiotics targeting bacteria-specific RNA
1 九州大学大学院農学研究院Graduate School of Bioresource & Bioenvironmental Sciences, Kyushu University ◇ 〒819–0395 福岡市西区元岡744 ◇ 744 Motooka, Nishi-ku, Fukuoka-shi, Fukuoka 819–0395, Japan
2 Biochemistry and Biophysics Center, National Heart, Lung and Blood Institute, NIHBiochemistry and Biophysics Center, National Heart, Lung and Blood Institute, NIH ◇ 50 South Drive, Bethesda, MD 20814, USA ◇ 50 South Drive, Bethesda, MD 20814, USA
3 産業技術総合研究所バイオメディカル研究部門Biomedical Research Institute, National Institute of Advanced Industrial Science and Technology ◇ 〒305–8566 茨城県つくば市東1–1–1 ◇ 1–1–1 Higashi, Tsukuba-shi, Ibaraki 305–8566, Japan
4 Chemical Biology Laboratory, National Cancer Institute, NIHChemical Biology Laboratory, National Cancer Institute, NIH ◇ Frederick, MD 21702, USA ◇ Frederick, MD 21702, USA