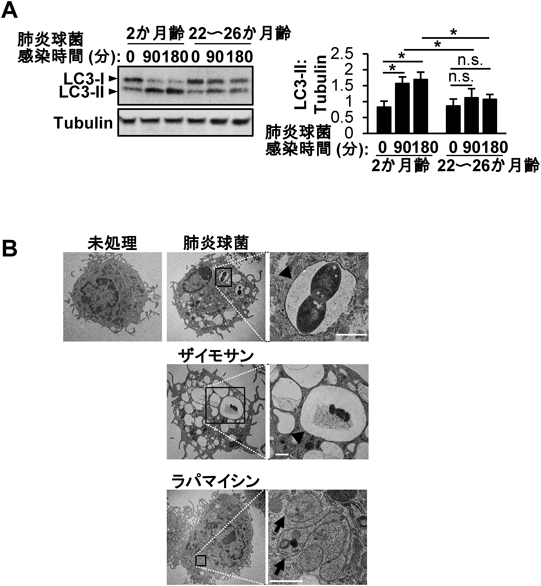
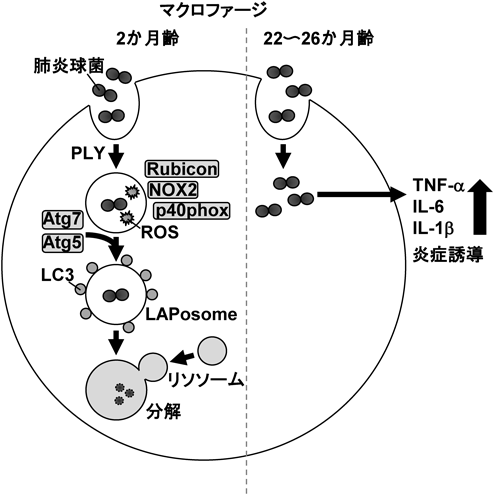
マクロファージにおけるLC3-associated phagocytosisを介した肺炎連鎖球菌に対する免疫防御機構—老化との関連Macrophage LC3-associated phagocytosis acts as an immune defense mechanism against Streptococcus pneumoniae—its relationship to aging
明海大学歯学部口腔生物再生医工学講座微生物学分野Division of Microbiology and Immunology, Department of Oral Biology and Tissue Engineering, Meikai University, School of Dentistry ◇ 〒350–0283 埼玉県坂戸市けやき台1–1 ◇ 1–1 Keyakidai, Sakado, Saitama 350–0283, Japan