タンパク質の分析に電気泳動は不可欠の技術であり,主にSDS(sodium dodecyl sulfate),等電点,ネイティブ電気泳動の三つに大別される.ネイティブ電気泳動とはタンパク質をできるだけ天然状態で分析する方法で,主に二つのやり方がある.一つは完全にタンパク質そのものの電荷状態に依存するもので,その等電点と電気泳動のpHによって移動する方向が決まる.たとえばpH 11で電気泳動を行えばほとんどのタンパク質は陽極側へと泳動されるが,そのようなpHではタンパク質が構造変化や化学修飾を受けて,天然状態の性質がみられない可能性がある.一般によく使われるのはpH 8付近のTris-Glycineを使った方法で,この場合,等電点がその付近にある抗体などは泳動されないか,あるいは陰極側のゲル外へ泳動されることが起こりうる.その場合電極を逆にし,正電荷を持つタンパク質をゲル内へと泳動させればよいわけだが,不思議なことにバンドの形状が変化したりしてうまくいかない例が報告されている1).もう一つの方法は負電荷を持つ色素コマシーブリリアントブルー(CBB)を添加してタンパク質に負電荷を持たせるブルーネイティブ電気泳動である.この方法の問題は後で述べるように,CBBが結合することと,その結合がタンパク質に影響しないことが前提となっていることである.そこで我々がCBBを用いなくても問題なく泳動できるように工夫したのがここで述べるアガロースを使ったネイティブ電気泳動である2–6).アガロースはアクリルアミドと違って扱いが安全で容易である.泳動条件として100 mMのヒスチジン塩基と酸のMESを当モルで配合したpH 6.1の緩衝液を使うことにした.このpHだと生理条件に近く,タンパク質の構造,高分子複合体,タンパク質や核酸と低分子物質との相互作用などが保存される確率が高い.また分析サンプルをゲル中央に入れるので,サンプルの泳動方向に制約がなく,電荷の状態に関係なく分析が可能である.この方法を用いてウシ血清アルブミン(BSA)の限定還元による会合,抗体の凝集,特異的分子集合,酵素活性のゲル中での測定,キナーゼのリン酸化などの解析を行った.
本法の原点はPAGE用に提唱された表1の緩衝液組成にある7).留意すべきことはこれらの成分はすべて酸,塩基そのもので,対イオンを含まない.たとえばヒスチジン(His)はヒスチジン塩酸塩ではない.中性pH付近では6.1から8.1までの4種があげられているが,どこのラボでもありそうな試薬として,pH 6.1のHis/MES系を試みた.上記pHの他の3個の緩衝液でもポリアクリルアミドゲルでバンドの形状がよく,緩衝液のpHの変動が小さいことが報告されている7).我々はより簡単なアガロースゲルを使用することにした.何といっても大きな違いは,アガロースゲルの作製には他の試薬,たとえば触媒など,はまったく必要ない,ということである.それゆえ反応副産物の除去などの操作が無用である.毒性もゼロである.
表1 ネイティブ電気泳動の緩衝液組成7)| pH | 塩基性側 | 酸性側 |
|---|
| 3.8 | 30 mM β-アラニン | 20 mM乳酸 |
| 4.4 | 80 mM β-アラニン | 40 mM酢酸 |
| 4.8 | 80 mM γ-アミノ酪酸 | 20 mM酢酸 |
| 6.1 | 30 mMヒスチジン | 30 mM MES |
| 6.6 | 25 mMヒスチジン | 30 mM MOPS |
| 7.4 | 43 mMイミダゾール | 35 mM HEPES |
| 8.1 | 32 mMトリス | 30 mM EPPS |
| 8.7 | 50 mMトリス | 25 mMホウ酸 |
| 9.4 | 60 mMトリス | 40 mM CAPS |
| 10.2 | 37 mMアンモニア | 20 mM CAPS |
| McLellan, T. (1982) Electrophoresis buffes for polyacrylamide gels at various pH. Anal. Biochem., 126, 94–99. |
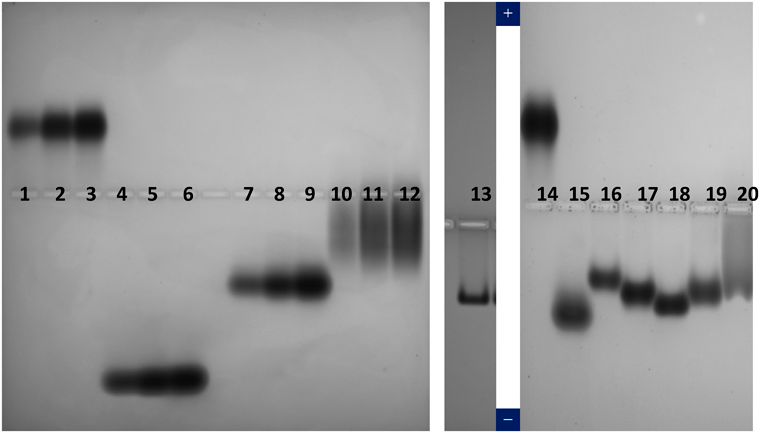
まず表の組成に基づき30 mMのHis/MESを用い,1%のアガロースゲルで泳動を試みたが,バンドがスメアになりアクリルアミドゲルを用いた先行研究7)のような結果は得られなかった2).その差がアクリルアミドゲルとアガロースゲルの差にあるかどうかは不明であるが,その可能性の一つとして電気浸透効果が考えられる.両ゲルの組成はまったく異なるので,表面電荷状態が異なれば,電気浸透効果に基づく溶媒の流れが変わる可能性はある.30 mMでスメアだったバンドは60 mMでは大きく改善され,100 mMでは完全に解消した2).図1はその結果の一つである1, 6).酸性タンパク質であるBSA(レーン1~3, 14)は陽極側,塩基性タンパク質である抗体(レーン10~12),キモトリプシン(レーン7~9),リゾチーム(レーン4~6)は陰極側に泳動されている.ここでポリクローナル抗体は,その特性を反映してバンドがブロードになっている.なお電気泳動の指標として陽極側への移動にはブロモフェノールブルーが,陰極側への移動のモニターにはメチルグリーンを用いた.また正電荷を持つAAVウイルス粒子(レーン13)も陰極側に泳動されている.このウイルスは非エンベロープウイルスで小さいが,それでも抗体などのタンパク質と比べるとはるかに大きい.大きな分子集合でも十分分析可能である.
同じ図1にいくつかのモノクローナル抗体(レーン15~20)の例を示した.4個のモノクローナル抗体(15~19)は電荷の違いを反映して移動度が異なっているものの,まともなバンドの形状を示しているが,一つの抗体(レーン20)は変性凝集に基づくスメアを示しており,それはこの抗体の不安定性を反映している.この結果は抗体の違いや安定性についても本法の有用性を示すものである.ここでさらにネイティブ電気泳動と他の電気泳動との違いの詳細を述べることにより,本法の利点について明らかにしたい.
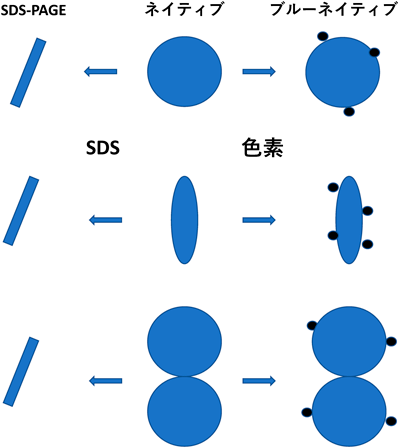
図2にSDS,ブルーネイティブ,ネイティブ電気泳動がタンパク質に及ぼす影響を模式図で示している.上段,中段は天然状態と変性状態のタンパク質にSDSあるいはCBBを添加したときの影響を示している.SDSを添加すると天然状態でも変性状態でもタンパク質分子は棒状の構造をとるようになり,電気泳動の結果は同じになる.CBBは主に疎水性部分に結合するので,その結合数が増える変性状態の方がより負に帯電するものと考えられるが(移動度を上げる),分子形の違いも含めて電気泳動への影響が予想できにくい.またCBBの結合が構造変化を促進する可能性がある(移動度を下げる).ネイティブ電気泳動では分子形の違いによる分子ふるい効果のみで,差がみられることになる.さらに,図2(下)に非共有結合による分子集合への影響を示す.SDSでタンパク質の複合体は解離するため,SDS電気泳動では分子の会合集合をみることはできない.ブルーネイティブでは色素の結合が分子集合の解離を促進しなければ,集合状態を検出しうる.一方,ネイティブ電気泳動では分子集合が保存され,分子ふるい効果で差が出る可能性が高い.このようにネイティブ電気泳動は分子の構造変化や集合状態の変化を検出できる利点がある.ブルーネイティブでも同変化を検出できる可能性があるが,構造や分子集合に色素結合が影響する可能性は常に残る.また分子が陽極側へと泳動されるためには,色素が結合することが前提である.疎水性が高い膜タンパク質の泳動には有効であるが,通常の水溶性タンパク質には応用できない可能性がある.
ネイティブ構造が維持されることで可能な分析がゲル中酵素活性測定,いわゆるザイモグラフィーである.SDS電気泳動でこれがみられるためにはSDS除去後活性が戻ることが前提となる.ブルーネイティブの場合,色素の結合が活性状態に影響しないことが前提となる.以下に本法を使って,タンパク質の構造に影響しないという利点を生かした結果を中心に紹介する.
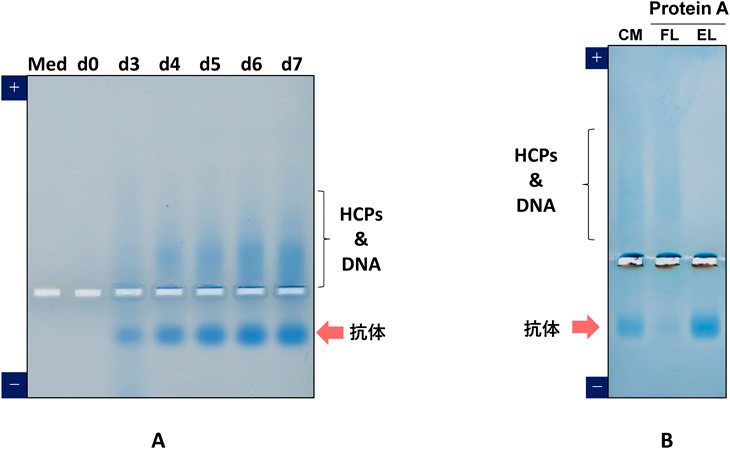
ウサギモノクローナル抗体の遺伝子をHEK293細胞にトランスフェクションし,分泌された組換えモノクローナル抗体を経時的にネイティブアガロースゲル電気泳動で解析した.HEK293細胞用培地(極東製薬工業社製)中に生産された抗体(pI=7.8)は,陰極側に移動し,抗HEK293細胞に対する特異抗体で染色される不純物のHost Cell Proteins(HCPs)は,陽極側に移動した(図3A).本方法では,抗体と不純物が逆方向に泳動され,簡便に培養上清中の抗体の発現量,純度,荷電状態,凝集体,HCPsの検出が可能である3, 4).また,抗体を6日発現させた培養上清から,Protein Aを用いて精製する工程も短時間に検出可能であった(図3B).
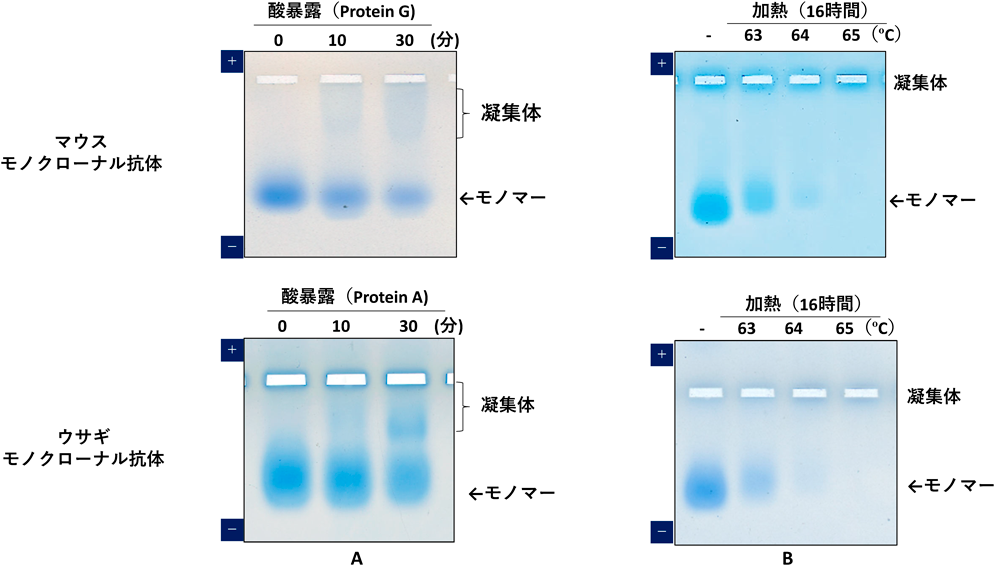
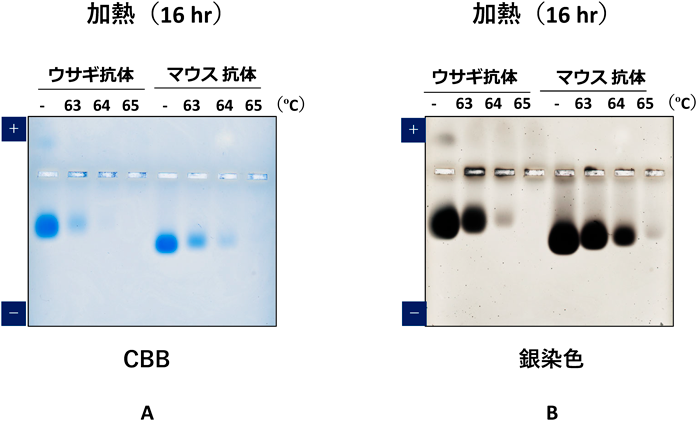
マウスモノクローナル抗体をProtein Gに,ウサギモノクローナル抗体をProtein Aに結合させ,溶出緩衝液(0.1 M Glycine-HCl, pH 2.0)にて室温で10~30分処理し,抗体の酸による変性・凝集の様子をネイティブアガロースゲル電気泳動法により解析した5).それぞれの抗体において,10分の酸曝露でわずかな,30分では顕著な可溶性凝集体が形成されることを検出した(図4A).また,1.4~2.5 mg/mLの抗体をTris-buffered saline(pH 7.6)に溶解し,16時間,沈殿を伴う非可逆凝集を起こすとされる変性温度63~65°Cで加熱したところ,63°Cからモノマーの変性と凝集が始まりモノマーのバンドのわずかな移動度の変化とバンドが薄くなり,65°Cでは,モノマーのバンドが完全消失し,加熱凝集が著しく進行する様子も検出された(図4B).本方法は,タンパク質の酸や加熱による凝集体形成を簡便に検出することが可能であることが示された5).
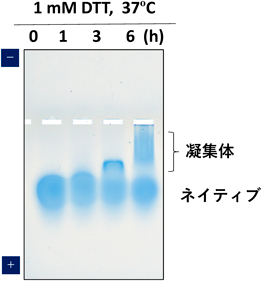
ウシ血清アルブミン(BSA)は,分子内に17個のS–S結合と一つのシステインがある66.4 kDa, pI=5.2の球状タンパク質である.BSAにジチオスレイトール(DTT)を作用させた限定還元による構造変化の様子をネイティブアガロースゲル電気泳動により解析した5).10 mg/mL BSAをphosphate-buffered saline(PBS)で調製し,DTTを1 mMになるよう添加後,37°Cで0, 1, 3, 6時間インキュベートすることで限定還元し,すぐに氷上に移した.100 mM His/MES(pH 6.1)で10倍希釈(終濃度1 mg/mL BSA, 0.1 mM DTT)し,1 mM N-ethylmaleimide(NEM)でフリーのSH基をブロックし,ネイティブアガロースゲル電気泳動を行った.DTT添加3時間で限定還元された特徴的なバンドが観察され,6時間では陽極側にスメアなバンドが観察された.これは,S–S結合の限定還元による開裂により分子内部の疎水面が表面露出し,BSA分子間の凝集体が形成されたものと考えられた(図5).もちろんNEMによる保護効果もあるが,SH基の解離が起こるpHより2ユニット低いpH 6.1下でのネイティブアガロースゲル電気泳動は,BSAの限定還元後の再酸化の影響も受けにくく,温和な条件で溶液でのタンパク質の構造変化を検出するあらたな実験手法といえる.
6. 大腸菌のβ-ガラクトシダーゼのゲル中酵素活性染色
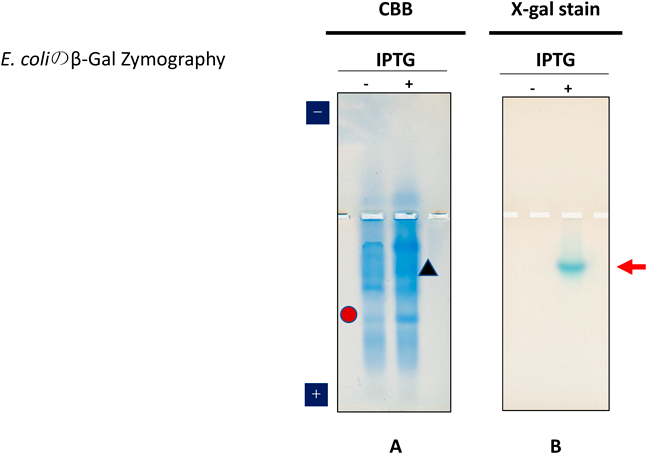
大腸菌のβ-ガラクトシダーゼは,pI=5.3のホモ四量体からなる約400 kDa巨大分子である.大腸菌DH5αは,LacZα遺伝子をプラスミドの形で導入することで活性のあるβ-ガラクトシダーゼが発現するようになる.そこで,プラスミドpUC19にて形質転換してIPTG添加によりLacZαを発現誘導させることで,菌体内に活性型のホモ4量体のβ-ガラクトシダーゼ酵素を発現させた.LacZαがない状態ではIPTG−(図6,〇印で示す)の活性のないβ-ガラクトシダーゼ二量体ができ,LacZαを発現したIPTG+では▲印の活性四量体ができる.菌体の可溶性ライセートをネイティブアガロースゲル電気泳動し,泳動後のゲルをX-galを基質とした溶液に浸漬すると,発現誘導後のレーンのみにβ-ガラクトシダーゼの酵素活性を示す矢印の青色のバンドを検出した(図6).本方法は,ネイティブアガロースゲル電気泳動による新たなザイモグラフィーであり,400 kDaの巨大分子が,わずか40分で理論的pIの方向である陽極側へ移動することを示している.本方法は,SDS-PAGEでは解析不能なオリゴマー酵素などの巨大タンパク質複合体を,活性を維持した状態で検出可能であり,今後の応用が広がっていくものと考えられた4).
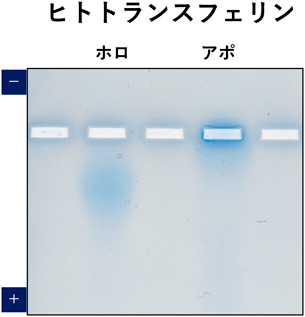
ヒトトランスフェリン(77 kDa)は鉄非結合時(アポトランスフェリン)と2分子の鉄結合時(ホロトランスフェリン)で立体構造が変化し,等電点が異なることが報告されている8–10).この構造の違いをネイティブアガロース電気泳動で検出できるかどうか試みた5).その結果,アポトランスフェリン(pI=6.1)は,pH=6.1の泳動緩衝液にてウエル付近にとどまり,ホロトランスフェリン(pI=5.6)は陽極側へ泳動され,理論的に予想される挙動を示した(図7).
銀染色は,タンパク質を高感度に検出する染色法として一般的によく用いられる.しかしながら,市販の多くの銀染色キットは,タンパク質のみならず糖にも反応を示すため,アガロースゲルを用いた染色では問題になるが,Bio-Rad社のSilver Stain Plus kitは,アガロースに反応しないことを特徴にしており,他社品とは,染色原理も異なっている.もっぱら核酸を高感度に検出することを目的に使用されることが多いが,今回,ネイティブアガロースゲル電気泳動後のタンパク質の検出を試みた5).図8に示すように,CBBでは検出されなかった加熱変性凝集体をスメアな状態で検出し,ウエル付近に蓄積した高分子凝集体も検出した.本銀染色キットの原理は,タングステンケイ酸,硝酸銀,硝酸アンモニウム,炭酸ナトリウム,ホルムアルデヒドの混合液を添加することで,タングステンケイ酸に結合した銀イオン–アミン錯体からイオン交換的・求電子的な相互作用によりタンパク質へ銀イオンが移動し染色されると考えられている11).銀イオンがタンパク質に結合するまで溶液中で安定化されるタングステンケイ酸+銀の錯体として存在し,増感のための酸化ステップがないために糖に銀イオンが結合することもない.Silver Stain Plus kitは,タンパク質の変性凝集体を電気泳動により高感度に検出する等の応用には適していると考えられた.ただし,糖タンパク質の検出は,逆に感度が低下し,今後の課題である.
細胞膜から核内への細胞内シグナル伝達におけるキナーゼの役割の解析研究は,多く報告されている.これまでの実験手法のほとんどが,細胞ライセートを還元処理し,SDS-PAGE後,ウエスタンブロットによりリン酸化タンパク質に対する特異的抗体を用いて検出する方法である.今回,キナーゼ活性の解析をネイティブアガロースゲル電気泳動とウエスタンブロットを組み合わせることで検討した.
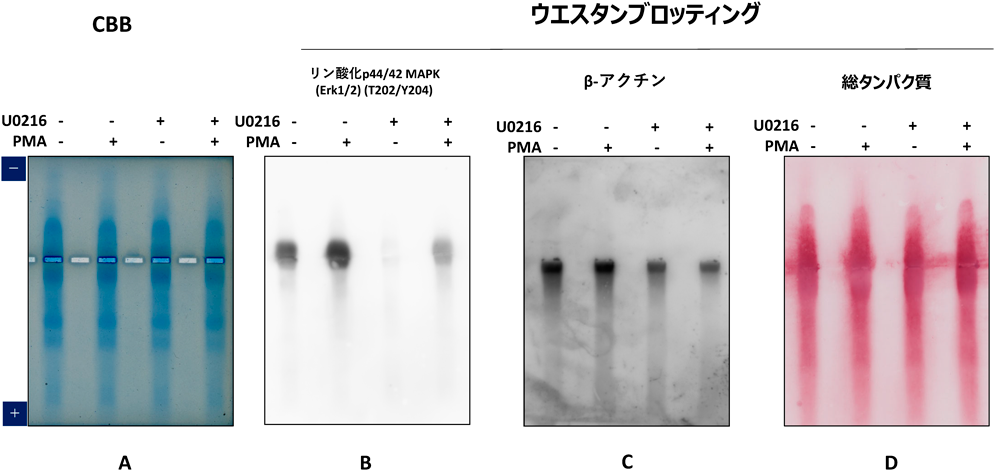
具体的には,株化ヒトBリンパ球細胞Ramos B細胞のMAPK経路であるリン酸化ERK1/2分子の検出を試みた.細胞は,細胞破砕液[83 mM sucrose, 6.6 mM imidazole-HCl(pH 7.0)]とビーズ破砕による温和な条件で回収し,続いて1%硫酸ストレプトマイシンを添加し遠心により除核酸し,ポリアニオンを除去した可溶性画分の細胞ライセートを調製した.この細胞ライセートをネイティブアガロースゲル電気泳動に供したところ,陰極側,陽極側双方にタンパク質が泳動され,細胞由来の核酸のアニオンによる電気泳動への影響を最小限に抑えられることを確認した.ネイティブアガロースゲルからのブロットの詳細な方法は,文献5に記載されている.抗リン酸化ERK1/2(T202/Y204)ウサギモノクローナル抗体(Abwiz Bio社製)を用いたウエスタンブロット解析からリン酸化ERK1/2がウエルよりもやや陰極側に検出された(図9).
ERK1/2は,pI=6.5, 41 kDaであり理論的なバンド位置と考えられた.また,ホルボール12-ミリスタート13-アセタート(PMA)刺激でシグナルが強くなり,MEK InhibitorであるU0216阻害でバンドが消失することも示された.PMAとU0216と同時に添加した場合,部分的に抑制された.内部標準のβ-アクチン(42 kDa, pI=5.29)は陽極側に検出され,均等にライセートが回収されていることも示された.面白いことにβ-アクチンは酸性かつ低分子量にもかかわらず,移動度がきわめて小さい.アクチンは細胞内では会合してフィラメントを形成すること,またアクチン結合タンパク質などの他分子と相互作用することが知られており,移動度の低下はそれを反映していることを示唆している.ネイティブアガロース電気泳動にてさまざまな荷電状態のタンパク質やオリゴマー状態の検出が可能であり,キナーゼ活性と細胞内シグナル伝達解析の新たな実験手法になるものと考えている.
我々はこの技術をさらに改良することを試みている.上記はすべてゲルを横にしたサブマリン型の方法であるが,縦型のアガロースゲルも作製することができる.アガロース溶液が注入可能な空のゲルカセットがいくつか市販されており,それぞれ特徴が異なるが,Thermo Fisher Scientific社のプラスチックカセットやATTO社のガラスカセットがアガロースゲルに適している.縦型では一方向のみの泳動しかできないが,非連続ゲルの作製が可能となる.本法の一つの問題は,市販のTris-Glycineのポリアクリルアミドゲルのようにバンドを濃縮することができないことである.現在,非連続ゲルでバンドの濃縮が可能か検討中である.また,より大きな分子集合が検出できればより応用範囲が広がることが期待できる.そのためには分子ふるい効果が異なるアガロースゲルが作製できること,また可溶性の分子集合モデルが必要で,それらの作製と分析を進めているところである.当然のことながらこの系では等電点が6.1付近の分子,あるいは分子集合体は泳動されない.今後,他の緩衝液についてもネイティブアガロース電気泳動が働くかどうか試す必要がある.
謝辞Acknowledgments
本検討は,米国Alliance Protein Laboratories, Abwiz Bio Inc.および日本の極東製薬工業株式会社の研究員により実施されたものであり,深く感謝いたします.
引用文献References
1) Kakuta, M., Yamazaki, T., Hayasaka, A., Hayashi, Y., & Arakawa, T. (2014) Stabilized antibody-containing preparations. EP1314437B1.
2) Li, C. & Arakawa, T. (2019) Agarose native gel electrophoresis of proteins. Int. J. Biol. Macromol., 140, 668–671.
3) Li, C., Akuta, T., Nakagawa, M., Sato, T., Shibata, T., Maruyama, T., Okumura, C.J., Kurosawa, Y., & Arakawa, T. (2020) Agarose native gel electrophoresis for characterization of antibodies. Int. J. Biol. Macromol., 151, 885–890.
4) Sakuma, C., Sato, T., Shibata, T., Nakagawa, M., Kurosawa, Y., Okumura, C.J., Maruyama, T., Arakawa, T., & Akuta, T. (2021) Western blotting analysis of proteins separated by agarose native gel electrophoresis. Int. J. Biol. Macromol., 166, 1106–1110.
5) Sakuma, C., Tomioka, Y., Li, C., Shibata, T., Nakagawa, M., Kurosawa, Y., Arakawa, T., & Akuta, T. (2021) Analysis of protein denaturation, aggregation and post-translational modification by agarose native gel electrophoresis. Int. J. Biol. Macromol., 172, 589–596.
6) 荒川力(2020)アガロースゲルを使ったネイティブ電気泳動法の開発.生物工学会誌,98, 274–276.
7) McLellan, T. (1982) Electrophoresis buffes for polyacrylamide gels at various pH. Anal. Biochem., 126, 94–99.
8) Legendre, J.M., Moineau, M.P., Menez, J.F., & Turzo, A. (1985) Rapid analysis of tranferrin-iron complexes by isoelectric focusing and and radioactive densimetry on gel. Pathol. Biol. (Paris), 33, 741–745.
9) Hovanessian, G. & Awdeh, Z.L. (1976) Gel isoelectric focusinf of human-serum transferrin. Eur. J. Biochem., 68, 333–338.
10) Battistuzzi, A.G. & Sola, M. (1992) Fe3+ binding to ovotranferrin in the presence of alpha-amino acids. Biochim. Biophys. Acta, 1118, 313–317.
11) Gottlieb, M. & Chavko, M. (1987) Silver staining of native and denatured eucaryotic DNA in agarose gels. Anal. Biochem., 165, 33–37.
著者紹介Author Profile
 荒川 力(あらかわ つとむ)
荒川 力(あらかわ つとむ)農学博士.
略歴1948年大阪生まれ.77年大阪府立大学農学部博士号取得.同年Brandeis大学ポストドクトラル.84年Amgen社入社.98年Alliance Protein Laboratories社設立.2020年退職.
研究テーマと抱負溶媒効果とタンパク質.タンパク質の分析.
趣味読書.散歩.旅行.
 芥 照夫(あくた てるお)
芥 照夫(あくた てるお)極東製薬工業株式会社抗体事業推進部部長.医学博士.
略歴1964年香川県に生まれる.88年神戸大学農学部卒業.90年京都大学大学院農学研究科修士課程修了.2003年大阪大学医学部博士号取得(論文博士).1990年田辺製薬株式会社応用生化学研究所研究員.2002年熊本大学医学部微生物学講座助手.05年バイオベンチャーを経て09年より現職.
研究テーマと抱負診断・研究に有用な抗原の調製や高感度な抗体の調製に関する研究を進めています.主に感染症の簡便な診断キットの開発を目指しています.
ウェブサイトhttps://www.kyokutoseiyaku.co.jp/research/home/
趣味ドライブ,ウオーキング,古事記の解釈本の読書やYouTubeをみること.