超硫黄分子に関する研究は,硫化水素(H2S)の生体内での機能に関する研究から始まっており,酸化数0の硫黄原子であるサルフェン硫黄(sulfane sulfur:S0)が結合したグルタチオン(GSH)やシステインなどの超硫黄分子の生理機能に関する研究へと発展してきている.このような研究の流れに呼応して,求められる研究ツールも変わってきた.とりわけ生きた細胞や組織でリアルタイムかつ高感度な含硫黄分子の検出を可能とする蛍光プローブを用いた方法が2010年ごろより注目され始め,これまでに数多くの蛍光プローブが開発されてきている1, 2).ここでいう蛍光プローブとは,標的とする含硫黄分子との反応前は蛍光を発さないが,特異的な標的含硫黄分子との反応によって蛍光性へと変化し,その発せられる蛍光によって,標的とする含硫黄分子の挙動を可視化することができる低分子化合物である.具体的な標的含硫黄分子はH2Sに始まったが,H2Sの生理機能の多くがサルフェン硫黄を含むシステインパースルフィドやグルタチオンパースルフィドなどの超硫黄分子によるものと報告されて以来3),それらの超硫黄分子を標的分子とする蛍光プローブの開発へと移行した.また,超硫黄分子を検出する蛍光プローブとしては,サルフェン硫黄自体の検出に始まり,システインパースルフィドやグルタチオンパースルフィドなどの求核性の高い超硫黄分子の検出へと,さらには,超硫黄分子を不可逆的にではなく可逆的に検出し,それら濃度変化を動的に検出できる蛍光プローブの開発へと変遷してきた1).現在では,超硫黄分子にとどまらず,二酸化硫黄(SO2)といった超硫黄分子の代謝物を検出する蛍光プローブの開発といった新たな流れもみられる4).
本稿では,このような活性の高い含硫黄生体分子の研究において,これまでに開発されてきたH2Sから超硫黄分子に至る含硫黄分子を標的とした蛍光プローブの開発について紹介する.これまでに数多くの蛍光プローブが開発されてきたが,とりわけ実際の生命科学研究に汎用されるに至っている蛍光プローブを中心に概説する.
H2Sは腐卵臭を有する毒性の高い気体として有名であるが,1989年,1990年にウシやヒト,ラットの脳内にH2Sが存在することが報告されて以来5, 6),H2Sが血管平滑筋の弛緩などの生理シグナルに関与していると報告され,一酸化窒素(NO),一酸化炭素(CO)に次ぐ,第三のガス性シグナル情報伝達物質として注目されてきた7).具体的には,H2Sは血管平滑筋,腸管平滑筋などの弛緩をもたらすことが報告されており8),また,神経細胞ではH2Sによる長期増強に対する効果があることから記憶の形成における関与が報告された9).さらには,抗炎症・細胞保護作用10, 11)やインスリンの分泌制御12)などにH2Sが関与しているという報告もある.このように,H2Sが薬理作用を示すことや,細胞内シグナル伝達に寄与していることが報告されているものの,H2Sの生体内での生理活性メカニズムについては不明な点が多く,その生理機能についても疑いの余地があった13).また,H2Sの検出方法としては,メチレンブルー法14)やガスクロマトグラフィー15),HS−選択的電極16),LC-MS17)などが用いられており,これら方法では生体内のH2Sを非侵襲的にリアルタイムに検出することは困難であった.このような点から,H2Sに関する研究をさらに発展させるために,H2Sを選択的に検出する蛍光プローブの開発が盛んに行われた1, 2).蛍光プローブを用いた蛍光イメージングは,生きた細胞や動物体内でのH2Sを簡便性かつ高い感度,高い時空間分解能で可視化することができるためである.2008年ノーベル化学賞にて「緑色蛍光タンパク質(GFP)の発見と開発」,2014年にノーベル化学賞にて「超解像度の蛍光顕微鏡の開発」が受賞対象になったことからも,近年の蛍光イメージング技術の重要性がうかがえる.以下に,開発されたH2Sを選択的に検出する蛍光プローブの中でも現在,生物学研究に汎用されているものについて,それらH2Sの検出メカニズムも含めて紹介する.
1)アジド基のH2Sによるアミノ基への還元反応を利用した蛍光プローブ
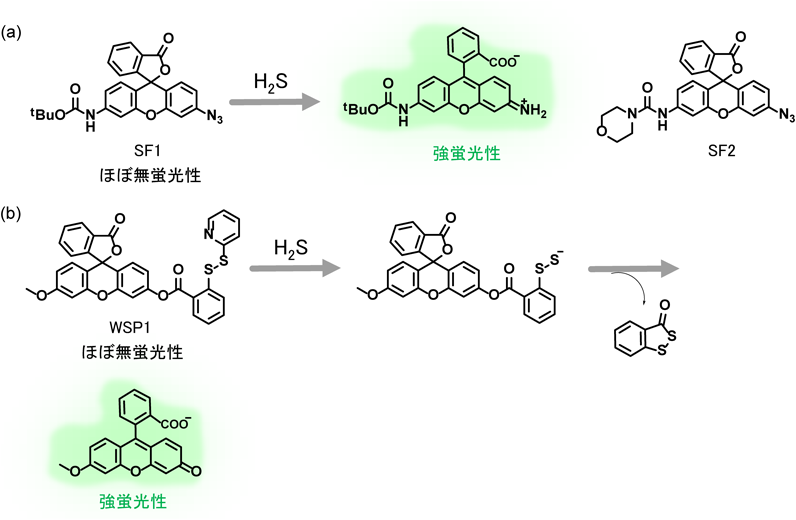
H2Sは還元性の高い分子であり,アジド基(–N3)をアミノ基(–NH2)へと還元することができる.この還元反応を利用することで,ChangらはH2S選択的な蛍光プローブであるSF1とSF2を開発することに成功した(図1a)18).これら蛍光プローブは,ローダミン蛍光色素のアミノ基をアジド基へと変換することで分子内環化を形成させ,プローブ分子を無蛍光性化している.10 µMのこれら蛍光プローブに,100 µMのNaHS(H2Sドナー)を加えると,SF1とSF2の分子内環化状態が解除され,それぞれ7倍および9倍の蛍光上昇を示した.また,これら蛍光プローブは活性酸素種や活性酸化窒素種とはほとんど反応せず,H2Sに高い選択性を示した.これら蛍光プローブは,アジド基を用いた最初のH2S選択的な蛍光プローブであり,本プローブが報告されて以後,数多くのアジド基を用いたH2S選択的な蛍光プローブが開発されている1, 2).
2)HS−の高い求核性を利用した蛍光プローブ
Xianらは,HS−による選択的なジスルフィド交換反応を利用することで,H2S選択的な蛍光プローブWSP1の開発に成功している(図1b)19).本プローブは,システインやGSHといった生体内のチオール分子存在下においてもH2Sへの選択性を付与するために,生体内チオール分子(RSH)と比較して,H2Sが無置換のチオール分子であることを利用した分子設計となっている.具体的には,HS−がまず始めに蛍光プローブ分子の求電子性部位に反応することでパースルフィド(R–S–S−)を持つ中間体を形成し,さらにこれが2段階目の求核反応によって分子内環化を起こし,蛍光色素部位が解放されることで強い蛍光を示す.なお,パースルフィド基(R–S–S–H)のpKa(=6.2)は通常のチオール基(pKa=7.6)よりも低く,高い求核性を示すこと20),また,分子内環化反応によって五員環構造を持つ分子が脱離することから,2段階目の反応は速やかにかつ非可逆的に進行する.システインやGSHなどの生体内チオール分子も,この蛍光プローブの求電子部位に対する1段階目の求核反応を起こすが,2段階目の分子内環化反応は進まないため,蛍光上昇は観察されない.このWSPシリーズは,WSP2–5までさまざまな誘導体が開発されている2).
3)Cu2+との錯体構造を利用した蛍光プローブ
著者らは,環状ポリアミンと銅(II)イオン(Cu2+)の錯体構造を利用して,H2Sを選択的に検出する蛍光プローブ,HSip-1(Hydrogen Sulfide imaging probe-1)の開発に成功した(図2a)21).Cu2+は,近傍の蛍光色素の蛍光を消光させ22),また,H2Sと反応して安定なCuS構造を形成することが知られている23).細胞内でH2Sを検出する際の最も大きな課題は,H2Sに対する選択性と感度である.細胞内にはチオール基を有する生体分子として,GSH(生体内存在濃度:約1–10 mM)やシステイン(約100 µM),システイン残基を含むタンパク質が存在し,蛍光プローブはこれらとは反応せず,H2Sに対してのみ反応する高い選択性を持つ必要がある.また,細胞内のH2S濃度は10 µM–1 mMのNa2S(H2Sドナー)の添加によって生理作用が起こるという報告から,少なくとも10 µMのH2Sを検出できる感度が必要であると考えた.そこで,10 mM GSHには応答せず,10 µM H2Sにすばやく応答する蛍光プローブの開発に取り組んだ.
蛍光プローブの分子設計として,Cu2+とそれをキレートする環状ポリアミン構造を有したフルオレセイン誘導体を設計・合成した.環状ポリアミン構造はCu2+とキレート効果により安定な錯体構造を形成することが知られている24).開発した蛍光プローブHSip-1の吸収・蛍光特性を測定した結果,490 nm付近に吸収極大波長を,515 nm付近に蛍光極大波長を示し,かつCu2+による強い消光によって蛍光が低く抑えられていた.次に,H2SおよびGSHへの応答性を評価した結果,HSip-1は10 mM GSHの添加ではほとんど蛍光上昇を示さず,100 µM Na2Sの添加によってのみ,迅速な蛍光上昇を示した(図2b).これら結果は,H2SとGSHのチオール基のpKaや分子のかさ高さの違い,環状ポリアミン構造とCu2+の安定度定数の高さに起因すると考えられた.また,HSip-1は1 mMシステインや1 mMホモシステイン,各種無機含硫化合物や活性酸素種,活性窒素種の添加によっても蛍光強度上昇を示さず,H2Sに対して高い選択性を示した(図2c).さらに,HSip-1の生細胞イメージングへの応用を行った.まずHSip-1に細胞膜透過性を付与するため,ジアセチル体であるHSip-1 DAを合成しHeLa細胞へと負荷し(図2d),その後,Na2Sを細胞外液に添加したところ,HSip-1は細胞質への局在を示し,添加したNa2Sの濃度依存的に蛍光強度の上昇を示した.このように,HSip-1を用いることで,細胞内においてもH2Sを選択的に可視化することに成功した.
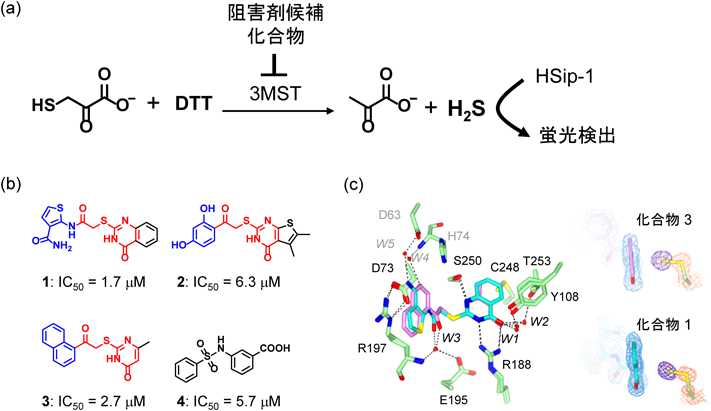
このような蛍光プローブは,蛍光イメージングへの応用にとどまらず,in vitroでの酵素アッセイにも有用である.たとえば,哺乳類の生体内でのH2S産生酵素として,cystathionine β-synthase(CBS)やcystathionine γ-lyase(CSE),3-mercaptopyruvate sulfurtransferase(3MST)が報告されているが1),3MSTの選択的阻害剤についてはこれまで報告されていなかった.そこで,HSip-1の持つH2Sに対する感度の高さと選択性の高さに着目して,HSip-1を用いた3MST阻害剤のハイスループットスクリーニング(high-throughput screening:HTS)を行った25).3MSTは,基質である3-mercaptopyruvate(3MP)と反応してピルビン酸を生成する過程で,タンパク質上の活性システイン残基がパースルフィド化される.また,このようなプロテインパースルフィドは,還元型のジチオスレイトール(dithiothreitol:DTT)を加えることで容易に還元され,H2Sを放出する.そこでまず,3MST, 3MP, DTTの三者存在下で産生されるH2Sをin vitroで検出する系の構築を行った(図3a).さらに,本系を用いて大規模HTS(約17万化合物)を行った結果,10 µMの化合物濃度でHSip-1の蛍光強度上昇を80–100%阻害する化合物を四つ得ることに成功した(図3b).そのうち,化合物1–3はAr–COCH2S-pyrimidoneの共通骨格を有しており,この構造が3MST阻害に重要であると考えられた.また,マウス3MSTを発現させたHEK293細胞のセルライセートを用いて,H2S産生の阻害活性を評価した結果,多くの夾雑物質の存在するセルライセート中においてもH2S産生を85–100%抑制した.さらに,CSE, CBSおよび3MSTと構造類似性(アミノ酸配列の相同性57.6%)を有するthiosulfate sulfurtransferaseに対する化合物3による阻害活性を評価した結果,化合物3は3MSTに高い選択性を示すことを明らかにした.また,3MST過剰発現細胞における細胞内の3MST活性を化合物3が阻害するようすを蛍光イメージングによって観察することができたことから,化合物3は十分な細胞膜透過性を持っていることがわかった.さらに,X線結晶解析および計算化学によって,化合物3の3MSTの阻害機構の解析を行った結果,3MSTの活性システイン残基に生成したパースルフィド(R–S–S−)のアニオン性と化合物のカチオン性部位とで強い静電的相互作用が形成されていることがわかった(図3c).このような相互作用による酵素の阻害メカニズムはこれまでに報告がなく,初めての例である.
HSip-1のその他の応用例として,ケージドH2SやH2S放出薬剤などのH2Sドナーによって産生された細胞内H2Sの検出26–28)や,システインジオキシゲナーゼ欠損マウス由来の肝細胞におけるシステインおよびその代謝物(H2S,チオ硫酸)の変化29),チオ硫酸による急性肺障害の緩和におけるH2Sの関与30)などを明らかにしている.
H2Sをはじめとして,生体内には反応性の高い硫黄含有分子が存在し,中でもサルフェン硫黄(S0)はその反応性の高さからも重要な生体内活性硫黄分子の一つであるといえる.これらサルフェン硫黄は,細胞や体内ではグルタチオンやシステインのチオール基に可逆的に付加して存在する(図4a)13).このようなサルフェン硫黄が付加したグルタチオンやシステインといった超硫黄分子は,シグナル伝達やレドックス制御などさまざまな生理機能に関与することが近年盛んに報告されている3).サルフェン硫黄の生体内での機能解明において,その検出法の開発はきわめて重要であり,さらに蛍光イメージング法を用いることで,高い時空間分解能で生体サンプルにてサルフェン硫黄をリアルタイムに検出することができる.これまでにサルフェン硫黄を検出する多数の蛍光プローブが開発されているが1, 2),生命科学研究に用いられている代表的なサルフェン硫黄を検出する蛍光プローブとして,サルフェン硫黄の求電子性を利用したSSP類31)とSSip-132)の二つの蛍光プローブがあげられる.以下にそれぞれの蛍光プローブについて,その特徴を記す.
1)SSP類
Xianらは,これまでにサルフェン硫黄自体を検出する蛍光プローブ群であるSSP類の開発に成功している(図4b)31).SSP類のサルフェン硫黄との反応による発蛍光メカニズムとしては,まず,プローブ分子のチオール基が求電子性のサルフェン硫黄に求核反応を起こすことで,サルフェン硫黄がプローブ分子に受け渡され,パースルフィド(R–S–S−)が生成する.次に,求核性の高いパースルフィド基が分子内のエステルに求核攻撃することで環化し,五員環構造を持つ分子が脱離することによって,蛍光色素部位の解放に伴う大きな蛍光上昇を示す.
2)SSip-1
SSP類の蛍光変化は不可逆的な化学反応に基づくものであるため,細胞内サルフェン硫黄の動的な濃度変動を観察することは難しかった.そこで著者らは,生体内のサルフェン硫黄を可逆的に検出できる新たな蛍光プローブの開発を行った.プローブの分子設計において,チオールとサルフェン硫黄の可逆的な結合に着目し,分子内のスピロ環化平衡とFӧrster resonance energy transfer(FRET)機構を利用した蛍光上昇型のサルフェン硫黄を検出する蛍光プローブ(SSip-1)を開発した(図4c)32).具体的には,プローブ分子内のベンゼン環2位のチオール基がサルフェン硫黄と反応することでパースルフィドを形成し,さらにそのパースルフィド基の高い求核性によって分子内スピロ環化を引き起こすことでFRETアクセプター部位の可視光吸収が消失し,FRETドナー部位に由来する蛍光強度の上昇を示す分子設計となっている.また,一度上昇した蛍光強度は,5 mMの還元型GSHの添加によって時間経過とともに減少したことから,細胞内に存在するmMレベルのGSHにより,サルフェン硫黄を可逆的に蛍光イメージング可能であることが示唆された.また,本蛍光プローブは生体内のチオール類やH2Sとは反応せず,サルフェン硫黄に高い選択性を示した(図4d).
さらに,SSip-1を細胞に応用するために,細胞膜透過性を持たせたSSip-1 DAを設計・合成した(図4e).まず,A549細胞を用いた蛍光イメージングを行った結果,Na2S4(サルフェン硫黄ドナー)の添加前ではほとんど蛍光が観察されなかったのに対し,細胞外液にNa2S4を添加したところ1分以内に蛍光上昇が観察された.また,Na2S4の繰り返し添加によって,蛍光の上昇・減少を繰り返し観察することに成功した.これら結果から,SSip-1は生細胞中においても可逆的にサルフェン硫黄を検出可能であり,その濃度の変動を観察できることがわかった.次に,初代培養細胞での蛍光イメージングへと応用した.SSip-1 DAを用いて,ラットの初代培養アストロサイトにおけるTRPA1チャネルの活性化と細胞内サルフェン硫黄の濃度変化の関係を調べたところ,アストロサイトの細胞内サルフェン硫黄の濃度と,TRPA1チャネルの活性化によるCa2+の細胞内流入には強い相関があることがわかった.さらに,本プローブを活用することによって,神経細胞におけるポリスルフィドの生成機構33)やN-アセチルシステインの抗酸化作用のメカニズムの解明34)に成功した.
4. 生体内硫黄分子の代謝物を検出する蛍光プローブ
超硫黄分子の生体内でのダイナミクスを包括的に理解するためには,各種超硫黄分子はもちろんのこと,チオ硫酸イオン(S2O32−),亜硫酸イオン(SO32−)および硫酸イオン(SO42−)などの生体内硫黄分子の代謝物も可視化することは重要である.このような背景から,近年,超硫黄分子の代謝物の一つであるSO2を検出する蛍光プローブが開発されている4).SO2は,水溶液中ではHSO3−/SO32−として存在し,哺乳類の体内においては,L-システインからの酵素による代謝や,H2Sの酸化,チオ硫酸の還元によって生成することが報告されている35, 36).また,SO2自体も硫酸イオンに酸化され,最終的には尿中に排泄されると報告されている37).
HSO3−/SO32−を検出する蛍光プローブとしては,それら分子の高い求核性を利用した蛍光プローブが報告されている4, 36).たとえば,HSO3−/SO32−の求核反応によるレブリン酸エステルの脱保護反応があげられる(図5a).蛍光色素骨格にフェノール基を持ち,かつ,そのフェノール基がエステル化および脱保護によって,大きく蛍光変化を示す場合は,レブリン酸を結合させることで,蛍光プローブが開発されている38).レブリン酸エステル部位がHSO3−/SO32−との反応後に,五員環構造を形成し,蛍光色素部位から放出されるとともに,蛍光が発せられる.このようにして開発された蛍光プローブを用いて,生細胞内でのSO2の蛍光イメージングに成功している.もう一つの代表的な分子設計としては,HSO3−/SO32−によるマイケル付加反応を利用した蛍光プローブが開発されている(図5b).C=Cに隣接した電子吸引性基を導入することで,HSO3−/SO32−によるマイケル付加反応を起こすことができる39).このような求核反応によって,蛍光色素部位に関わる共鳴系が短縮され,蛍光上昇が生じる.また,アルデヒド基へのHSO3−/SO32−の求核反応による蛍光プローブの開発も行われている(図5c).この蛍光プローブの分子設計の場合,蛍光色素部位の発蛍光機構が,分子内電荷移動(intramolecular charge transfer:ITC)となる場合,HSO3−/SO32−の求核反応によりアルデヒド基の電子吸引性の強さが変化することで,蛍光強度を変化させている40).以上のような分子設計によって,数多くのSO2の検出蛍光プローブが報告されているが4),広く生命科学研究に用いられている蛍光プローブは存在しておらず,今後の課題である.