活性酸素種(reactive oxygen species:ROS)や活性酸化窒素種(reactive nitrogen oxide species:RNS)はこれまで,生体分子と非特異的に反応し,不可逆的な酸化的損傷をもたらし,さまざまな疾患に関与する有害物質であると考えられてきた(ROS毒性説).しかし近年,ROS/RNSは生理条件下においても産生され,その下流で生体内親電子性物質[8-ニトログアノシン-環状一リン酸(8-nitro-cGMP)やニトロ化脂肪酸など]の生成を介して,シグナル分子として機能しているという新たな概念「ROS/RNSレドックスシグナル説」が提唱されるようになってきた.筆者らは,ROS/RNSレドックスシグナルのセカンドメッセンジャーである8-nitro-cGMPの代謝機構を解析する過程で,システイン(cysteine:CysSH)のチオール(SH)基に過剰な硫黄原子が付加されたシステインパースルフィド(cysteine persulfide:CysSSH)などの超硫黄分子が,8-nitro-cGMPを8-SH-cGMPに変換することで,そのシグナルを制御していることを見いだした1, 2).CysSSHは,通常のCysSHに一つの硫黄原子が付加しただけだが,隣接する硫黄原子の不対電子の作用(α効果)により,CysSHよりも還元力や求核性が著しく高まり,強力な抗酸化活性およびレドックスシグナル制御活性を示す3, 4).また,超硫黄分子のサルフェン硫黄(sulfane sulfur:S0,酸化数0の硫黄原子)は,別分子内のSH基へと容易に受け渡されること(硫黄転移反応)が知られている4).そのため,超硫黄分子はCysSSHやグルタチオンパースルフィド(GSSH)以外に,硫黄原子が複数連結したポリスルフィド[RS-(S)n-H]などの多様な分子形態で生体内に豊富に(mmolオーダー)存在することが明らかにされている2, 5–8).さらに,超硫黄分子は,低分子だけでなく,タンパク質システイン残基上にも存在すること(タンパク質ポリスルフィド)が知られ,SH基の不可逆的な酸化修飾による損傷と劣化に対して保護的に働く他,タンパク質構造維持や酵素活性制御に寄与していることが明らかにされてきている9–11).また,最近,システイニルtRNA合成酵素(cysteinyl-tRNA synthetase:CARS)が超硫黄分子産生活性を持ち,生体内における超硫黄分子生成の主要酵素として機能していることが明らかになった5).CARSは大腸菌などの原核生物から,哺乳動物を含む真核生物まで種横断的に発現している酵素であり,超硫黄分子が生物普遍的に生体内に豊富に存在していることが示されている5, 12).さらに,哺乳動物細胞において,超硫黄分子がミトコンドリア内で産生され,ミトコンドリアの品質管理やエネルギー代謝(哺乳細胞における新規硫黄呼吸)制御に関与していることなどの新たな知見も得られてきている5).このように,多様な存在様式を持ち,多彩な細胞機能に関与する超硫黄分子の生理機能の実態を解析するためには,そのユニークな化学特性を理解した上で,適切な解析系を用いる必要がある.本稿では,超硫黄分子の化学特性および解析方法について,筆者らの最近の知見を紹介する.
超硫黄分子は分子内に存在するサルフェン硫黄によって,対応するチオール化合物のpKa値と比べ,そのpKa値が低くなることが報告されている13–16).たとえば,グルタチオン(glutathione:GSH)のpKa値が8.9であるのに対して,GSSHのpKa値は6.9である17).すなわち,生理的pH条件下において,GSHは主にプロトン化状態(GSH)で存在する一方で,GSSHの大部分は脱プロトン化状態(GSS−)で存在し,強力な求核性(還元力)を示していると考えられる.実際,CysSSHやGSSHなどは高い求核性を示すため,酸化物質を効率的に除去することが明らかにされている2).グルタチオンレダクターゼは酸化型グルタチオントリスルフィド(oxidized glutathione trisulfide:GS-S-SG)を基質にGSSHを生成することが知られ,この酵素反応液で過酸化水素(hydrogen peroxide:H2O2)を処理すると,H2O2の著しい分解が認められる一方で,グルタチオンジスルフィド(glutathione disulfide:GS-SG)を基質にした酵素反応液ではH2O2の有意な分解は観察されなかった2).また,生理的pH条件下(pH 7.4)において,GSSHは硫化水素(hydrogen sulfide:H2S)よりもH2O2に対して50倍反応性が高いことが報告されている17).これらの結果から,生体内において,GSSHなどの超硫黄分子は,チオール化合物よりも重要な抗酸化分子として機能しており,酸化ストレスに対する細胞保護に寄与していることが予想される.
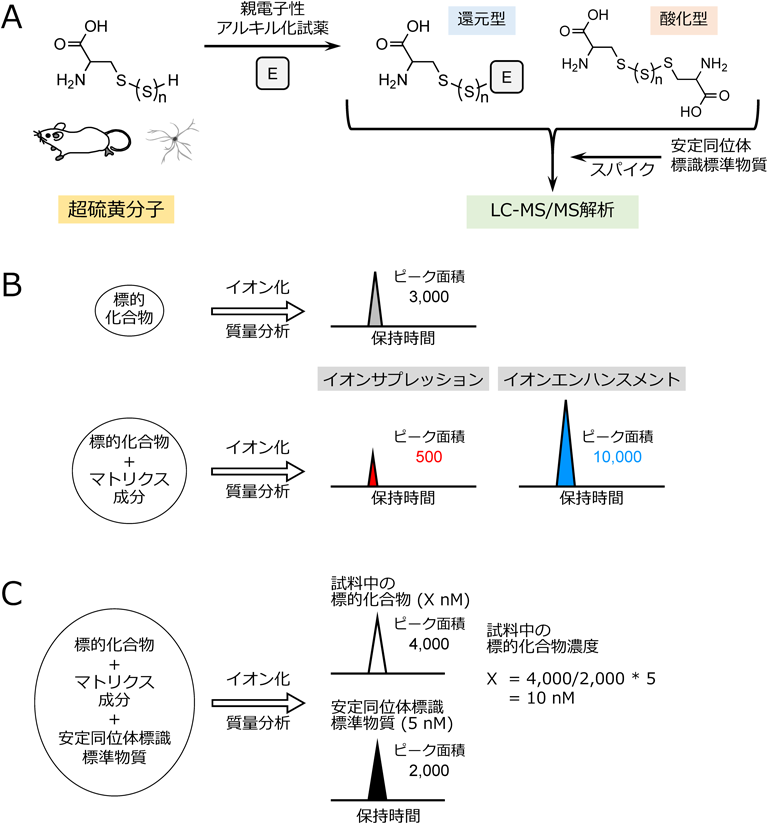
上述のとおり,GSSHなどの還元型の超硫黄分子は非常に高い求核性を持つことから,試料調製の過程で容易に酸化され,そのままの形で直接検出することはきわめて困難である.筆者らはこれまでに,親電子性アルキル化試薬を用いてCysSSHやGSSHなどの還元型超硫黄分子を安定な誘導体へと変換した後,高速液体クロマトグラフィー-三連四重極型質量分析装置(liquid chromatography triple quadrupole mass spectrometry:LC-MS/MS)を用い,多重反応モニタリング(multiple reaction monitoring:MRM)法にて標的の超硫黄分子を選択的かつ網羅的に検出する解析系(ポリスルフィドメタボローム解析系)を確立してきた(図1A)2, 5).質量分析装置を用いて,複数の試料間でさまざまな標的物質のシグナルを比較する場合,夾雑物の存在によるイオンサプレッションやイオンエンハンスメントなどによりシグナル強度が変化するので,生データを直接比較することで定量的に解析することは困難である(図1B).そこで,このような問題を回避するために,化学的性質は同じで分子量の異なる安定同位体標識標準物質を用いる.LC-MS/MS解析時に濃度既知の標準物質を内部標準として添加し,標準物質由来のシグナルと内因性のシグナルを比較することで定量的な解析が可能となる(安定同位体希釈法,図1C).GS-S-SGなどの酸化型超硫黄分子は,比較的安定であるため,生体試料から抽出し,そのまま直接LC-MS/MSで検出することが可能である.
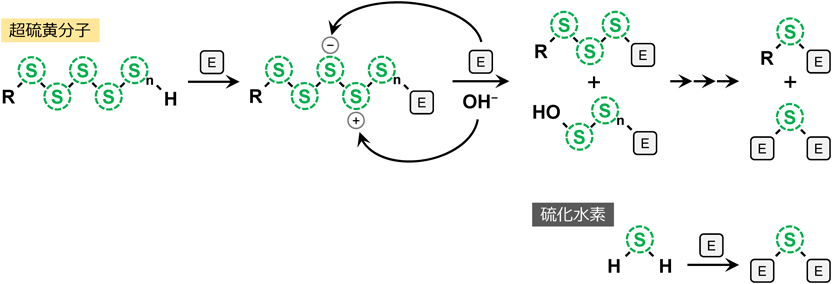
上述のとおり,ポリスルフィドメタボローム解析を行う上で,還元型超硫黄分子は親電子性アルキル化試薬を用いて末端のSH基を標識し,安定な誘導体にする必要がある.しかしながら,SH基標識試薬として一般に知られている,N-エチルマレイミド(NEM)やモノブロモビマン(monobromobimane:MBB)などの強力な親電子性を持つアルキル化試薬は,ポリスルフィド構造末端のSH基と反応する一方で,同時にポリスルフィド構造を著しく分解し,種々の分解産物を生成することが明らかになっている(図2)5, 18, 19).一方で,ヨードアセトアミド(IAM)は超硫黄分子の分解が比較的穏やかである5, 19).このように,超硫黄分子分解の度合いは,使用する標識試薬の種類(親電子性が高いほど増大)や,反応温度・時間・pH,還元剤の有無によって変動する5, 18, 19).また,親電子性アルキル化試薬による超硫黄分子の分解生成物の一種であるS-二量体は,H2Sと親電子性アルキル化試薬が直接反応した際に生じる産物とまったく同一の分子であるため,生体試料のようなH2Sと超硫黄分子が混在する場合に,そのシグナルがH2Sに由来するのか,超硫黄分子の分解に由来するのかを判別することはできない.そのため,超硫黄分子の分解を抑制するアルキル化試薬を用いることがポリスルフィドメタボローム解析を行う上で必須である.
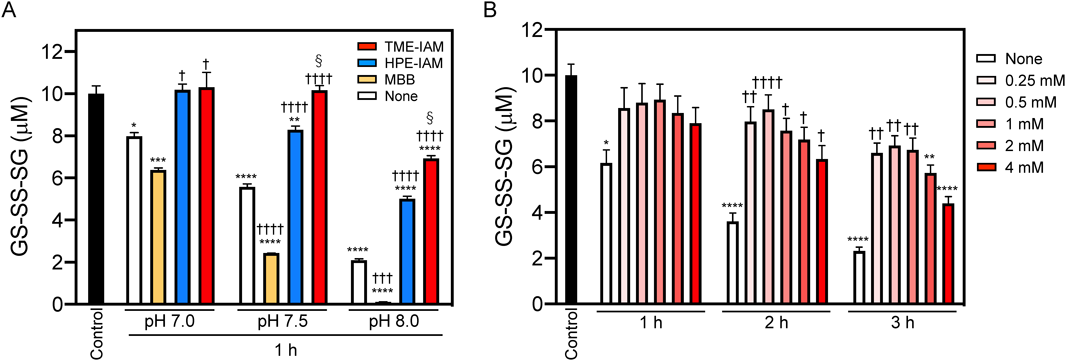
超硫黄分子のモデル化合物として酸化型グルタチオンテトラスルフィド(oxidized glutathione tetrasulfide:GS-SS-SG)を用いて,その安定性を検討した結果,GS-SS-SGはリン酸バッファー(pH 7.0)中でインキュベートすることにより単独で分解することがわかった19).この分解は,アルカリ条件でより顕著になることから,水酸化物イオン(OH−)がポリスルフィド構造の分解に寄与していることが考えられている.さらに,反応液中に親電子性アルキル化試薬を共存させ,種々の親電子性アルキル化試薬が超硫黄分子の安定性に及ぼす影響を検討した結果,親電子性の高いMBBやNEMはGS-SS-SGの分解を促進する一方で,親電子性の低いIAMはGS-SS-SGの分解が比較的穏やかであることがわかった19).大変興味深いことに,IAMの誘導体であるβ-(4-hydroxyphenyl)ethyl iodoacetamide(HPE-IAM)を添加したサンプルでは,GS-SS-SGの分解の著しい抑制が認められた19).HPE-IAMは,IAMにヒドロキシフェニル-エチル基が付加した構造をしているため,ヒドロキシフェニル基がポリスルフィドの安定化に関与している可能性が予想された.そこで,ヒドロキシフェニル基を持つ化合物であるチロシンについても,そのポリスルフィドの安定化効果を検討した.その結果,チロシン濃度依存的にGS-SS-SGの分解を抑制し,10 mMでほぼ完全なGS-SS-SGの分解抑制効果が認められた19).さらに,チロシンを共存させた場合,前述の親電子性アルキル化試薬によるGS-SS-SGの分解も抑制されることがわかった19).これらの結果から,GS-SS-SGの分解は,OH−によるポリスルフィド構造への攻撃を起点としており,チロシンまたはHPE-IAMのヒドロキシフェニル基はOH−によるポリスルフィド構造への攻撃を競合阻害することによって,GS-SS-SG安定化効果を示していることが予想された.
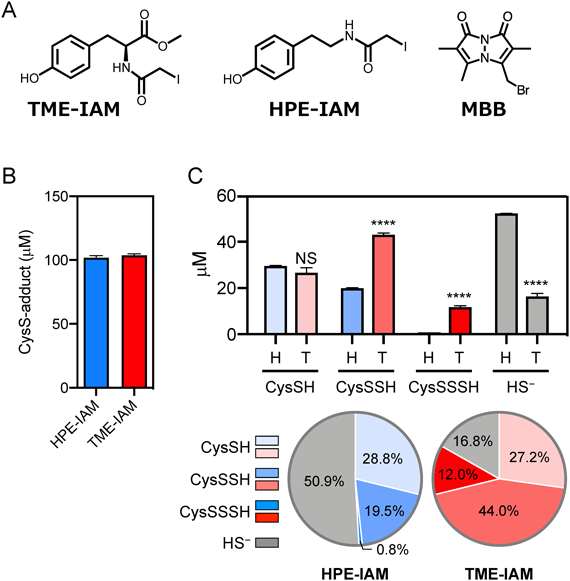
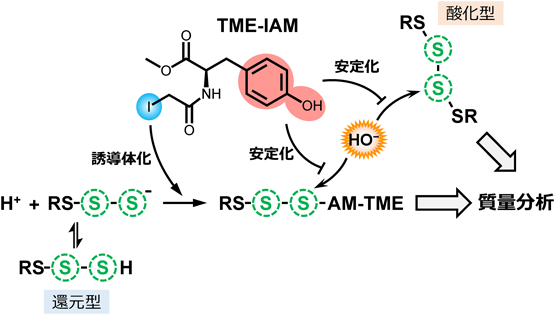
上述のとおり,MBBなどの親電子性アルキル化試薬と比較して,HPE-IAMは超硫黄分子の分解効果の低い親電子性アルキル化試薬である.しかしながら,超硫黄分子の分解を完全に抑制することはできない.そこで,チロシンの超硫黄分子安定化作用に注目し,チロシン誘導体を用いて,より超硫黄分子分解抑制効果を持つ新規の親電子性アルキル化試薬の合成を試みた.その結果,新規アルキル化試薬N-iodoacetyl L-tyrosine methyl ester(TME-IAM)の合成に成功した(図3A)20).TME-IAMのチオール化合物(CysSH)との反応性はHPE-IAMと同等である(図3B).一方で,還元型システインポリスルフィド[CysS-(S)n-H]との反応性を解析した結果,TME-IAMを用いた場合,CysSSHやシステイントリスルフィド(cysteine trisulfide:CysSSSH)の量は,HPE-IAMを使用した場合と比べ大幅に多かったのに対し,H2SおよびCysS-(S)n-Hの分解生成物であるS-二量体の量はHPE-IAMを使用した場合より有意に低かった(図3C)20).これらの結果は,TME-IAMは,分子内のIAM基を介して還元型超硫黄分子のSH基と反応して安定な誘導体を形成する一方で,ヒドロキシフェニル基によってポリスルフィド構造の加水分解を阻害することによって超硫黄分子を安定化することを示唆している(図4).
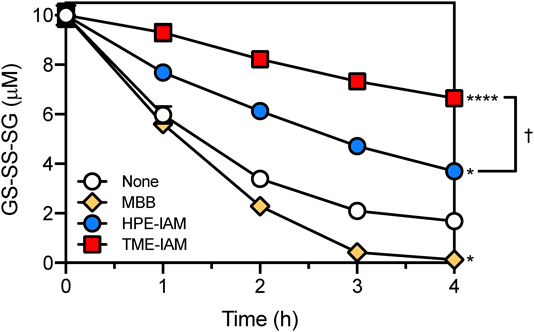
次に,GS-SS-SGをモデル化合物として用いて,TME-IAMの酸化型超硫黄分子分解抑制効果を検討した(図5).上述のとおり,GS-SS-SG(10 µM)をリン酸バッファー(pH 7.0)中でインキュベートすると容易に分解され,強力な親電子性アルキル化試薬であるMBBはその分解を促進した.一方で,HPE-IAMまたはTME-IAMが共存した場合,GS-SS-SGの分解の有意な抑制がみられ,TME-IAMで最も顕著なGS-SS-SG分解抑制効果が認められた20).驚くことに,37°Cで1時間インキュベートした場合もTME-IAM存在下ではGS-SS-SGの有意な分解は観察されず,4時間後においてもGS-SS-SGの約70%が残っていた.4時間インキュベートした際のGS-SS-SGの分解生成物を分析したところ,TME-IAMおよびHPE-IAM存在下では,GS-SS-SGの分解に由来する還元型グルタチオンポリスルフィドはほぼ検出されず,GS-S-SGとGS-SGが検出された20).この結果から,TME-IAMは,強力にポリスルフィド構造を保護する作用を持つことが示され,生体試料から還元型および酸化型超硫黄分子を網羅的に検出する上で非常に有効な検出試薬となりうることが予想された(図4).
超硫黄分子の分解は,アルキル化試薬の種類や濃度,バッファーのpH,およびインキュベーション時間に依存して増加することがわかっている5, 19).そこで,TME-IAMのGS-SS-SG安定化効果に対するバッファーpHの影響を解析した(図6A)20).アルキル化試薬の非存在下でも,バッファーpH依存的にGS-SS-SGは大幅に分解され,MBBが共存するとさらにその分解が促進された.一方で,TME-IAMが共存した場合,pH 7.5でもGS-SS-SGの有意な分解は観察されず,pH 8.0においてもHPE-IAMよりも高いGS-SS-SG分解抑制効果を示すことがわかった.先行研究の結果から,GS-SS-SG濃度に対して,アルキル化試薬の相対濃度が高まるにつれ,分解速度が増加することがわかっている19).そこで,TME-IAMとGS-SS-SGをさまざまなモル比で反応させ,GS-SS-SGの分解抑制への影響を検討したところ,GS-SS-SG濃度の400倍のTME-IAM存在下で1時間インキュベートした場合でも,GS-SS-SGの有意な減少は認められなかった(図6B)20).
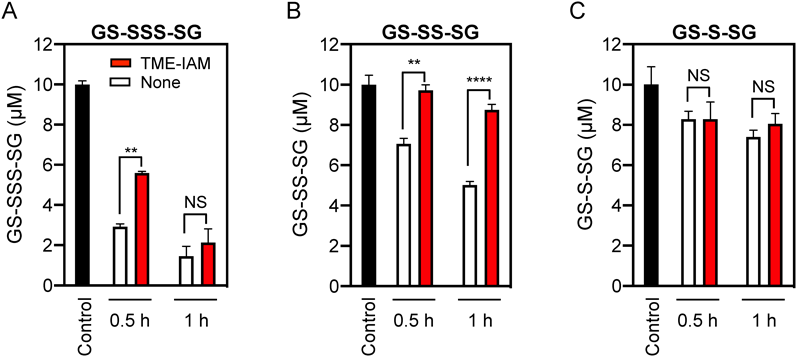
前述したとおり,CysSSHは,CysSHよりも高い反応性を示すことが知られている3, 4).また,酸化型超硫黄分子も同様に,GS-SS-SGは,GS-S-SGよりもバッファーpHによるアルカリ分解や親電子物質による分解に対して脆弱であることが示されている19).そこで,酸化型グルタチオンペンタスルフィド(oxidized glutathione pentasulfide:GS-SSS-SG)を用いて,より反応性の高い超硫黄分子に対するTME-IAMの保護効果を検討した(図7)20).その結果,TME-IAMの有無にかかわらず,GS-SSS-SGは検討した酸化型グルタチオンポリスルフィドの中で最も脆弱な化合物であり,TME-IAMの非存在下でpH 7.0で30分間のインキュベーションで容易に分解されたのに対し,TME-IAMはGS-SSS-SG分解の部分的な抑制が認められた(図7A).しかしながら,より長いインキュベーション(1時間)では,TME-IAMの存在下においてもGS-SSS-SG分解の有意な抑制は認められなかった.GS-SS-SGはTME-IAM存在下において1時間インキュベート後も有意な分解はみられない一方で,GS-S-SGはTME-IAMの非存在下または存在下どちらにおいても1時間のインキュベーションによる有意な分解は観察されなかった(図7B, C).また,TME-IAMがpH 7.0のリン酸バッファー中でGS-SGとも反応しないことを確認している.
5. TME-IAMを用いた生体試料からの超硫黄分子の検出
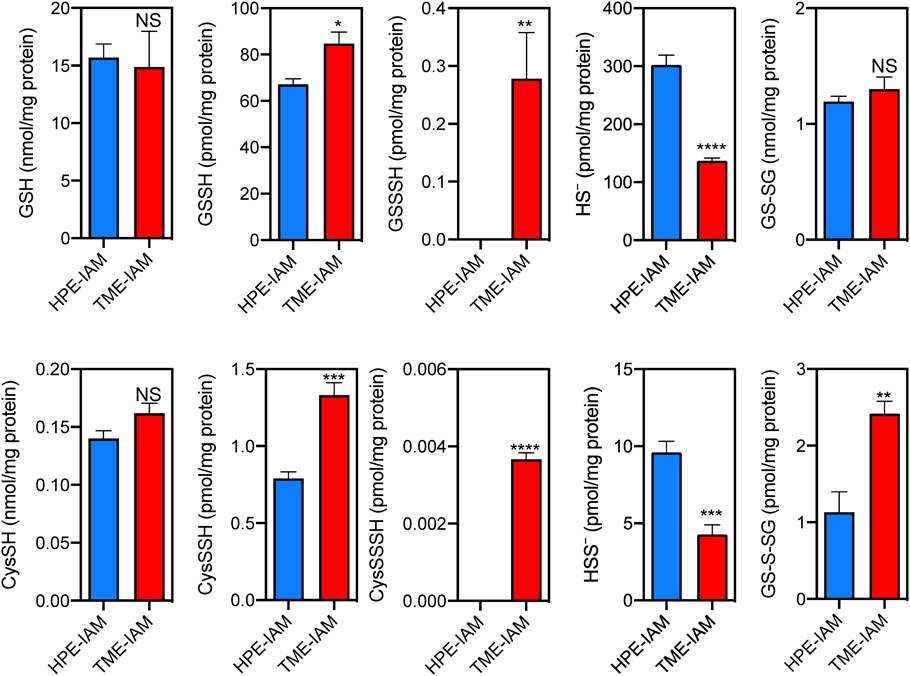
上述のとおり,TME-IAMは既存の親電子性アルキル化試薬と同等のSH基反応性を有する一方で,分子内のヒドロキシフェニル基に由来する高い超硫黄分子分解抑制効果を持つことが示されたことから,ポリスルフィドメタボローム解析の有効な検出ツールであることが示唆された.そこで,TME-IAMとHPE-IAMをそれぞれ検出試薬に用いて,マウス肝臓組織内の超硫黄分子を定量的に検出した(図8)20).その結果,CysSSSH, CysSSH,グルタチオントリスルフィド(glutathione trisulfide:GSSSH),およびGSSHの量は,HPE-IAMを用いた群と比べ,TME-IAMを使用した群において有意に多く検出される一方で,CysSHとGSHのレベルに両群間で有意な差はみられなかった.また,興味深いことに,HPE-IAMを使用した群では,H2Sおよび超硫黄分子の分解に由来するS-二量体の量はTME-IAM群の約2倍高かった.同様に,超硫黄分子の分解生成物と考えられるSS-二量体についてもHPE-IAM群で有意に高い量が検出された.酸化型超硫黄分子であるGS-S-SGにおいても同様に,TME-IAM群でHPE-IAM群よりも大幅に高い値が検出された.一方で,GS-SG量は両群で有意な差はなかった.マウス脳組織を用いた解析においても同様のプロファイルが示されている20).これらの結果から,TME-IAMは生体試料を用いたポリスルフィドメタボローム解析においても有効な検出ツールであることが示された.
本稿では,主に低分子量超硫黄分子の検出に関する,筆者らの最新の知見を紹介した.超硫黄分子は低分子だけでなく,タンパク質システイン残基上にも存在することが明らかにされている.これまでに,簡便なタンパク質ポリスルフィドの検出方法として,シアン化物と超硫黄分子内のサルフェン硫黄と選択的に反応(シアノライシス反応)する性質を利用した,シアノ-ビオチンタグスイッチアッセイ2)や,biotin-polyethylene glycol-conjugated maleimide(biotin-PEG-MAL)と種々の親電子性物質を用いることで,SDS-PAGEでの移動度の変化からポリスルフィド化システイン残基数を確認することができるbiotin-PEG-MAL labeling gel shift assay(PMSA)法などが開発されている5, 21).同様の原理に基づいて,iodoacetyl-PEG-biotinを用いたポリスルフィド化タンパク質検出法が,ハンガリー国立腫瘍学研究所のNagyらのグループにより報告されている22).しかしながら,上述したとおり,マレイミドなどの親電子性の高いアルキル化試薬を用いた場合,試料調製中にポリスルフィド構造の分解が生じてしまうため,ポリスルフィド化タンパク質の実態を検出することは非常に困難である.本稿で紹介した新規アルキル化試薬TME-IAMは,タンパク質ポリスルフィドを分解することなく,誘導体化することが可能であることから,タンパク質ポリスルフィドの解析にも有効であると考えられる.現在,筆者らは,TME-IAMと質量分析装置を組み合わせた新たな超硫黄分子検出系の構築に取り組み,これまでに検出が困難であった酸化型のタンパク質ポリスルフィドの検出に成功している(未発表データ).また,本稿で紹介した質量分析装置を用いた解析方法の他に,さまざまな蛍光試薬を用いた検出法や,表面増強ラマンイメージングによる超硫黄分子検出系がさまざまな研究グループから多数報告されてきている.2014年に超硫黄分子の酵素的な生体内生成が初めて報告されてから数年のうちに,これまでの生物学的な概念を覆すような大発見が多数なされている.今後,超硫黄分子に注目した研究分野は,タンパク質科学,ケミカルバイオロジー,レドックスバイオロジー,エネルギー代謝,分子生物学,細胞生物学,各種疾病の分子病態論,食品科学など,基礎生物学から医学・臨床科学など多彩な分野へ革新的な波及効果をもたらすことが予想される.