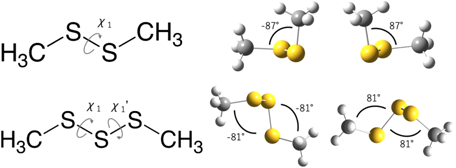
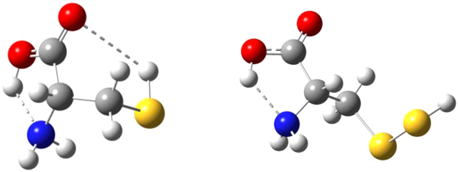
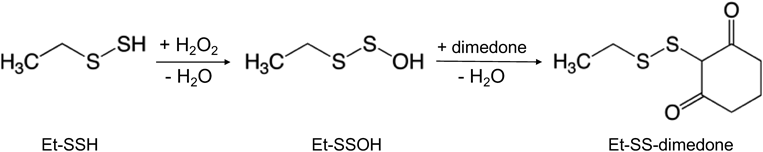
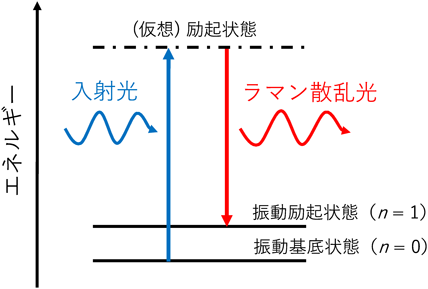
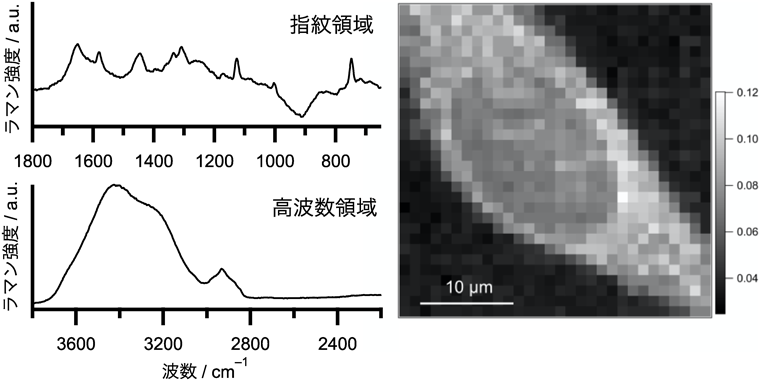
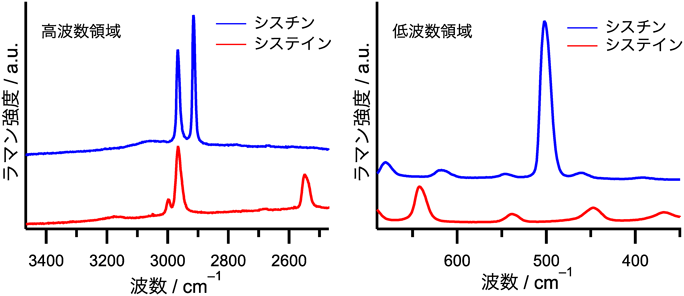
量子化学計算・ラマン分光法を用いた硫黄化合物の構造解析の動向Trends in the structural analysis of sulfur compounds using quantum chemical calculations and Raman spectroscopy
東北大学大学院薬学研究科Graduate School of Pharmaceutical Sciences, Tohoku University ◇ 〒980–8578 仙台市青葉区荒巻字青葉6–3 ◇ 6–3 Aoba, Aramaki, Aoba-ku, Sendai 980–8578, Japan