ヒト血清アルブミン(human serum albumin:HSA)は,ビタミンD結合タンパク質やα-フェトプロテインと同類のアルブミンスーパーファミリーに属する.また,HSAは,585個のアミノ酸残基からなる約66.5 kDaの単純タンパク質として知られており,35個のシステイン(Cys)残基を有する.これらCys残基は,唯一の遊離型Cys残基である34Cysを除いた34残基によって17対のCys–Cys架橋構造を形成している.この高度なCys–Cys架橋構造は,九つのループ構築やHSAの構造安定化に大きく寄与している.また,HSAのX線結晶構造解析の結果より,HSAは三つの相同性の高いαへリックス構造に富んだドメインI, IIおよびIIIから構成され,さらにサブドメインAとBに大別されている.このHSAの生理機能としては,膠質浸透圧の維持作用やリガンド結合作用,抗酸化作用,エステラーゼ様作用などが古くから知られており,多機能性タンパク質として名高い.すでにリガンド結合作用については,Sudlowらが提唱した二つのリガンド結合サイトSite I(ワルファリン結合サイト)およびSite II(インドール,ベンゾジアゼピン結合サイト)が,それぞれサブドメインIIAおよびIIIAに位置することが明らかにされている.一方で,抗酸化作用については,HSAの唯一の遊離型Cys残基である34Cysの寄与が多数報告されているものの,34Cys変異体C34AにおいてもHSAの抗酸化作用を完全に消失しないことから,他の残基の関与も示唆されている1).加えて,392Cysと438CysのCys–Cys架橋構造は,酸化還元反応を触媒すること2)や,558Cysと567CysのCys–Cys架橋構造は,シアンと反応すること3)などが報告されており,HSAのいくつかのCys–Cys架橋構造には,酸化還元(レドックス)制御機構が備わっているのではないかとささやかれていた.しかしながら通常のジスルフィド結合であれば抗酸化能を有するとは考えにくい.そこで我々は,そのレドックス制御機構に「酸化型ポリスルフィド結合(酸化型超硫黄)」が含まれるのではないかと突飛な仮説を立てた.しかしながら,その当時,「酸化型」超硫黄を測定する方法が皆無であったため,まずは測定方法の確立を行う必要があった.
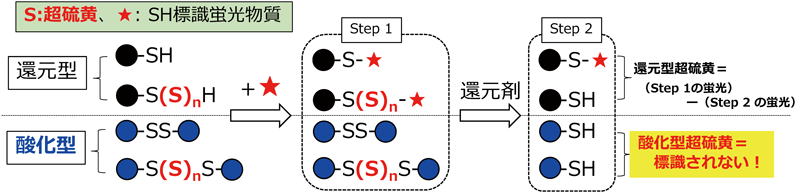
これまでに報告されている一般的なポリスルフィドの定量法としては,アルキル化還元法4),蛍光プローブ法5),シアン(CN)法6)などが報告されている.アルキル化還元法は,SH基およびSSH基をヨードアセトアミドやS-メチルメタンチオスルホナートなどのアルキル化剤で修飾し(Step 1),その後還元処理を行う(Step 2)という方法である.SHはアルキル化されると還元されないが,SSH基はアルキル化されても還元剤によりSHに還元される.つまり,SSH基に付加していたアルキル化剤のみが還元剤による還元を受けるため,Step 1とStep 2の標識量の違いによりポリスルフィドを検出できる.また,Step 2の後でビオチンやマレイミドなどでSH基を検出することで,もともとSSH基であった部位への標識も可能である.一方,ジスルフィド結合の間に硫黄原子が組み込まれたような酸化型ポリスルフィド(酸化型超硫黄)は,Step 1でのアルキル化が困難であり,アルキル化還元法によって酸化型ポリスルフィド(酸化型超硫黄)を定量することはできない(図1).
また蛍光プローブ法は,測定が簡便であるため,最も汎用されているポリスルフィドの検出法の一つであるものの,HSAのような高次構造を有するタンパク質には,立体的な反応障害が懸念され,タンパク質分子内部に存在するポリスルフィド定量には不向きである.
一方,H2SやHS−,S2−といったスルフィドに関しては,メチレンブルー法7)をはじめ,電極法,ビマン法,NEM法8)など,さまざまな定量法が確立されている.したがって,酸化型ポリスルフィドから効率的かつ安定にスルフィドに還元することができれば,スルフィド測定法を用いて酸化型ポリスルフィドの定量が可能となる.そこで我々は,酸化型ポリスルフィドからスルフィドへの反応液として,sulfide anti-oxidant buffer(SAOB)に注目した.このSAOBは,1960年代にH2Sの酸化を防止する目的で開発された還元剤溶液である.アスコルビン酸や水酸化ナトリウム,サリチル酸ナトリウムで構成される簡単な組成であり,現在でも電極法を行う際に汎用されている.しかしながら,血液や血清にSAOBを添加すると,1 mM以上のスルフィドが検出されることが,2008年にWhitfieldらによって報告されている9).この血液や血清からの多量のスルフィドの由来に関しては,2014年のOlsonらの報告に,「アルカリ条件下においてR-SHがヒドロキシル(R-OH)に変化し,スルフィドが遊離した可能性がある(式1)」という考察にとどまっており,詳細な検証は現在まで行われていない10).
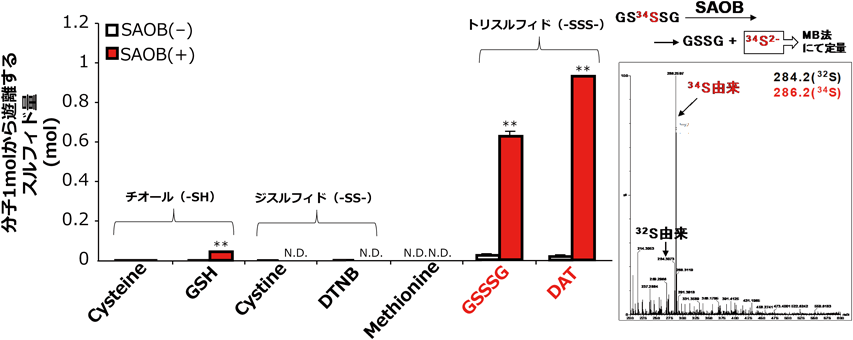
そこで我々はまず,SAOBに含まれる高濃度アスコルビン酸が酸化型ポリスルフィドをスルフィドに還元する可能性を検証した.まず,Olsonらの仮説(式1)ならびにWhitfieldの報告に従い,SAOBがSH由来のスルフィドを検出するか否かについて検討した.生成したスルフィドの検出にはメチレンブルー(MB)法を用いた.その結果,L-システインやグルタチオン(GSH)など還元型のSH含有化合物,シスチンや5,5′-dithiobis(2-nitrobenzoic acid)(DTNB)などのジスルフィド結合含有化合物からは,SAOB処理によってスルフィドはほとんど検出されなかった.その一方で,グルタチオントリスルフィド(GSSSG)およびジアリルトリスルフィド(DAT)などの酸化型ポリスルフィドを有する化合物をSAOB処理すると,化合物1分子あたりそれぞれ0.6および0.9分子のスルフィドが検出された.さらに,中央のSを安定同位体34SにしたGS34SSGに対してSAOB処理をしたところ,放出するスルフィドのほとんどが34S由来であることを確認している(図2).これらの結果から,SAOB処理により,R-SHからR-OHへ変化したのではなく,酸化型ポリスルフィド由来のサルフェン硫黄(酸化型超硫黄)からスルフィドが産生したことが明らかとなった.誌面の関係上,詳細は割愛するが,さまざまな検討結果から,1 M KOH+0.3 Mアスコルビン酸を含む溶液中で,37°C, 4時間の反応条件によって,酸化型ポリスルフィドを含む低分子化合物およびタンパク質から効率的にスルフィドが遊離してくることが明らかとなったことから,この反応液を用いた酸化型ポリスルフィド(酸化型超硫黄)の測定方法をElimination Method for Sulfide from Polysulfide(EMSP)と命名した.
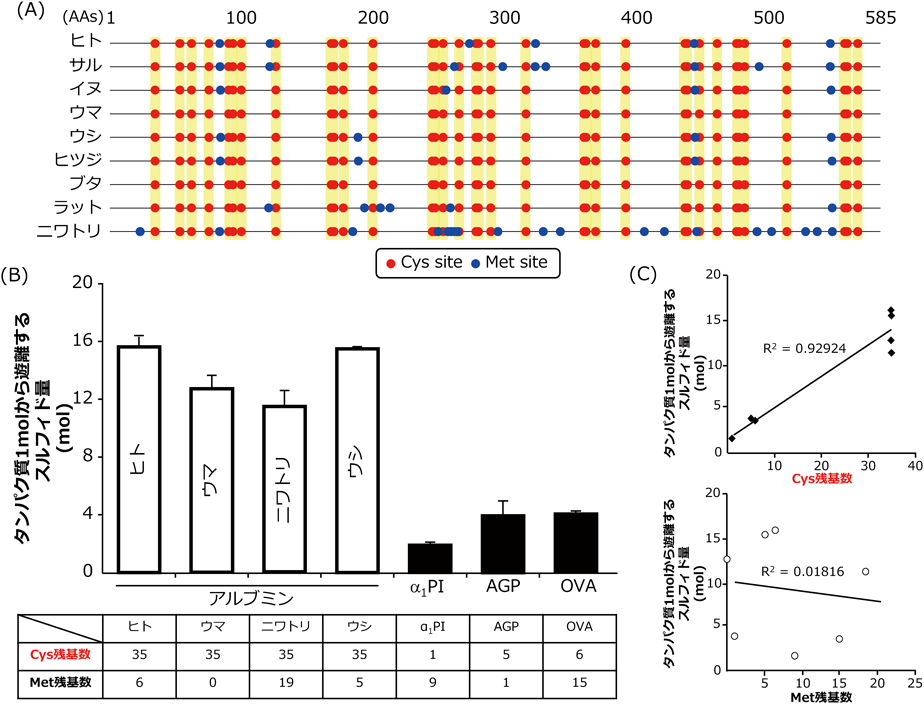
我々の確立した酸化型ポリスルフィドの測定法であるEMSPを用い,ヒト血清から精製したHSAの酸化型ポリスルフィドを定量した.その結果,HSA 1分子から約15分子ものスルフィドが遊離したことから,HSAは内因的に酸化型超硫黄を多量に保持していることが示唆された11).ここでさまざまな動物種アルブミンのアミノ酸配列に着眼すると,メチオニン(Met)残基数は多くの動物種間でバラバラである一方,Cys残基数とその位置はきわめて高度に保存されていることに気づく.そこで,内因的な酸化型超硫黄結合量とCysおよびMet残基数の関連について,各動物種アルブミンあるいはアルブミン以外のタンパク質を用いて評価したところ,ウマやニワトリ,ウシ由来アルブミンも同様に,アルブミン1分子に10~15分子の酸化型超硫黄が結合していた(図3).また,アルブミン以外のタンパク質であるα1-アンチトリプシン(α1PI)やα1-酸性糖タンパク質,卵白アルブミンにも内因的に酸化型超硫黄が結合しているものの,その量は低値であった(図3).これらデータを基に,含硫アミノ酸数と酸化型超硫黄をプロットしたところ,Cys残基数には高い相関性を示した一方で,Met残基数にはまったく依存しなかった.この結果は,Cys残基,特にCys–Cys架橋構造中に酸化型超硫黄が結合していることを示唆している.
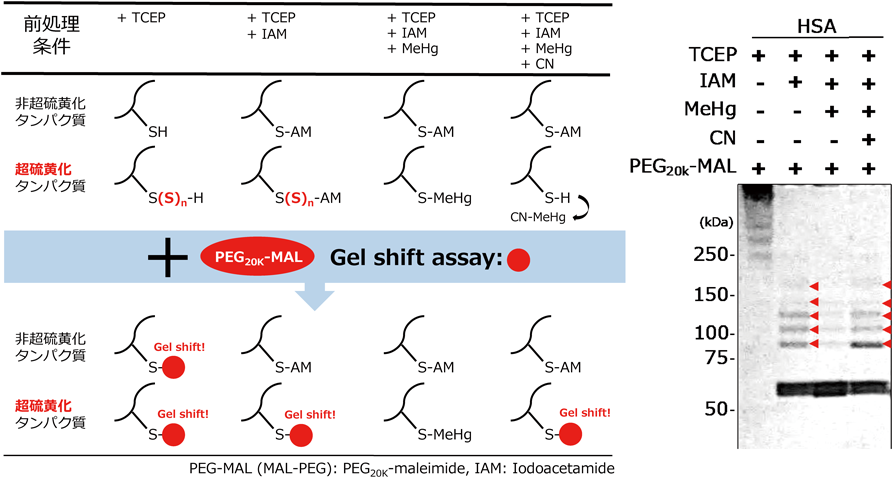
そこで,HSAに存在する酸化型超硫黄が,HSA分子内のCys–Cys架橋構造に存在しているかをAkaikeらの開発したポリエチレングリコール(PEG)-Maleimide based gel Shift Assay(PMSA)12)にて検証した.ここで使用したtris(2-carboxyethyl)phosphine(TCEP)は,超硫黄を一部分解することが知られているが,TCEP自身はS原子を持たない構造であるため,この系で検出されるポリスルフィドは試料中のタンパク質由来であると考えられている.以下にPMSAについて概説する.まずTCEP処理によりCys–Cys架橋構造を還元した試料は,20 kDaのポリエチレングリコール(PEG)が付加したSH反応試薬であるPEG-マレイミド(MAL)と反応させると,SHあるいはSSHと結合し,結合したPEGの個数に依存して分子量がシフトアップする.ここで,PEG-MAL反応の前にSHのアルキル化剤であるヨードアセトアミド(IAM)にて処理を行うと,R-SHとIAMの反応部位には,その後PEG-MALを反応させても結合しないが,R-SSHとIAMの反応部位は,ポリスルフィドを保持したままアルキル化されるため,IAMより高い求核性を持つPEG-MALが結合し,分子量はシフトアップする.これらの試料をSDS-PAGEにて電気泳動し,分子量の差からタンパク質の酸化型ポリスルフィドを評価することができる(図4).本反応に加えて,PEG-MAL反応前にメチル水銀(MeHg)やシアン(CN)にて処置することで,IAMやPEG-MALの反応効率の確認実験も並行して行っている.ごく最近では,このIAMも一部の超硫黄を分解することが判明し,近年ではβ-(4-hydroxyphenyl)ethyl iodoacetamide(HPE-IAM)などの超硫黄の分解がより少ないIAM誘導体も次々と開発され,日々改良が進んでいる13).
HSAにおけるPMSAの結果を図4に示す.TCEPのみ前処理したHSAにPEG20k-MALを反応させると,非常に高い位置にバンドが観察されたことから,TCEPの還元反応が十分に進んでいることがわかる.一方で,IAMを前処理した試料にPEG20k-MALを反応させた検体では,図4中の赤い矢印で示した,少なくとも五つのシフトアップしたバンドが多く観察された.また,それらシフトアップしたバンドはメチル水銀処理で消失し,シアン処理で回復したことからこれらのシフトアップしたバンドは,酸化型ポリスルフィド由来であることが示唆された.このPMSAの結果から,HSAのCys–Cys架橋構造は,少なくとも5か所以上はポリスルフィド結合として存在していると考えられる.それでは,なぜHSAは酸化型超硫黄を多く結合させているのか,その生理学的意義について以下に述べる.
4. HSAの酸化型超硫黄化と構造・生理機能の関連
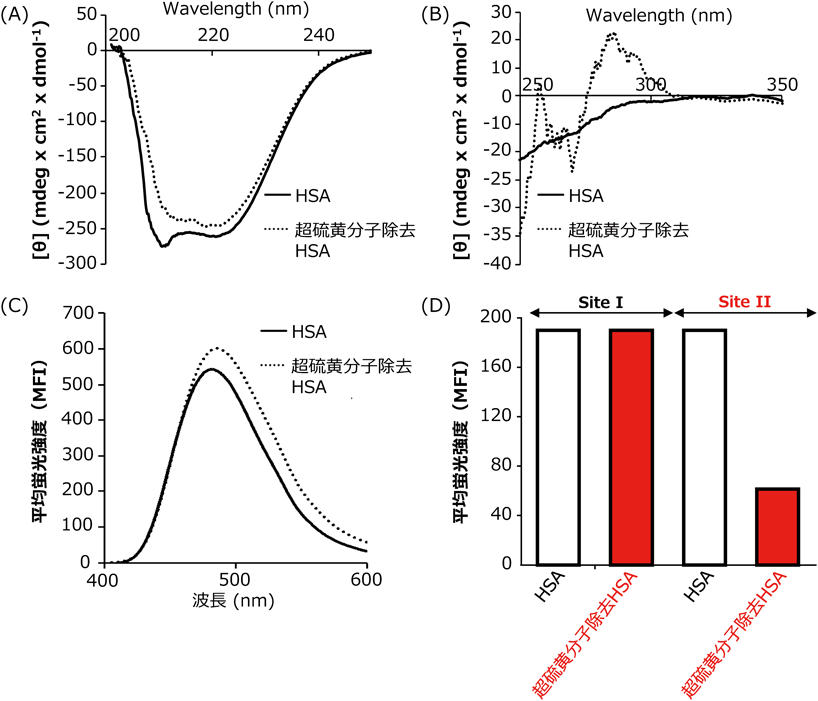
HSAにおける酸化型超硫黄化の生理学的意義解明を行うにあたり,酸化型超硫黄を特異的に除去したHSAの調製が必須であると考えた.ポリスルフィドの検出に使われる蛍光プローブSulfane Sulfur Probe(SSP)は,ポリスルフィドを引き抜くことでフルオレセインの蛍光を示すため,この反応を酸化型超硫黄の特異的除去に利用した.その結果,平均3分子の酸化型超硫黄が減少したHSAが調製できたが,さらなる酸化型超硫黄の除去はHSAを凝集させた.このSSP以外の方法で酸化型超硫黄除去を試みても,同様にHSA凝集を惹起させたことから,HSAの酸化型超硫黄はHSAの溶解性にも一部関与している可能性があると考えている.そこで,HSA凝集が起こらない条件であった3分子の酸化型超硫黄が減少したHSAを使用して,HSAの構造およびリガンド結合作用,抗酸化作用の解析を試みた.まず,円二色性スペクトル(CD)を測定したところ,二次構造を反映する遠紫外領域,さらに三次構造を反映する近紫外領域のいずれにおいてもスペクトルに変化が観察された(図5A, B).210~230 nm付近のスペクトルはタンパク質のαヘリックス含量に由来していることから,酸化型超硫黄の引き抜きによって,HSAのαヘリックス含量が減少したことを示唆している.これは,一般的な酸化修飾を施した際のHSAの構造変化に類似していると考えられる.一方近紫外領域では,酸化型超硫黄の引き抜きによってCys–Cys架橋構造に由来する260 nm近辺に特徴的な変化が観察されたことから,酸化型超硫黄がCys–Cys架橋構造内に存在していた可能性が高いことを示唆している.このことは,先述してきた結果とまったく矛盾しないものである.
次に疎水領域探索プローブであるSypro orangeを用い,タンパク質表面の疎水面評価を行ったところ,酸化型超硫黄除去HSAで蛍光の増大がわずかに観察され,酸化型超硫黄の引き抜きによって,疎水面がよりタンパク質分子表面に露出していることが明らかとなった(図5C).この結果は,先述した過剰な酸化型超硫黄の引き抜きにより引き起こされる凝集化メカニズムにも一部関与しているかもしれないが,詳細な凝集化メカニズムとの関連性に関してはさらなる検討が必要である.
冒頭でも述べたとおり,HSAにはSite IとSite IIと呼ばれる薬物結合ポケットが存在することから,それぞれの薬物結合サイトに特異的に結合して蛍光を示すプローブであるダンシルアミド(Site I)およびBD140(Site II)を用いて酸化型超硫黄除去HSAの薬物結合作用を評価した.その結果,わずか3分子の酸化型超硫黄を除去しただけにもかかわらず,Site IIの薬物結合能がほとんど消失していた(図5D).したがって,HSAの特にSite II近傍の構造維持には,酸化型超硫黄が重要な役割を担っていることが示唆された.また,この結果は二次構造の変化と同様に,HSAが酸化修飾を受けた際の結合能変化と類似しており,「HSAに結合している酸化型超硫黄の減少」と「HSAの酸化」の間に密接な関連があると考えている.
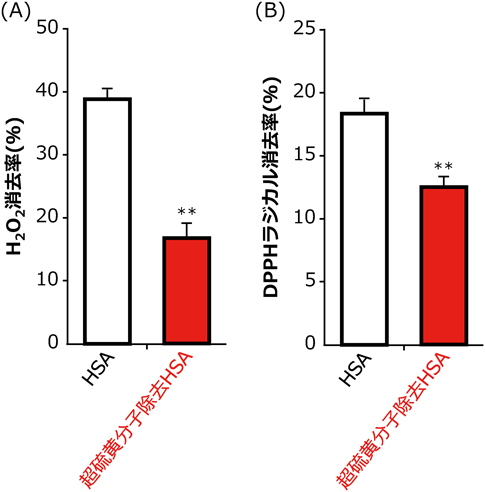
そこで,酸化型超硫黄の除去はHSAの抗酸化作用を減弱させるのではと考え,過酸化水素(H2O2)および2,2-ジフェニル-1-ピクリルヒドラジル(DPPH)ラジカルに対する消去活性にて評価した.結果は予想以上であり,HSAに結合している約15分子の酸化型超硫黄のうち,わずか3分子(全体の20%程度)の酸化型超硫黄を取り除いただけでH2O2消去活性は約50%,DPPHラジカル消去活性は約65%にまで減少していた(図6).これまで,HSAの抗酸化作用には34Cysの関与が示唆されていたが,今回の結果は,HSAに結合している酸化型超硫黄による抗酸化作用の関与を初めて明らかにするものである.また,HSAに結合している酸化型超硫黄15分子のうち,均一に抗酸化作用があるわけではなく,ごく一部の酸化型超硫黄によって抗酸化作用を発揮している点は,非常に興味深い.現在,その結合部位の同定や抗酸化作用に寄与している酸化型超硫黄の選択的測定系の構築を行っている.
ここまで述べてきたように,HSAに結合している酸化型超硫黄は,HSAの構造やその溶解性に影響を及ぼすとともに,生理機能である薬物結合作用,特にSite IIの薬物結合作用と抗酸化作用にも大きな影響を与えることが明らかとなった.
タンパク質の超硫黄化,特に「還元型」超硫黄化(R-SSHなど)において,これまで酸化・還元のレドックスバランスに関わる報告が多数なされてきた.その背景には細胞内という還元環境下に存在するタンパク質が主たる研究対象であったことも一因であると思われるが,実はヒト循環血中という比較的酸化的環境下においても,「酸化型」超硫黄分子ほどの量ではないが,「還元型」超硫黄が存在することを我々は見いだしており,酸化ストレス病態との関連性を報告している14).ここでは,特に慢性腎臓病(chronic kidney disease:CKD)疾患の患者血清を用いたHSAの「還元型」超硫黄と酸化ストレスの関連性に関してご紹介したい.
CKDは,糸球体濾過量(glomerular filtration rate:GFR)で表される腎機能の低下が3か月以上あるか,もしくはタンパク尿,片腎や多発性嚢胞腎,腎結石などの画像所見,血液検査異常や異常病理所見など,腎臓の障害を示唆する所見が慢性的(3か月以上)に持続する病態のすべてを指す疾患である.2020年現在,本邦のCKD患者数は予備軍も含め,2000万人以上と推定されており,この人数は成人約5人に1人に相当し,今や新たな国民病として位置づけられている.CKDの場合,腎機能を改善する有効な治療薬が存在しないこと,進行すると末期腎不全から血液透析療法の導入となること,心血管疾患の発症リスクが上昇することの3点が早急に解決すべき問題として取り上げられている.実際,維持血液透析患者数は33万人を超え,医療費も1兆円が費やされていると試算されており,本邦のヘルスケア対策の緊急的課題として,厚生労働省は元より自治体レベルでの取り組みも活発化している.
CKDや死因第1位の合併症である心血管疾患は,病態の進展に伴い酸化ストレスが亢進する.特に,維持血液透析患者では,最も酸化ストレスが亢進している.また,血圧や血糖を十分管理してもCKDや心血管疾患の進行を阻止できないことも多く,近年では,新たな病態進展因子として,酸化ストレスの関与が注目されるようになってきた15).実際に,Nrf2活性化を介した抗酸化剤であるバルドキソロンメチルは2型糖尿病患者の腎機能を改善した初めての薬剤であり16),本邦でもCKDステージG3・G4の糖尿病性腎臓病患者や常染色体優性多発性嚢胞腎患者を対象とした第III相試験がそれぞれ進行中である.特筆すべきは,これまでの臨床試験において糸球体濾過量の増加が認められた初めての薬ということで,専門医を中心に実用化が大いに期待されている.このバルドキソロンメチルの一例をみても,CKDや心血管疾患の進展に酸化ストレスが重要な役割を果たしていることは明確であろう.
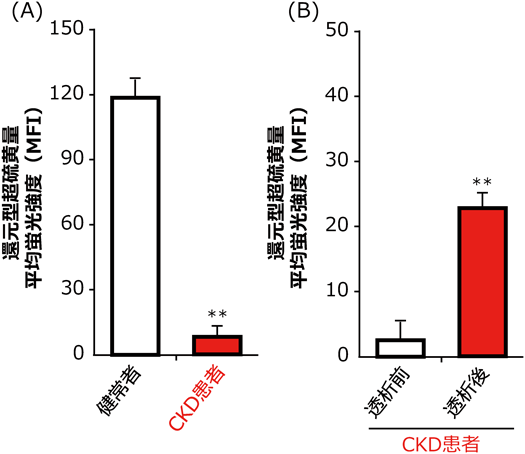
さて,先述したHSAに唯一遊離型で存在する34CysのSH基は血漿中の遊離型SH基の約80%を占めている上,血漿中の酸化ストレスに応じて34CysのSH基が酸化修飾を受けることから,血清タンパク質の主たるレドックス反応性Cys残基として位置づけられており,酸化ストレスマーカーとして基礎および臨床の両面から研究が行われてきた.すでに,34Cysの還元型と酸化型を分離定量するHPLC測定法が確立されており,酸化型34Cys分率(HSA34 Cys酸化度)の上昇が,加齢やさまざまな酸化ストレス関連疾患で観察されている17).また我々も,HPLCに代わる新たな測定法として確立したESI-TOF-MSによる解析法により,34Cysの主な酸化修飾体として,システイン付加体であることを報告してきた18).このようなHSAのレドックス研究を行う中で,我々は図1のアルキル還元法を用い,ヒト血清から単離したHSAにCys-SSHのような還元型超硫黄化が含まれており,その還元型超硫黄化がCKDなどの病態において減少することを発見した13)(図7).
また興味深いことに,維持血液透析患者の血清中還元型超硫黄濃度は,血液透析前後で大きく増加することが明らかとなった(図7).この血清中還元型超硫黄濃度の変化は,活性酸素や尿毒症物質などの酸化ストレス誘発物質が透析療法により除去された結果を鋭敏に反映しているものと考えており,新規酸化ストレスマーカーとしての可能性を示すものである.現在,病態早期からの血清中還元型超硫黄濃度の変動を精査し,酸化ストレス関連疾患早期からの変動の有無を人間ドック受診者検体にて解析を進めている.
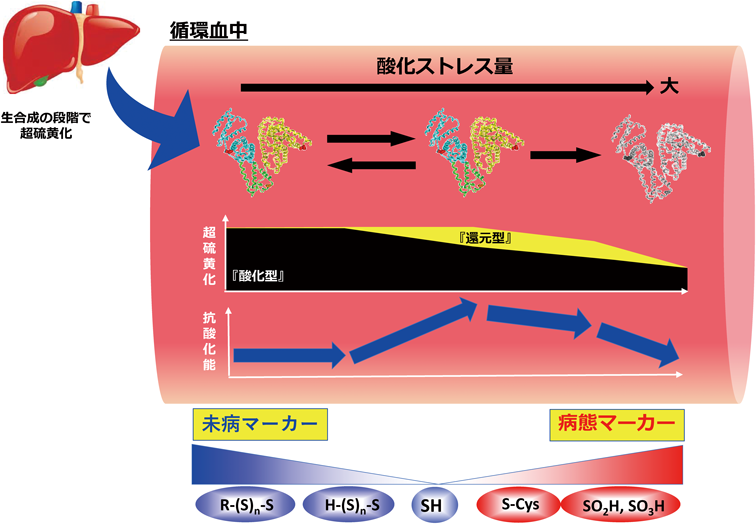
これまで,HSAの抗酸化作用が34CysのSHの寄与が中心的であると考えられてきたが,今回新たにHSAに存在するCys-SSHのような還元型超硫黄が関与する可能性を見いだした.まだ未発表データではあるが,“このCys-SSHのような還元型超硫黄量とHSAの抗酸化作用の間に高い相関が認められること”や“HSAに存在する酸化型超硫黄量は還元剤や酸化剤との反応によって還元型超硫黄を生成すること”を確認している.これはまさに,酸化型超硫黄のユニークな反応特性を生かした「循環血中という酸化的な環境下で獲得した巧みなレドックス調節機構」であると考えている.現在我々は,このHSAの超硫黄化がもたらす「新規生体恒常性維持機構」の概要を以下のように仮説立てている(図8).
- 1)HSAは生合成段階で超硫黄化を受ける.
- 2)循環血中での酸化的環境下において,多くは酸化型超硫黄として結合している.
- 3)必要に応じ,酸化剤などにより酸化型超硫黄から還元型超硫黄へと変換する.
- 4)変換した還元型超硫黄により,抗酸化作用を発揮する(通常レベルの活性酸素量では十分対応可能).
- 5)病的な活性酸素種量に及ぶと,システイン化HSAが増加し,アルブミン酸化度が増加する.
今後,どのCys残基がCys-SSH化されるのか?,さらにはHSAの抗酸化活性にCys-SSHがどの程度貢献するのか?など,これらの疑問を解決していくことで,生体におけるHSAの超硫黄化の生物学的意義の理解をより深化することができると考えている.加えて,肝硬変を含む慢性肝炎,炎症性腸炎,肺気腫などの他の慢性期疾患におけるHSA-Cys-SSHの変動や,血液脳脊髄液,関節液,腹水などの血清以外の組織液中や尿中のHSAにおける超硫黄化の程度などについても,今後明らかにしていきたいと考えている.
ここまで,内因的なHSAの超硫黄化の生理学的な意義として,抗酸化作用や立体構造の保持において重要な役割を果たしていることを述べてきた.特に,HSAの還元型超硫黄は即効性の抗酸化剤として機能する可能性が高いことから,多量な還元型超硫黄を結合させたHSAの外因的な供給は,酸化ストレス関連疾患の発症・進展に対し,抑制的に働くことが期待できる.また,古くからHSAはその高い生体適合性や優れた血中滞留性から,生理活性分子の担体として汎用されており,我々もこれまでに,不安定なガス分子である一酸化窒素(NO)をHSAに付加させたS-ニトロソ化(SNO)-HSAが優れたNOのキャリアとして,肝臓虚血再灌流障害を実証してきた19).そこで今回,多硫化ナトリウムNa2Sn(n=2~4)をHSAと反応させることによって還元型超硫黄分子付加HSAの作製を試みた.以下,Na2SnとHSAの反応物をSn-HSA(n=1~4)と表記する.作製した各種Sn-HSAとポリスルフィドの蛍光プローブであるSSPを反応させると,原料とする硫化ナトリウムの価数依存的に蛍光が増大した.また,還元型超硫黄の測定系であるDTT-MB法によって,S4-HSAはHSA 1分子あたり約4分子のポリスルフィドを保有することを確認している.
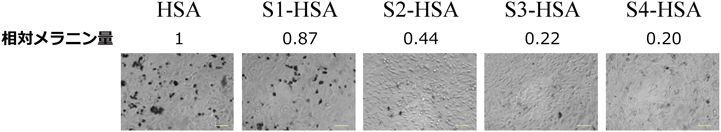
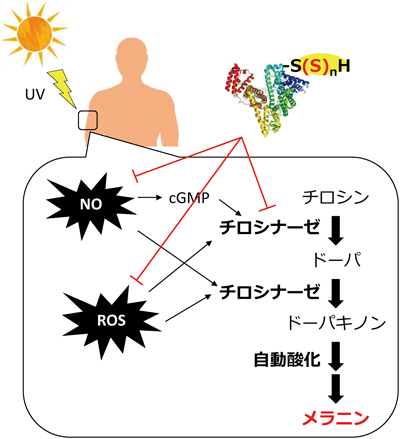
ここでは,作製したSn-HSAの美白剤としての応用例を紹介する.皮膚のメラノサイトは,紫外線(UV)などの刺激により活性酸素種(ROS)やNOが産生し,チロシナーゼの活性化を介してメラニンを産生することが知られている.還元型超硫黄は,高いROS消去作用を有することから,Sn-HSAがメラニン産生抑制作用を示す可能性はきわめて高いと考えられる.まず既報に従い,マウスメラノーマ細胞であるB16細胞を用い,メラニンの産生を促進させた条件下で,Sn-HSAを添加したところ,S1-HSA<S2-HSA<S3-HSA<S4-HSAの順でメラニン産生抑制作用が観察された(図9).加えて顕微鏡観察によっても,Sn-HSA処理によるメラニン産生の抑制と,細胞毒性がないことを確認している(図9).
詳細なデータは割愛するが,Sn-HSAの美白に関するこれまでの結果をまとめると,Sn-HSAは,①紫外線照射により産生したROSやNOを直接的消去作用,および②チロシナーゼ活性抑制作用という多面的機序によりメラニン産生を抑制することが明らかとなった(図10).本知見は,Sn-HSAの美白化粧品としての可能性を示すだけでなく,細胞毒性の少ない抗酸化剤として,酸化ストレス関連疾患治療薬としての応用も十分可能であることを示唆しているものと考えている.
現在臨床では,「栄養状態の指標」として,血中におけるHSAの「量」の測定が行われている.今回ご紹介した,HSAの「超硫黄化」は,HSAの「質」を決定づける新たな因子であると我々は考えており,以下の2点の理由から,臨床での新たな早期酸化ストレスマーカーとして応用したいと考えている.
- 1)酸化ストレス関連疾患の病態早期からHSAの「超硫黄化」は変動し,「超硫黄分子」を「酸化型」から「還元型」に変換させることで,一過的に抗酸化作用を増大させ,病的な酸化ストレスに対抗し,生体恒常性維持に働いている.
- 2)この生体恒常性維持機構により,多くは回復の一途をたどる(病態発症には至らない)が,この恒常性維持機構が破綻した場合は,HSAの「超硫黄化」は減少し,病態の進展とともに,システイン化HSAに代表される酸化アルブミンという「質」の悪いHSAが増大していくことから,HSAの「超硫黄化」はきわめて鋭敏な早期酸化ストレスマーカーになる.
今後,「超硫黄化」というHSAの「質」が,病態早期マーカーあるいは診断マーカーになりうる可能性をさまざまな臨床検体にて詳細に検証し,予防医療に貢献していきたいと考えている.また,酸化ストレス関連疾患治療薬として,人工的に高効率に「超硫黄化」させたHSAの創製も非常に興味深い研究領域であると感じている.動物種を超えて長い歴史の中で受け継いできた「超硫黄化」による生体恒常性維持機構は,今回ご紹介したHSAに限ったことではなく,毛髪や皮膚におけるケラチンなどにおいても同様な機構を有していることを我々は確認している.今回の「アルブミンの超硫黄化」の内容が,生物の中で多彩な機能を発揮している「超硫黄化」という生理現象の解明に少しでも貢献できればと切に願っている.
引用文献References
1) Iwao, Y., Ishima, Y., Yamada, J., Noguchi, T., Kragh-Hansen, U., Mera, K., Honda, D., Suenaga, A., Maruyama, T., & Otagiri, M. (2012) Quantitative evaluation of the role of cysteine and methionine residues in the antioxidant activity of human serum albumin using recombinant mutants. IUBMB Life, 64, 450–454.
2) Cha, M. & Kim, I.H. (2006) Disulfide between Cys392 and Cys438 of human serum albumin is redox-active, which is responsible for the thioredoxin-supported lipid peroxidase activity. Arch. Biochem. Biophys., 445, 19–25.
3) Fasco, M.J., Stack, R.F., Lu, S., Hauer, C.R. 3rd, Schneider, E., Dailey, M., & Aldous, K.M. (2011) Unique cyanide adduct in human serum albumin: potential as a surrogate exposure marker. Chem. Res. Toxicol., 24, 505–514.
4) Dóka, É., Arnér, E.S.J., Schmidt, E.E., & Nagy, P. (2019) ProPerDP: A protein persulfide detection protocol. Methods Mol. Biol., 2007, 51–77.
5) Chen, W., Liu, C., Peng, B., Zhao, Y., Pacheco, A., & Xian, M. (2013) New fluorescent probes for sulfane sulfurs and the application in bioimaging. Chem. Sci. (Camb.), 4, 2892–2896.
6) Wood, J.L. (1987) Sulfane sulfur. Methods Enzymol., 143, 25–29.
7) Moest, R.R. (1975) Hydrogen sulfide determination by the methylene blue method. Anal. Chem., 47, 1204–1205.
8) Kasamatsu, S., Kakihana, Y., Koga, T., Yoshioka, H., & Ihara, H. (2020) Generation of rat monoclonal antibody to detect hydrogen sulfide and polysulfides in biological samples. Antioxidants, 9, 1160.
9) Whitfield, N.L., Kreimier, E.L., Verdial, F.C., Skovgaard, N., & Olson, K.R. (2008) Reappraisal of H2S/sulfide concentration in vertebrate blood and its potential significance in ischemic preconditioning and vascular signaling. Am. J. Physiol. Regul. Integr. Comp. Physiol., 294, 1930–1937.
10) Olson, K.R., DeLeon, E.R., & Liu, F. (2014) Controversies and conundrums in hydrogen sulfide biology. Nitric Oxide, 41, 11–26.
11) Ikeda, M., Ishima, Y., Shibata, A., Chuang, V.T.G., Sawa, T., Ihara, H., Watanabe, H., Xian, M., Ouchi, Y., Shimizu, T., et al. (2017) Quantitative determination of polysulfide in albumins, plasma proteins and biological fluid samples using a novel combined assays approach. Anal. Chim. Acta, 969, 18–25.
12) Jung, M., Kasamatsu, S., Matsunaga, T., Akashi, S., Ono, K., Nishimura, A., Morita, M., Abdul Hamid, H., Fujii, S., Kitamura, H., et al. (2016) Protein polysulfidation-dependent persulfide dioxygenase activity of ethylmalonic encephalopathy protein 1. Biochem. Biophys. Res. Commun., 480, 180–186.
13) Akaike, T., Ida, T., Wei, F.Y., Nishida, M., Kumagai, Y., Alam, M.M., Ihara, H., Sawa, T., Matsunaga, T., Kasamatsu, S., et al. (2017) Cysteinyl-tRNA synthetase governs cysteine polysulfidation and mitochondrial bioenergetics. Nat. Commun., 8, 1177.
14) Shibata, A., Ishima, Y., Ikeda, M., Sato, H., Imafuku, T., et al. (2016) Human serum albumin hydropersulfide is a potent reactive oxygen species scavenger in oxidative stress conditions such as chronic kidney disease. Biochem. Biophys. Res. Commun.., 479, 578–583.
15) Ramos, L.F., Shintani, A., Ikizler, T.A., & Himmelfarb, J. (2008) Oxidative stress and inflammation are associated with adiposity in moderate to severe CKD. J. Am. Soc. Nephrol., 19, 593–599.
16) Pergola, P.E., Raskin, P., Toto, R.D., Meyer, C.J., Huff, J.W., Grossman, E.B., Krauth, M., Ruiz, S., Audhya, P., Christ-Schmidt, H., et al.; BEAM Study Investigators (2011) Bardoxolone methyl and kidney function in CKD with type 2 diabetes. N. Engl. J. Med., 365, 327–336.
17) Turell, L., Radi, R., & Alvarez, B. (2013) The thiol pool in human plasma: the central contribution of albumin to redox processes. Free Radic. Biol. Med., 65, 244–253.
18) Nagumo, K., Tanaka, M., Chuang, V.T., Setoyama, H., Watanabe, H., Yamada, N., Kubota, K., Tanaka, M., Matsushita, K., Yoshida, A., et al. (2014) Cys34-cysteinylated human serum albumin is a sensitive plasma marker in oxidative stress-related chronic diseases. PLoS One, 9, e85216.
19) Ishima, Y., Yoshida, F., Kragh-Hansen, U., Watanabe, K., Katayama, N., Nakajou, K., Akaike, T., Kai, T., Maruyama, T., & Otagiri, M. (2011) Cellular uptake mechanisms and responses to NO transferred from mono- and poly-S-nitrosated human serum albumin. Free Radic. Res., 45, 1196–1206.
著者紹介Author Profile
 異島 優(いしま ゆう)
異島 優(いしま ゆう)徳島大学大学院医歯薬学研究部 准教授.博士(薬学).
略歴1979年熊本県に生る.2002年熊本大学薬学部薬科学科卒業.07年同大学院薬学教育部博士後期課程修了.同年熊本大学薬学部特任助教.2010年米国・ピッツバーグ大学医学部博士研究員.16年より現職.
研究テーマと抱負ヒト血清アルブミンの生理機能解明とその特性を生かした新たな薬物送達キャリアの創製を研究テーマとしている.現在は,アルブミンの超硫黄化から派生し,皮膚や毛髪研究にも着手しており,未だ見ぬ生体の神秘を明らかにしたい.
ウェブサイトhttps://www.tokushima-u.ac.jp/ph/faculty/labo/ykz/
趣味家族とドライブ,温泉,飲酒(特に焼酎).