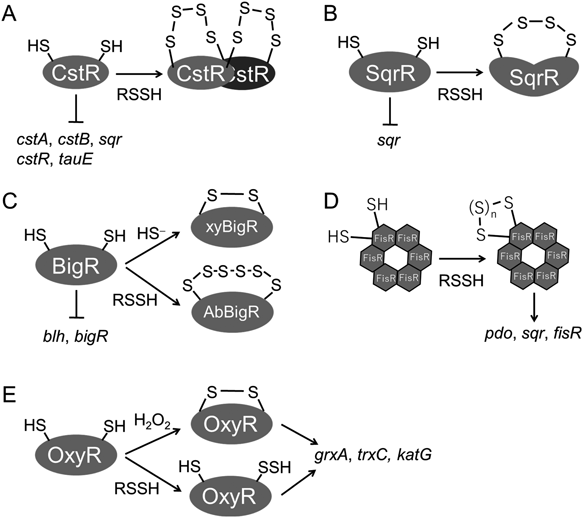
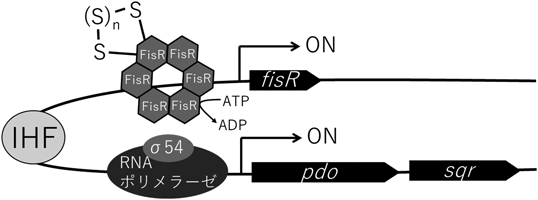
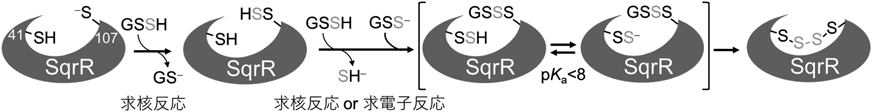
硫化水素・超硫黄分子のセンシング機構Molecular mechanism of sulfide and supersulfide sensing
1 東京大学大学院総合文化研究科Graduate School of Arts and Sciences, The University of Tokyo ◇ 〒153–8902 東京都目黒区駒場3–8–1 ◇ 3–8–1 Komaba, Meguro-ku, Tokyo 153–8902, Japan
2 東京工業大学生命理工学院Department of Life Science and Technology, Tokyo Institute of Technology ◇ 〒226–8501 神奈川県横浜市緑区長津田町4259, B–66 ◇ 4259 Nagatsuta-cho, Midori-ku, Yokohama-shi, Kanagawa 226–8501, Japan