硫黄はすべての生物にとって生育に必須な元素である.硫黄はアミノ酸やオリゴペプチド,抗酸化物質など多様な生体構成物質に含まれる.また,卵の腐卵臭として知られる硫化水素は細胞毒性を示す一方で,多様な経路のシグナル分子としても知られている.植物においても硫黄は成長に必須元素の一つであり,乾燥重量の1~2%を占める1).植物は硫酸を還元してシステインやメチオニンを合成することが可能であるが,動物はこの硫黄代謝系を保持していないため,植物を通してこれらを摂取する必要がある.植物では,硫酸イオンが土壌から吸収され,地上部に送られてから葉緑体内部に取り込まれる.葉緑体に取り込まれた硫酸イオンは還元され,硫化物イオンとなり,システインへと同化される.タンパク質内のチオール基を有するシステインによって形成されているジスルフィド結合は,細胞内外の還元状態に伴い結合が切れることで,タンパク質の構造変化を引き起こし活性調節に寄与している.特に葉緑体に局在するチオレドキシンは,明所ではチラコイド膜の電子伝達鎖から電子を受け取り,ATP合成酵素やカルビンベンソン回路を構成する酵素のジスルフィド結合を還元することでATPと糖の合成を促進する.逆に暗所ではチオレドキシンは酸化型となることで,カルビンベンソン回路を不活性化させ,酸化的ペントースリン酸化回路を活性化させることで,NADPHの供給を促進させる.また,グルタチオンもシステインを含有する重要な抗酸化物質であり,病害応答により生産した活性酸素を応答後に速やかに消去する役割や,過剰な光にさらされたときに光化学系から生産された活性酸素を消去し,光化学系を保護する役割を持つ.また,植物が乾燥ストレスにさらされたとき,細胞質におけるシステインの脱硫化により生産した硫化水素は重要なシグナル分子となる.硫化水素は一酸化窒素の生産や転写因子,NADH生産酵素のパースルフィド化を行うことで気孔閉鎖を誘導する.また,硫化水素によりオートファジーが抑制されていることも報告されている.
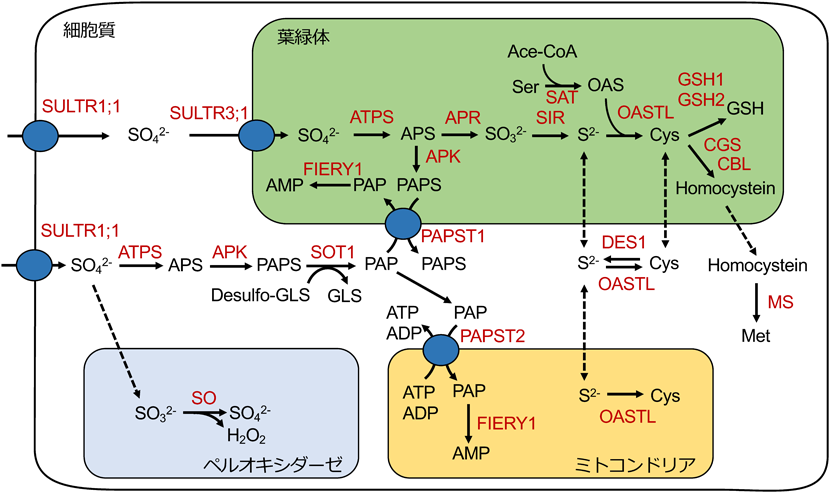
土壌中では硫酸イオンが最も安定した硫黄化合物であり,植物はこれを根から吸収し,その後,植物体内で硫黄同化経路により代謝され,システインやメチオニンが生合成される2).土壌中では,硫酸が最も安定した硫黄化合物となる.土壌中の硫酸イオンの取り込みから,システインの合成までの一連の反応経路を,図1にまとめた.シロイヌナズナには12個の硫酸イオントランスポーター遺伝子にコードされるSULTR(sulfate transporter)が存在する.土壌中の硫酸イオンは,根の表皮細胞の細胞膜に局在する硫酸イオン輸送体であるSULTR1;1などを介して細胞内に取り込まれる.植物体内に取り込まれた硫酸イオンはそのまま地上部へ輸送され,葉緑体がある葉肉細胞に取り込まれる3).その後,葉緑体包膜に存在するSULTR3;1などを介して硫酸イオンは葉緑体内部へと輸送される4).葉緑体内部では,硫酸イオンがATPスルフリラーゼであるATPS(ATP sulfurylase)によりアデノシン5′-ホスホ硫酸(adenoshine 5′-phosphosulfate:APS)へと変換される.APSはこの後,二つの経路により,代謝される.APS還元酵素であるAPR(APS reductase),亜硫酸還元酵素であるSIR(sulfite reductase)により亜硫酸イオン,硫化物イオン(S2−)へと変換される.o-アセチルセリンチオールリアーゼであるOASTL[o-acetylserine(thiol)lyase]により,セリンから合成されたo-アセチルセリン(o-acetyl-Ser:OAS)と葉緑体内部で生産されるS2−が反応することで,システインへと同化される.同様の反応は,ミトコンドリアのOASTLによっても生じることがわかっている.システインはグルタミン酸システイン結合酵素であるGCL(glutamate-cysteine ligase)とグルタチオン合成酵素であるGSH1(glutathione synthase 1)とGSH2(glutathione synthase 2)によりグルタチオンの生産に用いられる.また,システインはシスタチオニンγ合成酵素であるCGS(cystathionine γ-synthetase),シスタチオニンβ-リアーゼであるCBL(cystathionine β-lyase)によりホモシステインヘと変換された後,細胞質へ輸送され,メチオニン合成酵素によりメチオニンの生産に用いられる.葉緑体内部で生産されたS2−は細胞質に存在するOASTLによりシステインへと合成される.また,システインはL-システインデスルフヒドラーゼであるDES1(L-cystein desulfhydrase 1)により脱硫化され,S2−が放出される.ミトコンドリアにもOASTLは存在しており,S2−を利用したシステインの合成が行われる.もう一つの経路は,APSがAPSリン酸化酵素(APS kinase:APK)により3′-ホスホアデノシン-5′-ホスホ硫酸(3′-phosphoadenoshine-5′-phosphosulfate:PAPS)へと変換される経路である.葉緑体内部で生産されたPAPSは細胞質へと放出される.細胞質でも葉緑体内部と同様に,硫酸はATPSによりAPSへと変換される.APSはAPSリン酸化酵素であるAPK(APS kinase)によりPAPSへと変換される.PAPSの硫酸部位は硫酸転移酵素によりグルコシノレートに取り込まれ,副産物として3′-ホスホアデノシン-5′-硫酸(3′-phosphoadenosine-5′-phosphate:PAP)が生産される.このPAPは核へ移行することで熱ストレス応答に寄与するマイクロRNAの生産を誘導するが,通常時はPAPS輸送体により葉緑体へと輸送された後にイノシトールリン酸脱リン酸化酵素であるFIERY1(FRY1, inositol polyphosphate 1-phosphatase 1)により脱リン酸化され,AMPへと変換される.また,PAPS輸送体はミトコンドリア内膜に局在しており,PAPとATPやADPは交換輸送され,イノシトールリン酸脱リン酸化酵素によりAMPへと変換される5).細胞内に取り込まれた硫酸は,亜硫酸としてペルオキシソームへと輸送される.ペルオキシソームに輸送された亜硫酸は,亜硫酸酸化酵素であるSO(sulfite oxidase)により過酸化水素との反応により酸化され,硫酸へと変換される6).この活性は,亜硫酸によるカタラーゼの阻害を抑制するために必要である.このように,動物ではみられない硫黄同化は,植物の葉緑体(色素体)を中心に生じる.
上述した硫黄同化系は,植物の生育環境に応じて,転写制御,翻訳制御,翻訳後制御など多段階で制御されている.植物が硫黄欠乏条件になると,転写因子であるSLIM1(sulfer limitation 1)が活性化し,硫酸からシステインを同化する経路を担う遺伝子の転写が活性化する7).マイクロRNAであるmiRNA395もSLIM1の制御下にあり,硫黄欠乏条件で発現が誘導されたmiRNA395は,硫酸イオン輸送体のSULTR2;1の発現を正に制御して,根から新しい組織への効率的な硫黄輸送を促す8).一方,SLIM1は,PAPSが害虫に対する忌避成分であるグルコシノレートに取り込まれる経路の遺伝子の発現を抑制することで,硫黄欠乏条件における硫酸の獲得に寄与すると考えられている.
細胞内の硫黄量はシステイン合成酵素であるOASTLの活性も制御する9).OASTLは,o-アセチルセリンの合成を触媒するセリンアセチルトランスフェラーゼであるSAT(serine acetyltransferase)と複合体を形成することで活性を持つ.OASTLとSATの複合体形成は,S2−存在下で誘導されるが,その一方で,S2−が存在しない状態では,システインの前駆体であるOASが蓄積することで,OASTLとSATの複合体が解離し,システイン合成活性は低下する.このように,細胞内の硫黄の恒常性は,これらの硫黄代謝経路の制御により維持されていると考えられている.
また,この硫黄同化経路は,酸化還元制御も受けることが報告されている.硫黄同化経路の最初の反応を触媒するATPSはチオレドキシンの標的となっており,酸化還元制御により活性調節されている10).ATPSより生産されたAPSは,上述したとおりAPRとAPKによりそれぞれ亜硫酸イオンやPAPSへと代謝される.APRとAPKは互いに競合し合う.APKの86番目のアミノ酸のシステイン残基と119番目のシステイン残基がジスルフィド結合を形成するが,このジスルフィド結合が還元されると,酵素の触媒反応効率を表すkcat/kmが17倍も上昇する.APRも同様に,ジスルフィド結合により調節されており,酸化状態になると活性が増強される11).また,還元型のチオレドキシンを添加すると,APRの活性は阻害されるため,APRの活性調節はチオレドキシンを介していると考えられている11).このように,細胞内の酸化還元状態により,APSが亜硫酸に変換されるか,PAPSへと変換されるかが決定される.酸化状態においてAPRが活性化され,亜硫酸イオンが合成されると,システインへと同化反応が進み,システインを元に抗酸化物質であるグルタチオンが合成されることで,酸化ストレス応答を行う.また,グルタチオン合成に寄与するGCLは,分子内に2か所のジスルフィド結合を保持しており,還元状態ではこの活性が阻害されることが明らかとなっている12, 13).このように,硫黄同化経路は,細胞が得られる量や,細胞内の酸化還元状態によって制御されている.
4. チオレドキシンを介した酸化還元制御による光合成制御機構
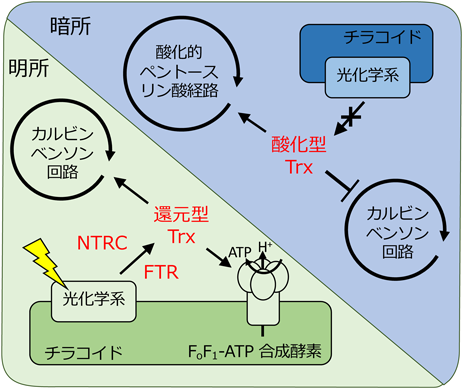
葉緑体で合成されたシステインは,アミノ酸としてタンパク質に取り込まれた後,酵素や転写因子の活性調節に用いられる.植物においてシステインが保持するチオール基の酸化還元には,チオレドキシンと呼ばれるチオールジスルフィド酸化還元酵素の一種が光環境応答に重要であることが知られている(図2).チオレドキシンとは,動物や酵母,細菌などで広く保存されている酸化還元タンパク質であり,多様な酸化還元制御機構に深く関与していることが知られている.シロイヌナズナは20種類ものチオレドキシンのアイソフォームを保持しており,7種類のサブファミリー(Trxh, Trxf, Trxm, Trxz, Trxy, Trxo, Trxx)に分類される14).Trxoはミトコンドリアに局在する一方,Trxf, Trxm, Trxy, Trxz, Trxxは葉緑体に局在する.Trxhは細胞質や核,小胞体,ミトコンドリアなどに局在している.これらのチオレドキシンは乾燥,熱,酸化ストレスなど多様な環境ストレスへの応答や光合成の制御において重要な役割を果たしている.葉緑体に局在するチオレドキシンは,フェレドキシン-チオレドキシン還元酵素(ferredoxin thioredoxin reductase:FTR)とNADPHチオレドキシンレダクターゼC(NADPH-dependent thioredoxin reductase C:NTRC)により活性化される.FTRはフェレドキシンを,NTRCはNADPHを用いてチオレドキシンを活性化する15).明所では,光を利用した電子伝達系が駆動し,光化学系Iからフェレドキシンに電子伝達が行われると,その電子はFTRを還元し,チオレドキシンを活性化する.NTRCは,NADPH依存的にチオレドキシンを活性化し,明所では電子伝達により生産されたNADPH,暗所では酸化的ペントースリン酸経路により生産されたNADPHを利用する.
活性化されたチオレドキシンは,光合成の明反応と暗反応の両方を制御することが知られている.光合成の一連の反応を簡単に説明する.植物葉緑体においてチラコイド膜に局在する光化学反応の中心となる光化学系は,光を吸収すると,水を分解することで,チラコイド膜内に酸素と水素を生産し,電子を電子伝達系へ渡す.電子伝達系は,NADPHを生産するとともに,ストロマからチラコイド膜内へプロトンを流入させ,チラコイド膜を介したプロトン駆動力を形成する.プロトン駆動力によりFoF1-ATP合成酵素が駆動されることで,ATPが合成される.得られたNADPHとATPは,カルビンベンソン回路に利用され,二酸化炭素の固定を行い,糖を合成する.
明所においてFTRとNTRCにより還元されたチオレドキシンは,ATP合成を行うFoF1-ATP合成酵素を制御する.このFoF1-ATP合成酵素は,プロトン駆動力を用いてATPの生産を行う一方で,FoF1-ATPaseとしてATPを加水分解することができる.このATPの加水分解は,チオレドキシンにより制御されることが報告されている16).FoF1-ATP合成酵素は,膜貫通領域であるFo分子と,ストロマに突出しているF1分子に分けることができる.Fo分子とF1分子はγサブユニットがつながっており,γサブユニットが回転することでATPが生産される.このγサブユニットは,二つの近接したシステイン残基を保持しており,ジスルフィド結合を形成する.チオレドキシンは,このジスルフィド結合を切断することで,FoF1-ATP合成酵素の活性化に必要なプロトン駆動力の閾値を低下させ,FoF1-ATP合成酵素を活性化する.逆に,暗所ではプロトン駆動力の枯渇とともにFTRによるチオレドキシンの活性化が抑制されるため,FoF1-ATP合成酵素のチオール基が急速に酸化されることで,ATPの加水分解を抑制することができる.また,NTRC経路はチオレドキシンを介してFoF1-ATP合成酵素を暗所でもわずかに活性化する17).
光合成の暗反応であるカルビンベンソン回路の酵素も,還元されたチオレドキシンにより活性化される.また,暗所においてグルコースを分解し,NADPHを生産する経路である酸化的ペントースリン酸経路もチオレドキシンに制御される.酸化的ペントースリン酸経路は,活性化されたチオレドキシンにより不活性化されることで,昼間におけるグルコース消費を抑制することができる18).カルビンベンソン回路においてフルクトース1,6-ビスリン酸を脱リン酸化する反応を触媒するフルクトース-1,6-ビスホスファターゼであるFBPase(fructose-1,6-bisphosphatase)は,一次構造の中央にシステイン残基を三つ保持している.FBPaseの活性化には,Mg2+が必要であるが,システイン残基が還元されることで,必要なMg2+量が低下する19).セドヘプツロース1,7-ビスリン酸の脱リン酸化を触媒するセドヘプツロース-1,7-ビスホスファターゼ(sedoheptulose-1,7-bisphosphatase:SBpase)もチオレドキシンに制御されている.FBpaseと同様,SBpaseもTrxfによる還元により活性化される20).NADPHの存在下において,1,3-ビスホスホグリセリン酸をグリセルアルデヒド3-リン酸に還元する酵素であるグリセルアルデヒド-3-リン酸デヒドロゲナーゼ(glyceraldehyde-3-phosphate dehydrogenase:GADPH),リブロース5-リン酸からリブロース1,5-ビスリン酸への反応を触媒するホスホリブロースキナーゼ(phosphoribulokinase)は,CP12と呼ばれる約80アミノ酸からなるタンパク質により制御される21).明所では,CP12は還元型チオレドキシンにより還元されるが,暗所では酸化状態となる.酸化されたCP12が足場となり,GADPHとホスホリブロースキナーゼが複合体を形成し,活性が阻害される.また,この複合体は還元的な条件やNADPHの存在下では解離することで,それぞれの酵素が活性化する.また,二酸化炭素固定酵素であるリブロース1,5-ビスリン酸カルボキシラーゼ/オキシゲナーゼであるRubisco(ribulose-1,5-bisphosphate carboxylase/oxygenase)の活性もチオレドキシンを介した制御を受ける22).明反応により電子を受け取ったチオレドキシンは,Rubiscoアクチバーゼ(Rubisco activase)を活性化させる.還元されたRubiscoアクチバーゼは,Rubiscoのカルバミル化修飾を促すことで活性化する.また,光が過剰となった場合には,活性酸素種の発生により,Rubiscoは酸化され不活性化する.酸化されたRubiscoはそのまま分解されるか,グルタチオン依存的シャペロンであるBundle-sheath 2により再活性化される22).明所においてチオレドキシンシステムがカルビンベンソン回路を活性化する一方で,暗所では酸化的ペントースリン酸経路を活性化する.酸化されたチオレドキシンは,酸化的ペントースリン酸経路のグルコース-6-リン酸デヒドロゲナーゼが保持するシステイン残基を酸化することで,活性化する23).
葉緑体で合成されたシステインは,アミノ酸としてタンパク質に取り込まれるだけでなく,植物の生育に必須な含硫代謝物の前駆体としても重要となる.これらの代謝物には,メチオニン,グルタチオン,ビオチンやチアミンなどのビタミン,モリブデン補酵素やリポ酸などの補酵素,電子伝達系に含まれる鉄硫黄クラスターが含まれる24).また,システインは抗酸化物質としてよく知られるグルタチオンの生産にも用いられる.グルタチオンは,グルタミン酸,システイン,グリシンから構成されるトリペプチドである.グルタチオンの中心にあるシステインのチオール基が酸化されると,ジスルフィド型(GSSG)となり,NADPH依存性グルタチオン還元酵素によって還元型グルタチオン(GSH)にリサイクルされる.還元型グルタチオンは,直接的な活性酸素の消去や,デヒドロアスコルビン酸還元酵素によるアスコルビン酸の生産を活性化させることによる活性酸素の消去も行うことができる25).
還元型グルタチオンは,植物の多様な生理学的応答において重要な役割を果たす.植物が過剰な光にさらされると,光合成電子伝達系の飽和とともに,活性酸素種が発生する.活性酸素種が発生すると,光化学系が損傷し,効率的な明反応が行えなくなる.グルタチオン還元酵素は,葉緑体とミトコンドリアに局在し,還元型グルタチオンの生産を促進することで,アスコルビン酸-グルタチオンサイクルを活性化することで,活性酸素の蓄積を抑制することができる26).また,病原菌応答にもグルタチオンは重要な役割を果たす.病原菌が植物に感染すると,葉緑体やペルオキシソームにグルタチオンが蓄積し,酸化ストレスに応答することで,細胞内器官の機能障害を防ぐことができる27).また,シロイヌナズナのグルタチオンを合成する酵素であるγ-グルタミルシステイン合成酵素は,根の伸長を促進することが報告されている28).GCLは,グルタチオンの生産を通して,植物の重力屈性に重要な植物ホルモンであるオーキシン応答性遺伝子の転写活性化や,植物の重力屈性に重要なオーキシンの輸送体であるPIN-FORMEDファミリータンパク質の局在に寄与する29).
生理活性物質として多くの生物において重要なシグナル伝達をになう硫化水素は,植物においても金属ストレス,干ばつ,塩ストレスなど外因性のストレスへの応答や,種子の発芽や根の伸長に重要な役割を果たしている.この硫化水素の主な供給源は葉緑体であり,上述した硫酸からシステインへの合成の過程で生産された硫化水素が膜を透過することで,他の細胞内器官へ拡散すると考えられていた30, 31).硫化水素はpKa1=6.9, pKa2>12であり,葉緑体のストロマのpHが7~8程度であることを考えると,ストロマでは硫化水素はH+イオンとHS−に解離する.HS−は葉緑体の包膜を自由に透過することができないため,葉緑体由来の硫化水素が細胞内へ供給されるためには,未知の輸送体が必要となる.
硫化水素は複数の酵素により生産されることが明らかとなってきている.DES1はシステインを脱硫化して,硫化水素とアンモニア,ピルビン酸を生産する.DES1以外にも,D-システインを分解する酵素であるD-CDes(D-cystein desulfhydrase)やNifS様酵素が存在している32, 33).NifS様酵素は細胞質,葉緑体,ミトコンドリアに局在しており,それぞれの器官でシステインをアラニンと硫化水素に分解する33).ミトコンドリアでは,β-シアノアラニンの生産を触媒するβ-シアノアラニン合成酵素が硫化水素の発生を行う34).この酵素は,シトクロムc酸化酵素の阻害剤であるシアン化物とシステインを基質として,硫化水素とβ-シアノアラニンを生産する.硫化水素もシアン化物と同様に,ミトコンドリアではシトクロムc酸化酵素を阻害する.この硫化水素はミトコンドリアに局在するOASTLによってシステインへと取り込まれる.このミトコンドリアにおける硫黄サイクルは,シアン化物の解毒に寄与し,根の伸長に重要である.上述した硫化水素の生産は,さまざまな環境ストレスにより誘導され,エチレンや一酸化窒素などの関与も報告されている35, 36).
7. 硫化水素の生産を介した気孔閉鎖とオートファジーの制御
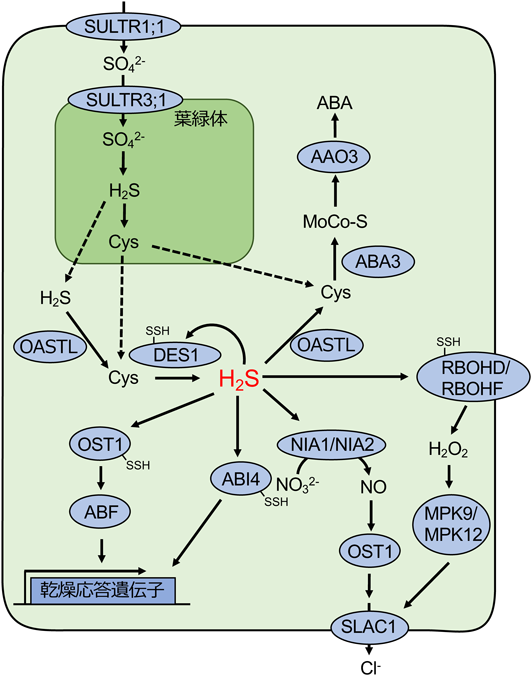
硫化水素は,植物体内で多様な生理学的プロセスに関与することが報告されている.硫化水素は光合成電子伝達系の光化学系Iの先祖型といわれている複合体が緑色硫黄細菌に存在しており,電子供与体として用いられることが知られている.また,植物体内の水分量の調節や二酸化炭素取り込みに関わる気孔の開閉において,硫化水素は重要な役割を果たしている(図3).植物の気孔は一対の孔辺細胞により構成されており,光合成が盛んに行われる晴天の昼には,気孔を開くことで二酸化炭素取り込み,光合成で得られた酸素を放出する.また,気温上昇や日光により葉の温度が上昇した場合も気孔を開くことで熱を放出する.一方で,植物が乾燥ストレスにさらされた場合,気孔からの水分の損失を防ぐために,気孔を閉鎖する必要がある.気孔の開閉は複雑な機構により制御されており,最終的には細胞膜に存在するCl−チャネルであるSLAC1(slow-type anion channel 1)に代表されるイオンチャネルが開閉することで孔辺細胞内部の浸透圧が変化することで細胞容積が増減し,気孔が開閉する.これより,植物における気孔開閉の制御機構を簡単に説明する.植物が乾燥ストレスにさられると,ストレスホルモンの一つであるアブシジン酸(abscisic acid:ABA)が生産される.ABAはABA受容体であるPYL(PYR1-like)/PYR(Pyrabactin resistance)/RCAR(regulatory component of ABA receptor)に結合することで,脱リン酸化酵素であるPP2C(protein phosphatase 2C)と複合体を形成することで,PP2Cを不活性化させる37).PP2Cはリン酸化酵素であるOST1(open stomata1)を脱リン酸化することで,不活性化させることができるが,PP2CがABA受容体により不活性化することで,OST1はリン酸化され,活性化される.活性化されたOST1はSLAC1をリン酸化することでCl−を孔辺細胞外へ排出し,浸透圧の減少を引き起こし気孔閉鎖を誘導する38).また,OST1の活性化は,NADH酸化酵素であるRBOHD(respiratory burst oxidase protein D)とRBOHF(respiratory burst oxidase protein F)をリン酸化することで,活性酸素を生産する39).活性酸素は,カルシウム透過型チャネルの活性化やリン酸化酵素であるMPK9/MPK12(mitogen-activated protein kinase 9/mitogen-activated protein kinase 12)を介したSLAC1の活性化を行うことで,気孔の閉鎖を誘導する40, 41).
気孔開閉の制御機構において,硫化水素は重要なシグナル分子となる(図3).乾燥ストレス応答に伴い生産されたABAは,細胞質におけるDES1によるシステインの脱硫化を誘導し,硫化水素の生産を促す42).この硫化水素が,複数の気孔閉鎖を誘導する経路にかかわっているが,その詳細な機構は明らかではない.硫化水素は,硝酸還元酵素であるNIA1/NIA2(nitrate reductase 1/nitrate reductase 2)を介した一酸化窒素の生産を誘導することが報告されている42).生産された一酸化窒素は,PP2CのファミリーであるABI1(ABA-insentive 1)の下流で作用し,さらにOST1リン酸化を促進することでSLAC1を活性化し,気孔閉鎖を誘導する42, 43).また,OST1が保持する二つのシステイン残基(Cys131/Cys137)のチオール基に硫黄が付加されるパースルフィド化修飾は気孔閉鎖を誘導することが報告された44).このパースルフィド化は,OST1とABAシグナルの下流に作用する転写因子であるABF2(ABA response element-binding factor 2)との相互作用を促進することで,気孔閉鎖を誘導する.細胞質におけるシステインの脱硫化に伴うH2Sの生産を触媒するDES1もパースルフィド化修飾を受ける45).パースルフィド化修飾を受けたDES1は活性化される.活性酸素の発生に寄与するNADH酸化酵素であるRBOHDもパースルフィド化修飾を受けることで活性化し,気孔閉鎖を誘導する45).また,乾燥ストレスにおいて重要なシグナル伝達をになうMAPKKK18(mitogen-activated protein kinase kinase kinase 18)の転写を促進するABA受容体であるABI4(ABA-insensitive 4)もパースルフィド化することで活性化することが明らかとなっている46).また,これらのパースルフィド化はすべてDES1の下流で行われており,DES1による硫化水素の発生がタンパク質のパースルフィド化の重要な引き金となっていることが示唆されている.また,硫化水素がOASTLによりシステインへ合成されることで,ABAの生産を促進する47).システインはモリブデン補酵素硫化酵素であるABA3(ABA deficient 3)によるモリブデン補酵素の硫化に用いられる.硫化モリブデン補酵素は,アブシジンアルデヒド酸化酵素であるAAO3(abscisic aldehyde oxidase 3)を活性化することで,ABAの生産を促し,気孔閉鎖を誘導する.
硫化水素は,タンパク質のリサイクル機構としてもよく知られるオートファジーによるタンパク質分解機構も制御している.オートファジーが誘導される環境に植物細胞がさらされると,ユビキチン様酵素であるAutophagy 8が脂質化修飾を受けた後に,分解されるタンパク質を包み込むオートファゴソームと呼ばれる小胞を形成する.DES1を欠損した株では,Autophagy 8の脂質化修飾が誘導されたことから,DES1によるシステインの脱硫化はオートファジーを抑制することが示唆された48).また,DES1の欠損はアンモニアの生産も抑制するが,外因性のアンモニアの添加は,オートファジーを抑制することはできなかった.これらの結果から,DES1による硫化水素の生産がオートファジーの抑制に重要であると考えられている.また,窒素飢餓条件においては,活性酸素がオートファジー誘導の重要なシグナル分子となっているが,硫化水素の添加は活性酸素の発生には影響を与えなかった.これらの事実から,硫化水素によるオートファジー抑制には,活性酸素量の制御を介していないと考えられる49).
本稿では,植物における硫酸からシステインへの同化経路と,システインを前駆体とした含硫代謝物の生理学的役割を中心に概説した.ヒトや酵母などとは異なり,植物が特異的に持つ葉緑体において硫黄代謝が行われ,さらに外部から得られる光を利用してチオール基が酸化還元されること代謝制御が行われる.また,チオール基の酸化還元による調節機構は,硫黄代謝にとどまらず,光合成や気孔開閉の制御にも寄与する.これらの制御は,植物が明暗に応答するために必須であることが示された.また,孔辺細胞の硫化水素は気孔閉鎖に重要な役割を持つタンパク質が保持するシステイン残基に硫黄を付加するパースルフィド化修飾を行い,活性化することで気孔閉鎖を誘導する.硫黄を介した酸化還元調節機構は,迅速に進行するため,たとえば太陽の角度や雲の動きなどにより急速に変化する光環境に応答するためには,必須な制御機構であることは間違いなく,今後の展開に注目される.
引用文献References
1) Kumar, V., Vogelsang, L., Seidel, T., Schmidt, R., Weber, M., Reichelt, M., Meyer, A., Clemens, S., Sharma, S.S., & Dietz, K.-J. (2019) Interference between arsenic-induced toxicity and hypoxia. Plant Cell Environ., 42, 574–590.
2) Saito, K. (2000) Regulation of sulfate transport and synthesis of sulfur-containing amino acids. Curr. Opin. Plant Biol., 3, 188–195.
3) Gommers, C.M.M. (2019) Plastid sulfate transporters open doors to abiotic stress resistance. Plant Physiol., 180, 12–13.
4) Chen, Z., Zhao, P.X., Miao, Z.Q., Qi, G.F., Wang, Z., Yuan, Y., Ahmad, N., Cao, M.J., Hell, R., Wirtz, M., et al. (2019) SULTR3s function in chloroplast sulfate uptake and affect ABA biosynthesis and the stress response. Plant Physiol., 180, 593–604.
5) Ashykhmina, N., Lorenz, M., Frerigmann, H., Koprivova, A., Hofsetz, E., Stührwohldt, N., Flügge, U.I., Haferkamp, I., Kopriva, S., & Gigolashvilia, T. (2019) Papst2 plays critical roles in removing the stress signaling molecule 39-phosphoadenosine 59-phosphate from the cytosol and its subsequent degradation in plastids and mitochondria. Plant Cell, 31, 231–249.
6) Veljovic-Jovanovic, S., Oniki, T., & Takahama, U. (1998) Detection of monodehydroascorbic acid radical in sulfite-treated leaves and mechanism of its formation. Plant Cell Physiol., 39, 1203–1208.
7) Dietzen, C., Koprivova, A., Whitcomb, S.J., Langen, G., Jobe, T.O., Hoefgen, R., & Kopriva, S. (2020) The transcription factor EIL1 participates in the regulation of sulfur-deficiency response. Plant Physiol., 184, 2120–2136.
8) Liang, G., Yang, F., & Yu, D. (2010) MicroRNA395 mediates regulation of sulfate accumulation and allocation in Arabidopsis thaliana. Plant J., 62, 1046–1057.
9) Wirtz, M. & Hell, R. (2006) Functional analysis of the cysteine synthase protein complex from plants: Structural, biochemical and regulatory properties. J. Plant Physiol., 163, 273–286.
10) Marchand, C., Le Maréchal, P., Meyer, Y., & Decottignies, P. (2006) Comparative proteomic approaches for the isolation of proteins interacting with thioredoxin. Proteomics, 6, 6528–6537.
11) Bick, J.A., Setterdahl, A.T., Knaff, D.B., Chen, Y., Pitcher, L.H., Zilinskas, B.A., & Leustek, T. (2001) Regulation of the plant-type 5′-adenylyl sulfate reductase by oxidative stress. Biochemistry, 40, 9040–9048.
12) Gromes, R., Hothorn, M., Lenherr, E.D., Rybin, V., Scheffzek, K., & Rausch, T. (2008) The redox switch of γ-glutamylcysteine ligase via a reversible monomer-dimer transition is a mechanism unique to plants. Plant J., 54, 1063–1075.
13) Hothorn, M., Wachter, A., Gromes, R., Stuwe, T., Rausch, T., & Scheffzek, K. (2006) Structural basis for the redox control of plant glutamate cysteine ligase. J. Biol. Chem., 281, 27557–27565.
14) Balsera, M., Uberegui, E., Schürmann, P., & Buchanan, B.B. (2014) Evolutionary development of redox regulation in chloroplasts. Antioxid. Redox Signal., 21, 1327–1355.
15) Kang, Z., Qin, T., & Zhao, Z. (2019) Thioredoxins and thioredoxin reductase in chloroplasts: A review. Gene, 706, 32–42.
16) Hisabori, T., Sunamura, E.I., Kim, Y., & Konno, H. (2013) The chloroplast ATP synthase features the characteristic redox regulation machinery. Antioxid. Redox Signal., 19, 1846–1854.
17) Nikkanen, L., Toivola, J., & Rintamäki, E. (2016) Crosstalk between chloroplast thioredoxin systems in regulation of photosynthesis. Plant Cell Environ., 39, 1691–1705.
18) Schürmann, P. & Buchanan, B.B. (2008) The ferredoxin/thioredoxin system of oxygenic photosynthesis. Antioxid. Redox Signal., 10, 1235–1273.
19) Balmer, Y., Stritt-Etter, A.L., Hirasawa, M., Jacquot, J.P., Keryer, E., Knaff, D.B., & Schürmann, P. (2001) Oxidation-reduction and activation properties of chloroplast fructose 1,6-bisphosphatase with mutated regulatory site. Biochemistry, 40, 15444–15450.
20) Gütle, D.D., Roret, T., Müller, S.J., Couturier, J., Lemaire, S.D., Hecker, A., Dhalleine, T., Buchanan, B.B., Reski, R., Einsle, O., et al. (2016) Chloroplast FBPase and SBPase are thioredoxin-linked enzymes with similar architecture but different evolutionary histories. Proc. Natl. Acad. Sci. USA, 113, 6779–6784.
21) Trost, P., Fermani, S., Marri, L., Zaffagnini, M., Falini, G., Scagliarini, S., Pupillo, P., & Sparla, F. (2006) Thioredoxin-dependent regulation of photosynthetic glyceraldehyde-3-phosphate dehydrogenase: Autonomous vs. CP12-dependent mechanisms. Photosynth. Res., 89, 263–275.
22) Tominaga, J., Takahashi, S., Sakamoto, A., & Shimada, H. (2020) Arabidopsis BSD2 reveals a novel redox regulation of Rubisco physiology in vivo. Plant Signal. Behav., 15, 1740873.
23) Née, G., Zaffagnini, M., Trost, P., & Issakidis-Bourguet, E. (2009) Redox regulation of chloroplastic glucose-6-phosphate dehydrogenase: A new role for f-type thioredoxin. FEBS Lett., 583, 2827–2832.
24) Droux, M. (2004) Sulfur assimilation and the role of sulfur in plant metabolism: A survey. Photosynth. Res., 79, 331–348.
25) Foyer, C.H. & Noctor, G. (2011) Ascorbate and glutathione: The heart of the redox hub. Plant Physiol., 155, 2–18.
26) Ding, S., Jiang, R., Lu, Q., Wen, X., & Lu, C. (2016) Glutathione reductase 2 maintains the function of photosystem II in Arabidopsis under excess light. Biochim. Biophys. Acta Bioenerg., 1857, 665–677.
27) Zechmann, B. (2020) Subcellular roles of glutathione in mediating plant defense during biotic stress. Plants, 9, 1–21.
28) Vernoux, T., Wilson, R.C., Seeley, K.A., Reichheld, J.-P., Muroy, S., Brown, S., Maughan, S.C., Cobbett, C.S., Van Montagu, M., Inzé, D., et al. (2000) The ROOT MERISTEMLESS1/CADMIUM SENSITIVE2 gene defines a glutathione-dependent pathway involved in initiation and maintenance of cell division during postembryonic root development. Plant Cell, 12, 97–109.
29) Pasternak, T., Palme, K., & Paponov, I.A. (2020) Glutathione enhances auxin sensitivity in arabidopsis roots. Biomolecules, 10, 1–24.
30) Takahashi, H., Kopriva, S., Giordano, M., Saito, K., & Hell, R. (2011) Sulfur assimilation in photosynthetic organisms: Molecular functions and regulations of transporters and assimilatory enzymes. Annu. Rev. Plant Biol., 62, 157–184.
31) García, I., Romero, L.C., & Gotor, C. (2015) Cysteine homeostasis. in Amino Acids in Higher Plants (D’Mello, J.P.F., ed.), pp. 219–233, CABI.
32) Riemenschneider, A., Wegele, R., Schmidt, A., & Papenbrock, J. (2005) Isolation and characterization of a D-cysteine desulfhydrase protein from Arabidopsis thaliana. FEBS J., 272, 1291–1304.
33) Van Hoewyk, D., Pilon, M., & Pilon-Smits, E.A.H. (2008) The functions of NifS-like proteins in plant sulfur and selenium metabolism. Plant Sci., 174, 117–123.
34) Hatzfeld, Y., Maruyama, A., Schmidt, A., Noji, M., Ishizawa, K., & Saito, K. (2000) β-Cyanoalanine synthase is a mitochondrial cysteine synthase-like protein in spinach and Arabidopsis. Plant Physiol., 123, 1163–1171.
35) da Silva, C.J., Batista Fontes, E.P., & Modolo, L.V. (2017) Salinity-induced accumulation of endogenous H2S and NO is associated with modulation of the antioxidant and redox defense systems in Nicotiana tabacum L. cv. Havana. Plant Sci., 256, 148–159.
36) Jia, H., Chen, S., Liu, D., Liesche, J., Shi, C., Wang, J., Ren, M., Wang, X., Yang, J., Shi, W., et al. (2018) Ethylene-induced hydrogen sulfide negatively regulates ethylene biosynthesis by persulfidation of ACO in tomato under osmotic stress. Front. Plant Sci., 871, 1517.
37) Vlad, F., Rubio, S., Rodrigues, A., Sirichandra, C., Belin, C., Robert, N., Leung, J., Rodriguez, P.L., Laurière, C., & Merlot, S. (2009) Protein phosphatases 2C regulate the activation of the Snf1-related kinase OST1 by abscisic acid in Arabidopsis. Plant Cell, 21, 3170–3184.
38) Geiger, D., Scherzer, S., Mumm, P., Stange, A., Marten, I., Bauer, H., Ache, P., Matschi, S., Liese, A., Al-Rasheid, K.A.S., et al. (2009) Activity of guard cell anion channel SLAC1 is controlled by drought-stress signaling kinase-phosphatase pair. Proc. Natl. Acad. Sci. USA, 106, 21425–21430.
39) Sirichandra, C., Gu, D., Hu, H.C., Davanture, M., Lee, S., Djaoui, M., Valot, B., Zivy, M., Leung, J., Merlot, S., et al. (2009) Phosphorylation of the Arabidopsis AtrbohF NADPH oxidase by OST1 protein kinase. FEBS Lett., 583, 2982–2986.
40) Saito, S. & Uozumi, N. (2019) Guard cell membrane anion transport systems and their regulatory components: An elaborate mechanism controlling stress-induced stomatal closure. Plants, 8, 9.
41) Singh, R., Parihar, P., Singh, S., Mishra, R.K., Singh, V.P., & Prasad, S.M. (2017) Reactive oxygen species signaling and stomatal movement: Current updates and future perspectives. Redox Biol., 11, 213–218.
42) Scuffi, D., Álvarez, C., Laspina, N., Gotor, C., Lamattina, L., & García-Mata, C. (2014) Hydrogen sulfide generated by L-cysteine desulfhydrase acts upstream of nitric oxide to modulate abscisic acid-dependent stomatal closure. Plant Physiol., 166, 2065–2076.
43) Wang, L., Wan, R., Shi, Y., & Xue, S. (2016) Hydrogen sulfide activates S-type anion channel via OST1 and Ca2+ modules. Mol. Plant, 9, 489–491.
44) Chen, S., Jia, H., Wang, X., Shi, C., Wang, X., Ma, P., Wang, J., Ren, M., & Li, J. (2020) Hydrogen sulfide positively regulates abscisic acid signaling through persulfidation of SnRK2.6 in guard cells. Mol. Plant, 13, 732–744.
45) Shen, J., Zhang, J., Zhou, M., Zhou, H., Cui, B., Gotor, C., Romero, L.C., Fu, L., Yang, J., Foyer, C.H., et al. (2020) Persulfidation-based modification of cysteine desulfhydrase and the NADPH oxidase RBOHD controls guard cell abscisic acid signaling. Plant Cell, 32, 1000–1017.
46) Zhou, M., Zhang, J., Shen, J., Zhou, H., Zhao, D., Gotor, C., Romero, L.C., Fu, L., Li, Z., Yang, J., et al. (2021) Hydrogen sulfide-linked persulfidation of ABI4 controls ABA responses through the transactivation of MAPKKK18 in Arabidopsis. Mol. Plant, 14, 921–936.
47) Bittner, F., Oreb, M., & Mendel, R.R. (2001) ABA3 Is a Molybdenum Cofactor sulfurase required for activation of aldehyde oxidase and xanthine dehydrogenase in arabidopsis thaliana. J. Biol. Chem., 276, 40381–40384.
48) Álvarez, C., García, I., Moreno, I., Pérez-Pérez, M.E., Crespo, J.L., Romero, L.C., & Gotor, C. (2012) Cysteine-generated sulfide in the cytosol negatively regulates autophagy and modulates the transcriptional profile in arabidopsisw. Plant Cell, 24, 4621–4634.
49) Laureano-Marín, A.M., Moreno, I., Romero, L.C., & Gotor, C. (2016) Negative regulation of autophagy by sulfide is independent of reactive oxygen species. Plant Physiol., 171, 1378–1391.