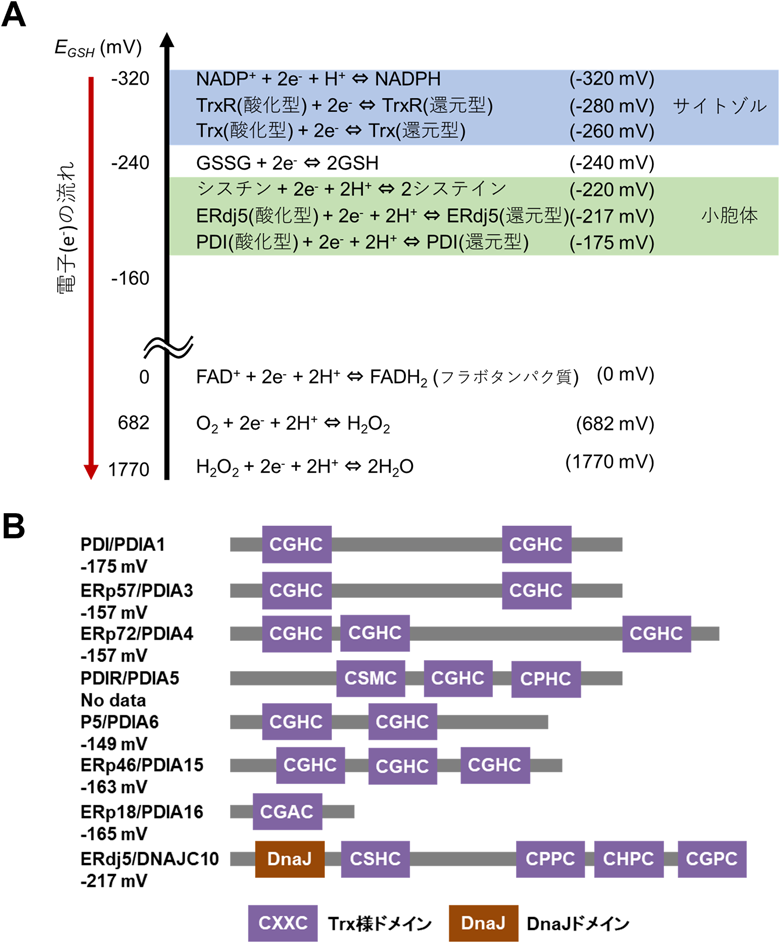
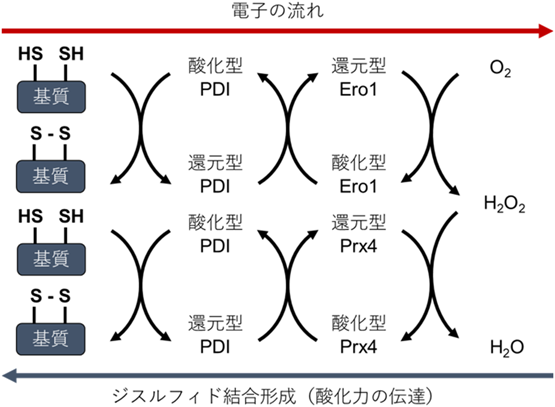
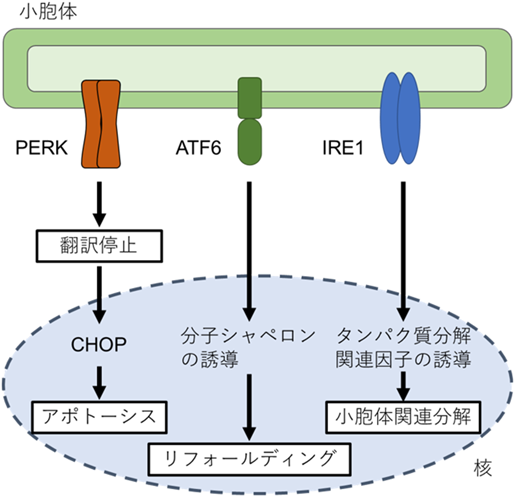
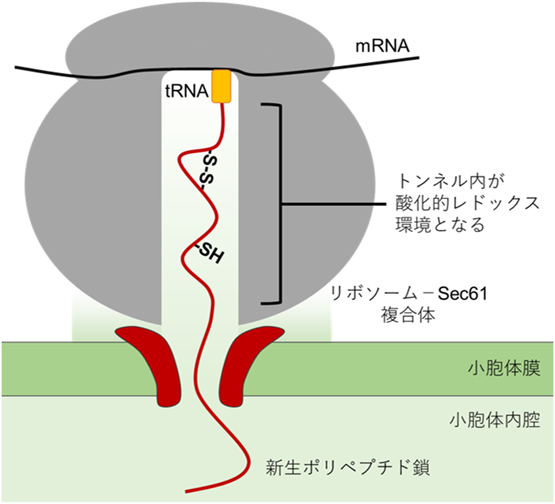
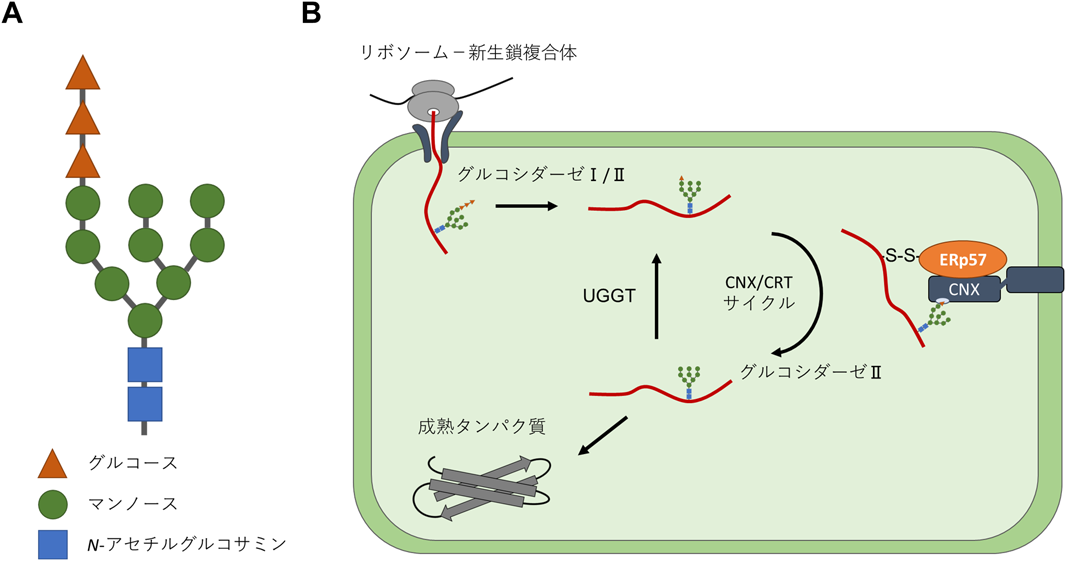
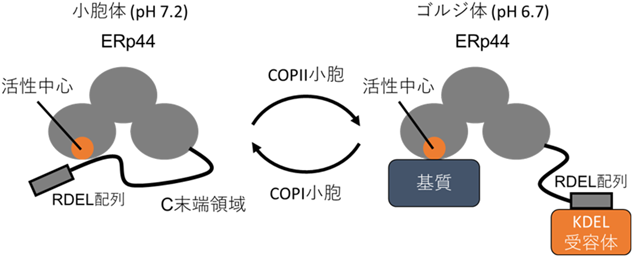
タンパク質品質管理を支える小胞体レドックス環境と電子伝達Redox environment and electron transfer for protein quality control in the endoplasmic reticulum
京都産業大学生命科学部/京都産業大学タンパク質動態研究所Faculty of Life Sciences, Kyoto Sangyo University/Institute for Protein Dynamics, Kyoto Sangyo University ◇ 〒603–8555 京都市北区上賀茂本山 ◇ Kamigamo motoyama, Kita-ku, Kyoto 603–8555, Japan