45億年前に誕生した地球はヘリウムや水素からなる高圧高温の大気に包まれていたが,徐々に水やさまざまな有機化合物が生成し,38億年前ごろ最初の生命が誕生したと考えられている.原始の生物は,硫化水素やメタンを電子供与体として利用するという現在の熱水噴出孔に棲息する化学合成細菌と類似のエネルギー代謝を営んでいたと考えられる1).酸素がほとんど存在していない太古代の地球では,硫酸塩還元菌が繁栄し,硫酸や亜硫酸を還元して硫化水素を産生していたことが明らかになっている2).25億年前あたりには硫化水素に富んだ海洋環境が形成され,現在の紅色硫黄細菌や緑色硫黄細菌と類似した原始的な光合成生物が,硫化水素(H2S)を電子供与体として利用して光合成を営んでいたと考えられる.その後,進化した光合成系を有するシアノバクテリアが出現し,水(H2O)を電子供与体として利用したことにより酸素が大気中に蓄積した.いわゆるGreat Oxygen Eventである.6~5億年ほど前になると,現在と同様に大気の20%を酸素が占めるようになり,酸素を電子受容体として利用することで効率的にエネルギー代謝を営む生物が繁栄するに至ったとされる3).
酸素の利用により,生物は栄養素から効率的にエネルギーを獲得することができるようになった一方で,酸素による毒性にもさらされることになった.タンパク質や脂質,核酸といった生体を構成する分子が非酵素的に酸化され,その機能喪失あるいは機能変化は生体機能の低下をもたらす.長年にわたる酸素への曝露から生じる不可逆的な生体分子の変化は,老化の分子基盤として大きく貢献している4).こうした酸素の毒性,すなわち,酸化ストレスに対する防御機構として重要なのがKEAP1-NRF2制御系である5).KEAP1-NRF2制御系の機能不全はさまざまな疾患への感受性を高め,その機能強化は疾患に対する抵抗性を賦与するとともに,抗老化作用も発揮することが明らかになってきた.本稿では,KEAP1-NRF2制御系の作動メカニズムについての最新の知見を紹介するとともに,生体の恒常性維持と疾患予防・抗老化における役割,さらに,近年明らかになってきた硫黄代謝への貢献を紹介する.
2. 生体の酸化ストレス応答機構KEAP1-NRF2制御系
KEAP1-NRF2制御系は脊椎動物,ショウジョウバエを含む生物種で広く保存されており,多くの生物種の生体防御において中心的な役割を果たしている5).線虫ではNRF2のホモログとしてSkn1が存在するが,KEAP1のホモログは見いだされていない.しかし,基本的な酸化ストレス応答機構として,Skn1はNRF2とほぼ同じ役割を果たしているとみなすことができる6, 7).
NRF2は塩基性領域−ロイシンジッパー(basic region-leucin zipper:bZip)構造を有する強力な転写活性化因子であり,小MAF因子とヘテロ二量体を形成することでDNA配列に結合する.その認識配列は,抗酸化応答配列(anti-oxidant response element:ARE)と呼ばれ,NRF2の標的遺伝子のプロモーター領域やエンハンサー領域に存在する.NRF2の強力な転写活性化は,複数の転写共役因子との相互作用により実現されている.ヒストンアセチルトランスフェラーゼであるCBPやp300と相互作用することで,NRF2はその結合部位周辺のヒストンのアセチル化を促進し,クロマチンの活性化を促す8).また,SWI/SNF複合体のサブユニットであるBRG1との結合によりクロマチンリモデリングを促進する9).さらに,メディエーター複合体のサブユニットであるMED16と直接結合することにより,メディエーター複合体をリクルートし,RNAポリメラーゼIIへ転写活性化シグナルを伝達する10).こうして,NRF2はクロマチンの活性化を伴い強力な転写活性化を誘導する.その標的遺伝子には,抗酸化タンパク質やグルタチオン合成酵素,グルタチオン分解酵素,グルタチオン抱合酵素に加えて,薬剤トランスポーターなども多く含まれている.これによりNRF2の活性化は,細胞に酸化ストレスに対する耐性を賦与し,かつ,解毒機能を増強させることで薬剤や化学物質,活性酸素種の毒性からの回避を可能にする11, 12).
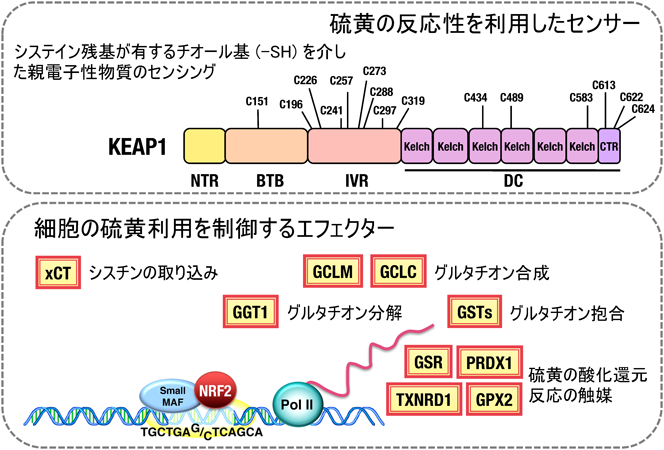
NRF2による遺伝子発現制御機構の最も重要な特徴は,誘導的という点である.細胞に対して酸化ストレスや親電子ストレスが負荷された場合に,NRF2の強力な転写活性化が誘導されて,標的遺伝子を活性化する.この誘導性の鍵を握るのが,KEAP1である.KEAP1はCUL3を含むユビキチンE3リガーゼの基質認識サブユニットであり,特段のストレスが存在しない状態ではNRF2を常に分解に導いている.KEAP1は細胞質に局在して,ホモ二量体を形成し,ちょうど,「さくらんぼ」のような形をしていることが,電子顕微鏡を用いた単粒子解析により明らかにされている13).二量体を形成したKEAP1の「さくらんぼ」の二つの房の間を橋渡しするようにNRF2のアミノ末端領域(Neh2ドメイン)が結合し,ユビキチン化を受けることで,NRF2はプロテアソームで分解される.こうしたNRF2の分解にはKEAP1の二量体形成が必要であること14),NRF2のNeh2ドメインに存在する2か所のKEAP1結合モチーフの両方がいずれも必要であること15, 16)が示されている.したがって,二量体を形成したKEAP1に1分子のNRF2が結合した構造が,NRF2のユビキチン化とそれに続く分解をもたらし,非刺激下でのNRF2機能を抑制しているといえる.ひとたび,細胞に酸化ストレスや親電子ストレスが負荷されると,KEAP1はこれらの刺激を鋭敏に感知して,ユビキチンE3リガーゼとしての機能を失い,NRF2を安定化させる.KEAP1の鋭敏なセンサー機能の基盤をなすのが硫黄の反応性である.KEAP1にはシステイン残基が多く,なかでも,反応性の高いチオール基を有するとされる塩基性アミノ酸に隣接するシステイン残基が多いのが特徴である.反応性の高いKEAP1のチオール基が活性酸素種や親電子性物質と速やかに反応し,NRF2の分解が停止する17).安定化したNRF2は抗酸化タンパク質や解毒酵素,トランスポーターを誘導し,細胞を構成する他のタンパク質や脂質などの生体分子を,活性酸素種や親電子性物質による障害から守る.
このように,KEAP1はチオール基の高い反応性により,鋭敏なセンサーとしての役割を果たすことが可能になっている.一方,NRF2が制御する遺伝子群を俯瞰すると,その多くが,細胞のシステイン利用や,硫黄原子が関与する酸化還元反応の触媒反応に関与するものであることに気づく.すなわち,KEAP1-NRF2制御系は,硫黄の反応性を利用した生体防御機構であるといえる(図1).
KEAP1がどのようにして多様な親電子性物質を感知しているのか,そのメカニズムは大変興味深い.KEAP1が有するシステイン残基のチオール基のうち,KEAP1の活性制御に特に重要な役割を担っているものがこれまでに七つ同定されており,KEAP1は,刺激の種類によりセンサーとして利用するチオール基を使い分けている18).一つは,KEAP1のBTBドメインに存在するCys151である.このシステインをセリンに置換すると,KEAP1は親電子性物質であるDEM(ジメチルマレイン酸)やトリテルペノイドであるCDDO-Imなどに対する応答性を失い,NRF2をユビキチン化し続ける19).Cys151をかさ高いアミノ酸であるトリプトファンに置換すると,KEAP1はNRF2のユビキチン化ができなくなり,NRF2は安定化する20, 21).親電子性を有する化学物質がCys151のチオール基に結合することにより,CUL3との結合が阻害されて,CUL3-KEAP1複合体によるNRF2のユビキチン化活性が抑制されることが示されている22).一方,KEAP1のIVRドメインに存在するCys273とCys288は,Cys151とはまったく異なる特性を示す23).これらをセリンやアラニンに置換すると,KEAP1は失活してNRF2のユビキチン化ができなくなるが,トリプトファンやアルギニン,グルタミン酸といったかさ高いアミノ酸に置換すると,KEAP1は活性を維持したまま応答性を失う.ちょうど,Cys151の性質とは逆である.Cys273とCys288は,プロスタグランジンである15d-PGJ2に対する応答性に必要であることが示されているが,Cys273とCys288を介するセンシング機能の構造的な基盤は不明である.これら三つのシステイン残基には親電子性物質がチオール基に結合することが観察されているが,過酸化水素のようないわゆる活性酸素種がどのようにKEAP1によって感知されているのかはながらく不明であった.最近,四つのシステイン残基,Cys226, Cys613, Cys622, Cys624がチオール基のジスルフィド結合形成を介してKEAP1の活性を抑制することが明らかになった18).以上のように,KEAP1は硫黄の反応性を利用したマルチモードセンサーであるといえる.
NRF2の生体防御機構を考えれば,その機能低下がさまざまな疾患に対する感受性を高めることは容易に想像できる.実際,Nrf2欠損マウスは,種々のストレスに対して脆弱である.たとえば,タバコ煙への曝露により,肺気腫様の病態が重篤化したり24, 25),排気ガスへの曝露により核酸の酸化障害が重篤化したり12),アセトアミノフェンによる肝毒性が重篤化したり11),というように,外界からの化学的ストレス,すなわち,親電子性物質に対する障害が起こりやすくなる.また,脳や心臓,腎臓などの虚血再灌流障害が重篤化したり26–28),膵臓のβ細胞の脆弱性から糖尿病が悪化したり29, 30),騒音がもたらす内耳の酸化ストレスが増加することで騒音性難聴が悪化したり31),など内因性に発生する酸化ストレスによる障害の重篤化も認められる.最近では,宇宙環境における微小重力がもたらすストレスに対しても,Nrf2欠損マウスの脆弱性が報告されている32).一方,NRF2の活性化はさまざまなストレスに対する抵抗力を増強し,健康維持にとってより好ましい状態をもたらすことが示されている.NRF2の抑制性制御因子であるKEAP1の発現を低下させたマウスでは,アセトアミノフェンの肝毒性が抑制され33),発がん物質の投与によるがんの発症も抑制される34).また,NRF2の活性化は,運動機能の改善をもたらすことも報告されている35).骨格筋でKeap1遺伝子を抑制してNRF2を活性化させたマウスでは,骨格筋のミトコンドリア機能が活性化するとともに全身の脂肪酸代謝が促進され,それに伴って持久力が向上することが観察されている36).
NRF2には強力な抗炎症作用があることも示されている.全身でNRF2が活性化状態にあるKeap1ノックダウンマウスでは,実験的自己免疫性脳脊髄炎の改善が認められたり37),制御性T細胞の分化障害による自己免疫疾患状態の緩和がみられたり38),と過剰な免疫応答が抑制されることで病態が改善する.一方,Nrf2欠損マウスでは,カラギーナン誘発性の胸膜炎が重篤化し39),エラスターゼ誘発性の慢性閉塞性肺疾患モデルの重篤化が認められる40).
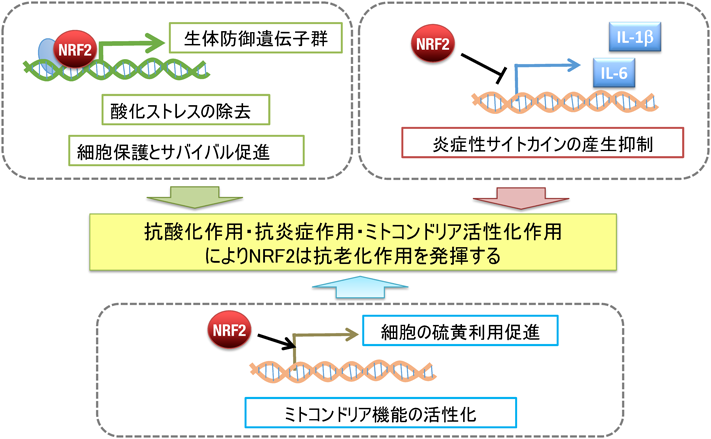
このように,NRF2の活性化は,抗酸化・解毒機能による細胞保護作用,抗炎症作用,そして,ミトコンドリアの活性化作用を有することがわかる.個体の老化において,酸化ストレスの増大,慢性的な微弱な炎症の持続,ミトコンドリア機能の低下がしばしば認められるとされることを鑑みると,NRF2は抗老化作用を発揮することが期待される.そこで,我々は,代表的な加齢関連疾患としてアルツハイマー病に,生理的な臓器の老化過程として唾液腺と内耳に着目して,NRF2が有する抗老化作用の検証を行った.全身でNRF2が活性化状態にあるKeap1ノックダウンマウスを用いて,アルツハイマー病モデルマウスの表現型の改善があるか,高齢になったときに現れる唾液腺や内耳の加齢変化に遅延がみられるかを検討した.
我々が用いたアルツハイマー病モデルマウスであるAppNL-GF/NL-GFマウス41)では,Keap1ノックダウンマウスとの交配により,中枢神経系における酸化ストレスマーカーの低下,還元型グルタチオンの増加,活性型ミクログリアの抑制,炎症性サイトカインの発現抑制がみられ,受動回避試験によるマウスの記憶力に改善が認められた42).興味深いことに,アミロイドβの蓄積自体には変化がなかった.これは,蓄積したアミロイドβ自体ではなく,それに対するミクログリアの応答が病態の形成に重要な役割を担っていることを示唆しており,NRF2の活性化は,そうした細胞の応答を改変することで,病態の改善効果をもたらしたと考えられる.
C57BL/6系統のマウスの唾液腺は,特に顎下腺が加齢に伴い顕著な変化をみせる.19~24か月齢のマウスの唾液腺では,4~5か月齢のものに比較して,いわゆる細胞老化マーカーとして知られるp19やp16の発現が著増する.しかし,Keap1ノックダウンマウスでは,加齢に伴うこのような細胞老化マーカーの発現上昇は認められなかった.また,組織学的には,加齢に伴い,顎下腺の線維化,鉄の沈着,炎症細胞の浸潤,DNA損傷マーカーとして知られるγH2AX陽性像の増加,アポトーシスの増加,さらに,過酸化脂質である4HNE(4-hydroxynonenal)や核酸の酸化体である8OHdG(8-hydroxydeoxyguanosine)の増加が認められるが,Keap1ノックダウンマウスではこれらすべての指標において抑制が認められた43).したがって,NRF2の活性化は唾液腺の老化を遅延させることができたと考えられる.
また,C57BL/6系統のマウスでは,12か月齢までに聴力が低下し,いわゆる加齢性難聴の発症が認められる.しかし,Keap1ノックダウンマウスでは12か月齢でも聴力が維持されていることがわかった.詳細に解析したところ,12か月齢の野生型マウスでは内耳の感覚細胞である外有毛細胞が多数脱落するのに対して,12か月齢のKeap1ノックダウンマウスでは,外有毛細胞がきわめてよく維持されていた.そして,加齢に伴い認められる4HNEや8OHdGといった酸化ストレスの指標の内耳全体での増加が,Keap1ノックダウンマウスでは顕著に抑制されていた44).これらの結果より,内耳のNRF2活性化はその加齢に伴う感覚細胞の脱落を抑制し,聴力の維持を可能にしたといえる.
以上のように,NRF2の活性化は抗老化作用を有するといえる(図2).ミトコンドリア機能へのNRF2の貢献の詳細にはまだ不明な点が多いが,我々は最近NRF2による硫黄代謝制御がミトコンドリア機能の活性化に重要であることを見いだしつつある.この点については,後述する.
NRF2は,前述のとおり我々の健康維持・健康増進をもたらす因子であり,抗老化作用により健康長寿実現のための鍵となる因子であると考えられる.しかし,一方で,多くのヒトのがん細胞で,NRF2の異常な活性化が認められており,がんの悪性化をもたらしていることも明らかになっている45).NRF2による転写制御において重要な性質である誘導性が,NRF2の分解制御の破綻により失われて,恒常的なNRF2の安定化が起こった状態では,NRF2の標的遺伝子である生体防御系遺伝子群が常に高いレベルの発現を維持している.そのため,NRF2の恒常的な活性化がみられるがん細胞は,抗がん剤や放射線などに対して耐性を示し,治療抵抗性を獲得している46).
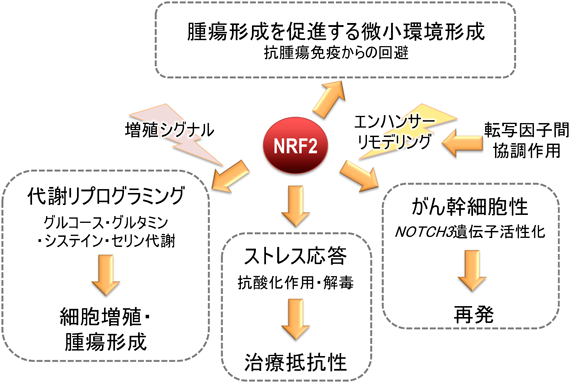
本来,KEAP1と結合することにより分解されるはずのNRF2が恒常的に安定化している主な原因としては,KEAP1遺伝子やNRF2(NFE2L2)遺伝子の体細胞変異が挙げられる47, 48).非小細胞性肺がんや,頭頚部がん,膀胱がんなど,外界にさらされている臓器に発生する固形腫瘍に多く認められるという特徴がある.KEAP1遺伝子変異は,KEAP1タンパク質をコードする領域の全長にわたり認められるが,NRF2(NFE2L2)遺伝子変異は,NRF2タンパク質のアミノ末端領域,KEAP1との結合に必要なNeh2ドメインに集中して認められる.KEAP1の体性変異はその不活性化をもたらし,その結果,NRF2が分解されずに蓄積する.NRF2(NFE2L2)遺伝子の体性変異では,KEAP1に結合できないものの転写因子としての機能は保たれたNRF2変異体が産生され,NRF2の標的遺伝子が恒常的に活性化される.その他,NRF2のユビキチン化に必要なCUL3遺伝子の不活性化変異49),NRF2のエクソンスキッピングによるNeh2ドメインの欠失50),KEAP1遺伝子のメチル化による発現抑制51)などがある.また,KEAP1とNRF2の結合を阻害するタンパク質の蓄積が起こっている場合もある.選択的オートファジーのアダプタータンパク質であるp62/SQSTM1は,リン酸化を受けるとNRF2のNeh2ドメインと競合してKEAP1に結合する.肝細胞がんでは,しばしばこうしたリン酸化p62/SQSTM1の蓄積が認められており,NRF2の恒常的安定化が認められる52, 53).さらに,オンコメタボライトと呼ばれるがん細胞で特徴的に蓄積する代謝物によりKEAP1が失活してNRF2が安定化することもある.糖代謝経路であるクエン酸サイクルの酵素,フマル酸ヒドラターゼの失活変異は,遺伝性平滑筋腫症−腎細胞がん症候群の原因である.フマル酸ヒドラターゼの失活によりフマル酸が蓄積するが,フマル酸は弱いながらも親電子性を有するため,KEAP1のチオール基に結合して失活させ,NRF2の蓄積をもたらす54, 55).このように,NRF2が恒常的に活性化しているがん細胞は,治療抵抗性をはじめとして,旺盛な細胞増殖や腫瘍形成能力,がん幹細胞性の維持,転移能,さらには,抗腫瘍免疫の回避など,がんの悪性化に関わる特性をすべてNRF2に依存している(図3).そこで,我々は,このようながん細胞をNRF2依存性がん細胞と定義し,その悪性化機構の解析を進めてきた.
最も理解しやすいメカニズムは,治療抵抗性の賦与である.NRF2が本来有している抗酸化機能と解毒代謝促進作用を鑑みれば,がん細胞中で活性化したNRF2が,抗がん剤や放射線からがん細胞を保護する,すなわち,治療に対して抵抗性を与えることは想像に難くない.しかし,NRF2依存性がん細胞は,治療の有無にかかわらず,増殖が盛んであり,かつ,腫瘍形成能も旺盛である.こうした旺盛な細胞増殖の基盤には,がん細胞における代謝の改変がある56).健康な生体におけるNRF2の活性化は,発がん性物質の解毒を促進することにより化学発がんを抑制する一方,ひとたびがん化してしまった細胞においては,NRF2ががんの増殖と腫瘍形成を促進することが報告された34, 57).NRF2の標的遺伝子に,細胞周期に直接かかわるものは報告されておらず,そのメカニズムは不明であった.我々は,がん細胞におけるNRF2の標的遺伝子を詳細に検討したところ,グルコース代謝経路の一つであるペントースリン酸経路を触媒する酵素がNRF2により直接制御されていることを見いだした56).それに加えて,グルタチオン合成系やグルタミノリシスとして,グルタミンの利用も促進されていることがわかった.また,NRF2はATF4の発現増加をもたらすことでセリン合成経路も活性化することが報告された58).セリンから生成するグリシンはグルタチオン合成に,一炭素ユニットはさまざまなメチル化反応に利用される.こうした代謝系酵素遺伝子へのNRF2の関与は,増殖シグナルが活性化している状態で特に強化されることも明らかになった56).すなわち,増殖の盛んながん細胞ではNRF2の機能拡張が起こり,グルコースやグルタミンの代謝の改変がもたらされて,増殖に有利な状態が成立しているといえる.
NRF2依存性がんは,旺盛な腫瘍形成に加えて,転移や再発が高頻度にみられることも報告されている59).NRF2依存性肺がんでは,ヘムオキシゲナーゼの発現が増加することで細胞のヘムが減少し,それに伴い,ヘム依存的にFbxo22により分解されるはずのBACH1が増加する.BACH1は,がん細胞の上皮−間葉転換を促進することで転移を促す性質があるとされており60),NRF2依存性がんはBACH1の増加を介して転移を促進することが示された61).また,NRF2依存性肺がんでは,いわゆるがん幹細胞性が亢進していることが示されている62, 63).NRF2依存性肺がんでは,エンハンサー・リモデリングによりNRF2が正常細胞とは異なる標的遺伝子を獲得しており,その一つであるNOTCH3がNRF2依存性がんの幹細胞性を強化している63).NRF2依存性肺がんで特に発現が亢進しているCEBPBがNRF2と協調して作用することにより,NRF2依存性肺がんに特異的なエンハンサー形成がなされ,NOTCH3遺伝子が活性化されることが明らかになった.
このように,NRF2は多方面からがんの悪性化をもたらしているが,最近では抗腫瘍免疫の抑制もその原因の一つであることが示唆されている.NRF2依存性がんのモデル実験では,NRF2依存性がんから得られる腫瘍では,免疫関連の遺伝子発現の激減が観察されている64).また,臨床検体の解析からも,NRF2依存性がん症例ではTリンパ球の腫瘍内浸潤が抑制される傾向にあること65),免疫チェックポイント阻害剤の効果が得られにくいこと66)が報告されている.がん細胞の中でNRF2が活性化することが,なぜ抗腫瘍免疫の回避につながるのかはいまだ不明である.我々は,NRF2依存性がん細胞に発現する細胞膜タンパク質や,そこから分泌される代謝物やエクソソームに何らかの手がかりがあると予想し,解析を進めている.また,グルコースをめぐるがん細胞とTリンパ球の代謝競合が報告されているが67),NRF2依存性がん細胞は,大量のシスチンを消費するとともに,グルタミン酸を放出することが観察されている68).こうした代謝物の出入りが,腫瘍微小環境に影響を与えている可能性もある.
がんの悪性化を強力にドライブするNRF2は,がん遺伝子かというと,答えはNOである.正常細胞あるいは正常な個体でNRF2を活性化させるだけでは,決して細胞はがん化に至らない.たとえばマウスの造血幹細胞では,Keap1遺伝子を欠損してNRF2が恒常的に活性化すると分化が促進されて枯渇してしまう69).必要なときにだけ一過性に機能するはずのNRF2が,その分解制御の破綻により常に安定化して機能し続けることは,正常な細胞にとってはかならずしも好ましいことではないと考えられる.NRF2依存性がん細胞は,NRF2の恒常的な安定化がもたらすデメリットを代償するための別経路をうまく利用できている細胞であるといえる.NRF2依存性がんの最も顕著な特性は,強い抗酸化機能・解毒機能の基盤をなしているグルタチオン合成の促進である.最近の研究から,グルタチオン合成の極度の亢進が,NRF2依存性がん細胞の治療抵抗性を支えると同時に,代償が必要なデメリットにもなっていることがわかってきた.
グルタチオンは,グルタミン酸とシステイン,グリシンの3アミノ酸からなるトリペプチドで,生体における抗酸化機能と解毒機能においてきわめて重要な役割を担っている.NRF2はグルタチオン合成経路の律速段階であるγ-グルタミルシステイン合成酵素の触媒サブユニットGCLCと調節サブユニットGCLMの両方を直接の標的遺伝子として活性化する.また,シスチントランスポーターxCTをコードするSLC7A11遺伝子も直接の標的遺伝子としており,これは,グルタチオン合成の材料として必要なシステインの補給に貢献している.NRF2の強力な活性化は大量のシスチンの取り込みとグルタチオン合成をもたらす一方,グルタミン酸の欠乏をもたらす.なぜなら,xCTはシスチンとグルタミン酸のアンチポーターであり,シスチンを取り込むと同時にグルタミン酸を排出するし,グルタチオン合成によってもグルタミン酸が消費されるからである.そのため,NRF2活性化状態を維持するためには,グルタミン酸の補給が必要となる.実際,NRF2依存性がん細胞では,グルタミンのトランスポーターであるSLC1A5を高発現しており,グルタミンからグルタミン酸の生成を触媒するグルタミナーゼの活性に依存していることが報告されている70).また,NRF2の活性化により,ペントースリン酸経路をはじめとしてNADPH産生に関わる酵素が一挙に誘導され,細胞は還元的な環境に傾くことから,還元ストレスが発生する恐れがある.実際に,a-Bクリスタリン遺伝子の変異で産生される変異型a-Bクリスタリンタンパク質がKEAP1に結合することでNRF2が恒常的に活性化してしまうことが知られている遺伝性心筋症では,還元ストレスが発生してタンパク質の凝集体ができてしまうことが病因となっている71).興味深いことに,こうした病態はNRF2の抑制により改善する72).すなわち,NRF2が恒常的に活性化するということは,還元ストレスを発生させて小胞体(ER)ストレスをもたらすため,NRF2依存性がんは,そうした状況も回避する必要がある.実際,NRF2依存性がんはERストレスを抑制するSLC33A1に依存しており,SLC33A1の阻害により発生するERストレスは,グルタチオン合成阻害によりキャンセルされることが示されている73).これらはNRF2の恒常的な活性化がもたらすグルタチオン合成の極度の亢進を代償するメカニズムであると理解できる.NRF2依存性がんが有する強力な抗酸化機能と解毒機能は,このような代謝の代償により支えられており,これらが機能して初めてNRF2依存性がんが成立するといえよう.
5. NRF2による硫黄代謝制御とミトコンドリア機能への貢献
NRF2が,ミトコンドリアの活性化作用を有することはすでに複数の研究者により報告されている74, 75).我々も,最近,NRF2の活性化が運動機能を改善することを受け35),そのメカニズムの検討を行ったところ,NRF2によるミトコンドリア機能の改善を確認した36).骨格筋特異的にKeap1遺伝子を欠失してNRF2が活性化しているマウスを作製したところ,運動機能,特に,持久力の向上が観察された.この効果は,雄マウスよりも雌マウスの方で明確であった.NRF2が活性化した骨格筋では,ミトコンドリアタンパク質であるチトクロームcのタンパク質量が増加し,ミトコンドリアを多く含むI型のミオシン重鎖を発現する筋繊維の割合が増加していた.また,ミトコンドリア活性を評価するために,コハク酸脱水素酵素活性を調べるとNRF2が活性化した骨格筋の方で,より活性が高いことがわかった.また,実際に骨格筋でNRF2が活性化すると酸素消費も増加することが報告されている35).こうしたミトコンドリア機能の増加は,脂肪酸のβ酸化活性の上昇とも相関しており,骨格筋のNRF2は,何らかの液性因子,あるいは神経性因子を介して,代謝臓器からの脂肪酸動員を促進して,ミトコンドリアでのβ酸化により効率的なエネルギー産生を可能にしていると考えられる.NRF2がどのようにミトコンドリア機能を増強するのかについては,まだ十分理解されるには至っていない.我々は,その手がかりとして,ミトコンドリアにおける硫黄代謝に着目している.
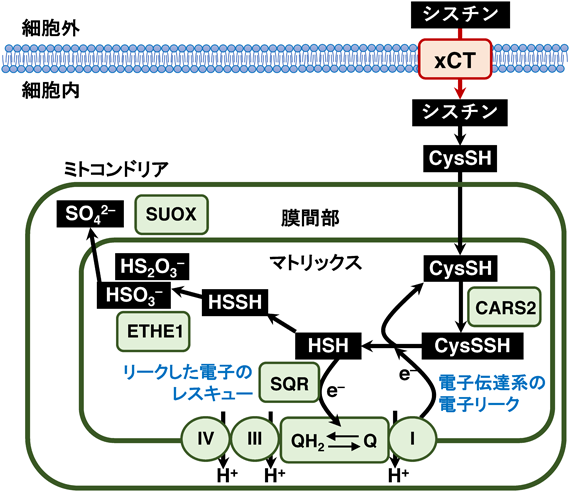
近年,質量分析装置を用いた分析技術の発展により,システインのチオール基(–SH)に過剰な硫黄原子が付加されたパースルフィド(–SSH)やポリスルフィド(–SSnH)と呼ばれる代謝物が,生体内に想定以上に豊富に存在することが明らかになった76, 77).このように硫黄原子が直鎖状に連結した状態はカテネーションと呼ばれ,硫黄カテネーションを有する代謝物やタンパク質を「超硫黄分子」と呼ぶ.超硫黄分子はユニークな反応性を有しており,生体内のエネルギー代謝やシグナル伝達などにおいて重要な貢献を果たしていることが明らかにされている77–79).従来,硫化水素の生理作用とされてきたことのうちかなりの部分が,超硫黄分子の生理作用であり,硫化水素は測定時の操作に伴う超硫黄分子の分解産物である可能性がきわめて高くなっている80).超硫黄分子の産生には,これまで硫化水素の産生酵素とされてきたシスタチオニンγ-リアーゼ(CSE)やシスタチオニンβ-シンターゼ(CBS)に加えて,システイニルtRNA合成酵素(CARS)が大きく貢献していることが明らかになった77).CARSはシステイニルtRNAの合成を行う一方,異なる活性中心を用いてシステインからシステインパースルフィドの産生を触媒する.特に超硫黄化タンパク質の産生に重要で,タンパク質の成熟や機能変換などに寄与が大きいと考えられる.一方,ミトコンドリア型のシステイニルtRNA合成酵素であるCARS2は,システインパースルフィドやグルタチオンパースルフィドなど,超硫黄化代謝物の産生への寄与が大きいと考えられる.こうした低分子の超硫黄分子は,抗酸化作用や抗炎症作用を有しており,また,ミトコンドリアのエネルギー代謝にも重要である76, 77, 79).
培養細胞でCARS2を抑制すると,超硫黄化代謝物が減少し,ミトコンドリアの膜電位も低下する77).ミトコンドリア電子伝達系を阻害すると,硫化水素が減少して超硫黄化代謝物が増加する77)ことから,ミトコンドリアの超硫黄分子は電子伝達系から電子を受容して硫化水素を発生させていると解釈できる.すなわち,超硫黄分子は酸素とともに,ミトコンドリアにおける電子受容体として機能するといえる.超硫黄分子の電子受容に伴い発生する硫化水素は,硫化水素の代謝酵素SQRにより酸化され,電子とプロトンは,電子伝達系のユビキノンに渡される(図4).硫黄はさらにETHE1やSUOXなどのミトコンドリア内の硫黄酸化酵素により酸化されて,チオ硫酸,亜硫酸,硫酸として排出される81).ミトコンドリアの膜電位形成は,CARS2による超硫黄分子の産生とSQRやETHE1による硫黄の酸化経路と共役しており,硫黄酸化経路の阻害によっても膜電位の低下がみられる.我々は,CARS2による超硫黄産生を抑制すると活性酸素種のレベルが大きく増加することを見いだしている(未発表).超硫黄分子は電子伝達系からリークする電子を受け取ることで,リークした電子が酸素に受容されることによる活性酸素種の発生を防いでいるものと考えられる.こう考えると,SQRによる硫化水素の酸化は,リークした電子をレスキューしてユビキノンに渡して電子伝達系へ戻す役割を担っていると捉えることができる.
NRF2の活性化は,シスチントランスポーターxCTを増加させて,シスチンを多く取り込むことができることから,細胞の硫黄利用を促進するといえる.したがって,NRF2は,細胞のシスチン取り込みを促進し,ミトコンドリアの硫黄代謝系により多くのシステインを供給することにより,超硫黄分子の産生を増加させてミトコンドリアの電子伝達系の電子リークを抑制して電子伝達の効率を向上させて,膜電位形成を促進するものと考えられる.
最近,個体の老化に伴い,超硫黄分子が減少し,硫黄の酸化物が増加することが報告された82).加齢に伴い,超硫黄分子の産生の低下と消費の増加が起こるものと予想される.超硫黄分子が有する抗酸化作用,抗炎症作用,そしてミトコンドリアの活性化作用を鑑みれば,超硫黄分子の適切な補充が抗老化作用をもつことが期待される.こうした超硫黄分子の作用はNRF2の活性化がもたらす作用と類似しており,NRF2による抗老化作用はこのような超硫黄分子の作用を介しているのかもしれない.一方,NRF2が恒常的に活性化しているNRF2依存性がんにおいては,NRF2による硫黄代謝制御が改変されており,ミトコンドリア機能への貢献は正常細胞におけるものとはかなり様相が異なることがわかってきた.糖代謝や脂質代謝など他の代謝経路との関係の中で,NRF2が創出するさまざまな生物学的効果における硫黄代謝の位置づけを理解する必要があると考えている.