1)RNA修飾
1965年Holley博士が酵母からアラニントランスファーRNA(tRNAAla)を単離し配列を決定したとき,メチル化修飾を含む数種類の化学修飾がいくつかのヌクレオチドに施されていることが発見され1),RNA修飾の存在が知られるようになった.以来,分析技術の発展とともにRNA修飾の種類が徐々に増え,現在ではすべての生物を合わせて,150種類以上のRNA修飾が見つかっている2).RNA修飾は,シンプルな水酸化やメチル化からグリコシル化といった複雑な修飾まで存在し非常にバラエティに富んでおり,またtRNA以外に,リボソームRNA(rRNA)やメッセンジャーRNA(mRNA)など,多様なRNA種に修飾が含まれていることも明らかになっている.特に近年,質量分析技術の高感度化に加え,次世代シーケンス技術を応用した修飾解析方法の開発により,RNA修飾に関する理解が急速に進み,RNA修飾はRNAの細胞内局在,安定性,翻訳効率などRNAが正しく機能するための質的な情報を含むことで,転写後の遺伝子発現調節に不可欠であることが明らかになりつつある.現在,RNA修飾は「Epitranscriptome」と呼ばれ,新たな研究分野として世界的に大きな広がりを見せている3, 4).最近では,COVID-19に対するmRNAワクチンにも人為的に修飾が導入されているように,RNA修飾は基礎生命科学にとどまらず,医療においても重要なモダリティとなっている.
2)tRNA硫黄修飾
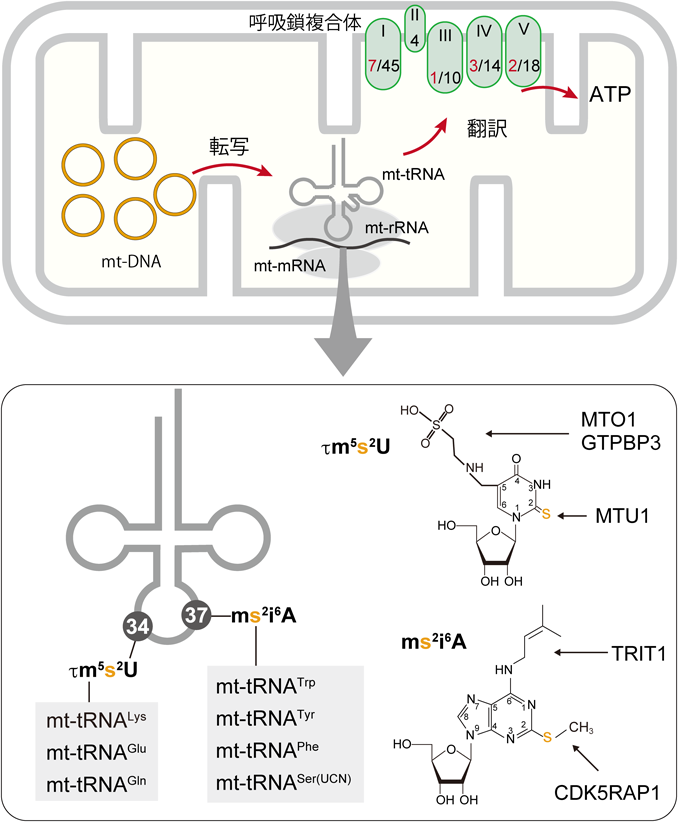
tRNAは長さ70塩基前後の小分子RNAであり,アンチコドンがmRNAのコドンと結合することで遺伝暗号をアミノ酸に変換する.tRNAは数百~数千塩基の長さを有するrRNAやmRNAと比べて圧倒的に短いにもかかわらず,これまで報告されているRNA修飾の約8割以上がtRNAに見つかっている2).また,tRNAを構成するヌクレオチドのうち,特にコドンと結合するアンチコドンに多くの修飾が集中している.本稿では,哺乳動物のミトコンドリア内に存在するtRNA(mt-tRNA)の34位と37位に存在する硫黄修飾に焦点を当て,高次生命機能におけるその重要性を紹介する(図1).
硫黄修飾はおもに2種類に分類することができる.1種類は硫黄原子のみを含む修飾であり,具体的にはtRNAの34位ウリジン(U34)のC2位に硫黄原子が付加された2-thio(以下s2)修飾である(図1).s2修飾はミトコンドリア以外に細胞質のtRNAにも存在し,細胞質側のタンパク質翻訳に重要であるが,本稿では割愛する.一方,細菌では,s2以外にウリジンのC4位に硫黄修飾を有する4-thiouridine(s4U)修飾や32位シチジンに硫黄修飾が付加された2-thiocytidine(s2C)が見つかっているが2),哺乳動物のtRNAにはs4Uやs2C修飾は確認されていない.
もう1種類の硫黄修飾は,硫黄原子にさらに他の修飾体が付与されているタイプであり,具体的には硫黄原子にメチル基が付加されているチオメチル化修飾(2-methiothio修飾=ms2修飾)である2)(図1).哺乳動物tRNAではms2修飾は37位アデノシン(A37)にのみ存在する.また,s2修飾と同様,ms2修飾を有するtRNAもミトコンドリアと細胞質の両方に存在しており,タンパク質翻訳ならびに生体機能制御に深く関わっている.
本稿では,mt-tRNAのs2修飾とms2修飾がミトコンドリアタンパク質翻訳に果たす役割,さらに修飾の欠損によるミトコンドリア関連疾患についてこれまでの知見を総説する.
2. ミトコンドリアtRNA硫黄修飾:2-thiouridine修飾
1)ミトコンドリアタンパク質翻訳
ミトコンドリアはエネルギー代謝をつかさどる細胞小器官である.ミトコンドリアは独自の環状DNA(mt-DNA)を有しており,22種類のトランスファーRNA(mt-tRNA)と2種類のリボソームRNA(mt-rRNA)をコードする5)(図1).これらのmt-tRNAとmt-rRNAは,同じくmt-DNAに由来するmRNA(mt-mRNA)を翻訳し13種類のタンパク質を産生する6).翻訳されたタンパク質は,ミトコンドリア呼吸鎖複合体のうち複合体I, III, IV, Vに取り込まれる6)(図1).呼吸鎖複合体は91個のサブユニットで構成されており,mt-DNAに由来するこの13個のサブユニットはそれぞれの複合体において中心的な役割を有している.実際,この13種類のタンパク質のコーディング領域に生じる遺伝子変異の多くはミトコンドリア病の発症につながることが知られている6).
2)ミトコンドリアtRNAの2-thio(s2)修飾と硫黄リレー
東京大学の鈴木らはヒト胎盤から全mt-tRNAを単離し,質量分析などを用いた網羅的な修飾解析により,22種類のmt-tRNAには18種類の修飾が137か所に存在することを明らかにした7).これら修飾のうち,s2修飾は3種類のmt-tRNA(mt-tRNALys, mt-tRNAGln, mt-tRNAGlu)のアンチコドンU34に存在する(図1).mt-tRNAのs2修飾は哺乳動物から酵母まで真核生物のミトコンドリアで保存されており,さらにミトコンドリアを持たない細菌のtRNALys, tRNAGln, tRNAGluのU34にもs2修飾が存在する2).
ヒトなど哺乳動物のmt-tRNALys, mt-tRNAGln, mt-tRNAGluのU34ではs2以外,ピリミジンのC5位にタウリノメチル修飾(τm5)をさらに有しており,τm5s2U修飾が最終形態である.τm5修飾は,MTO1/GTPBP3酵素複合体によって付加され(図1),s2修飾に依存しない8).すなわち,MTO1あるいはGTPBP3の欠損により,τm5修飾が存在しなくてもs2修飾は正常に施され,また,s2修飾酵素の欠損によりs2修飾が存在しなくても,τm5修飾は正常に施される.τm5修飾もミトコンドリアタンパク質翻訳に不可欠であるが,本稿では割愛する.
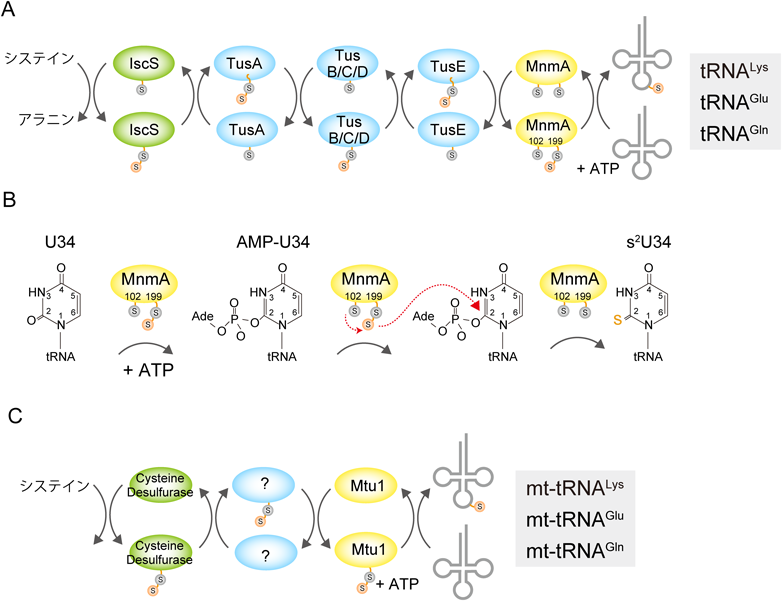
ヒトmt-tRNAのs2修飾酵素であるMTU1は進化的に保存されており(図1),そのホモログは酵母や細菌にも存在する.ヒトMTU1は酵母Mtu1とおよそ25%の相同性,細菌MnmAと37%の相同性を有し,N末端にATP結合モチーフ,活性部位に二つのシステイン(MnmAの場合はCys102とCys199)を有する8, 9).ヒトMTU1によるmt-tRNAのs2修飾反応に関する生化学研究は少なく,詳細な反応機構が不明であるが,細菌MnmAによるs2修飾は詳細に調べられており10)(図2),またtRNAGlnと結合した状態の結晶構造も解かれている11).これらの研究から,細菌MnmAによるtRNAのs2修飾はエレガントな硫黄リレーメカニズムを用いつつ,ATPのエネルギーを巧みに利用することで34U位に硫黄原子を付加する機序が明らかになった10)(図2A, B).
MnmAによるs2修飾はATPによるtRNA-34UのC2位のAMP付加から始まり,次にC2-AMPが硫黄原子に置き換わることで,s2U修飾が完成する10)(図2A, B).このs2修飾の硫黄原子はシステインの硫黄原子に由来する.システインの硫黄原子はまずcysteine desulfuraseであるIscSによってIscSのシステイン残基に移転され,パースルフィド型(あるいは超硫黄型)Cys-SSHとなる(図2A).次にこの超硫黄原子がTusA, TusB, TusC, TusD, TusEからなるタンパク質群に次々とリレーされ,最終的にMnmAの活性中心にあるCys199に渡される11).その後,Cys199の上に存在する超硫黄がC2-AMPをアタックし,s2修飾反応が完了する(図2B).このとき,Cys102によるCys199の求核反応が,cys199による硫黄付加反応に必須である11)(図2B).実際,Cys102をセリンに改変した変異MnmAはCys199がパースルフィド化された状態で酵素活性を失うことから,Cys199はCys102と共調して硫黄付加反応を行うことが示された11).このように,システインの硫黄原子は,ミトコンドリアの電子伝達系を流れる電子のごとく,多くのリレー因子を経由し最終的にU34に付加される.
一方,MnmAと同じ反応機構が真核生物でも保存されているかは不明である(図2C).Cys199とCys102に相当するシステイン残基は真核生物のMTU1にも保存されており,超硫黄原子がmt-tRNAのs2修飾に大きな役割を果たしていることが予想される.
3)mt-tRNAのs2修飾の分子機能
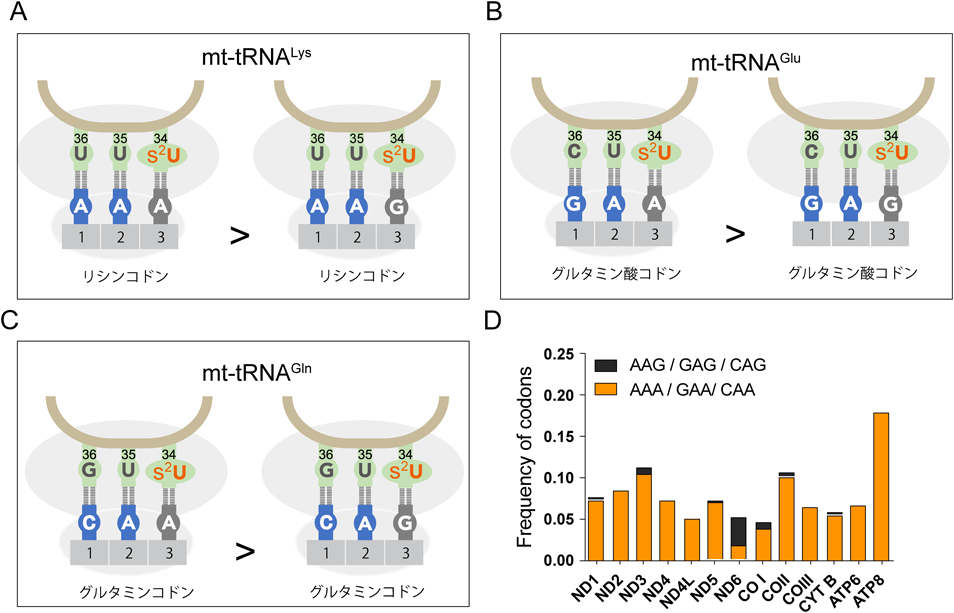
tRNALys,tRNAGlu,tRNAGlnのs2修飾はアンチコドンループの立体構造に必要であり12, 13),コドンの認識やタンパク質翻訳の速度に大きな影響を及ぼすことが明らかになってきた14, 15).ウリジンの分子構造は柔軟性に富んでおり,近傍の塩基との相互作用に弱いとされている6).ところが,s2修飾が施されると,U34の立体構造がC3′-endo型と呼ばれる「かたい」構造をとるようになる.この変化がU34とその近傍の塩基との相互作用を増強し,また,U34を含むアンチコドンループに空間的な安定性をもたらすことになり,その結果,アンチコドンとコドンの結合が強化される12, 13).
tRNALys, tRNAGlu, tRNAGlnは,それぞれリシンコドン(AAAとAAG),グルタミン酸コドン(GAAとGAG),グルタミンコドン(CAA, CAG)を解読する(図3A~C).それぞれのtRNAのU34は,対応するコドンの第3字目のAあるいはGと結合する(図3A~C).興味深いことに,s2修飾を有するU34は立体構造の制約によりGよりもAとの結合を好む13, 16).細胞質tRNAのs2修飾を欠損した酵母では,第3字目のAであるリシンAAAコドンとグルタミンCAAコドンにおいて翻訳の著しい停滞が認められている15).このようなコドン指向性は,ミトコンドリアでのタンパク質翻訳に特に重要であると考えられる.なぜなら,mt-mRNAのコドン組成には偏りが存在し,特にリシン,グルタミン酸,グルタミンコドンは第3字目がAのコドンを多用するからである(図3D).たとえば,ヒトmt-mRNAの全リシンコドンのうち88.4%がAAAで残り11.6%がAAG,全グルタミン酸コドンのうち68.3%がGAAで残り31.7%がGAG,全グルタミンコドンのうち87.8%がCAAで残り12.2%がCAGである17).このように,ミトコンドリアではリシン,グルタミン酸,グルタミンに対応するコドンは第3字目がAであるコドン(AAA, GAA, CAA)に極端に偏っているが,U34におけるs2修飾がこの偏ったコドン環境における翻訳に重要であると考えられる.
4)mt-tRNAのs2U修飾によるミトコンドリアでの翻訳制御
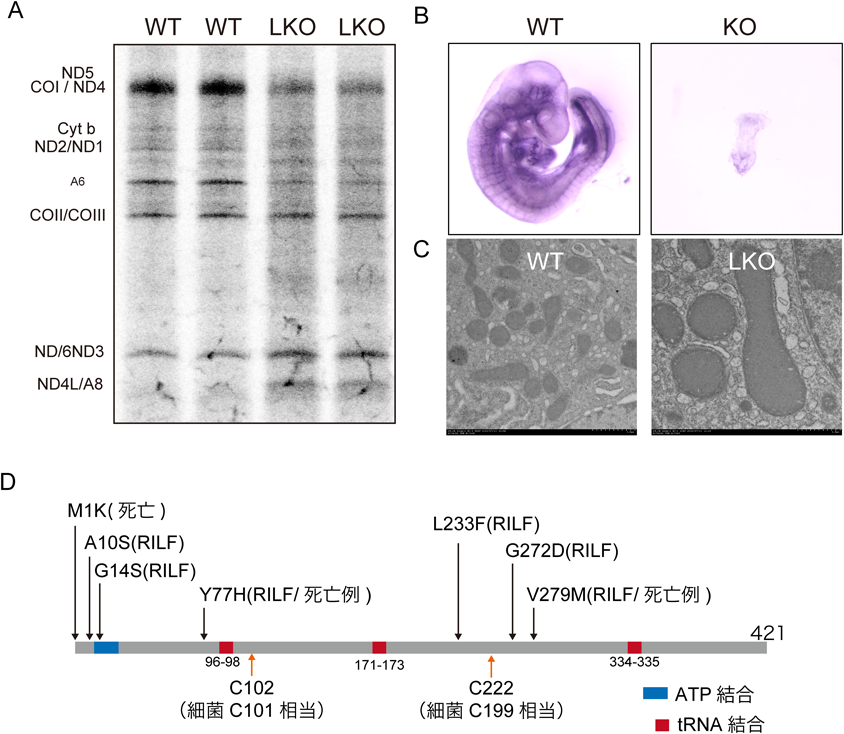
ミトコンドリアタンパク質翻訳におけるs2修飾の重要性は,修飾酵素Mtu1の欠損細胞や欠損マウスの解析で示されている11, 17).Mtu1を欠損した酵母ではミトコンドリア内のタンパク質翻訳量が低下し,その結果,酸素消費量が低下し,ミトコンドリア機能に強く依存する培養条件(YPG培地)では生育が著しく障害された11).肝臓特異的Mtu1欠損マウスから調製した初代培養肝細胞ではミトコンドリア内のタンパク質翻訳が劇的に低下していた17)(図4A).また,酵母とマウス以外に,Mtu1を欠損したゼブラフィッシュも作製され,ミトコンドリアタンパク質の低下が認められている18).このように,さまざまな生物種でミトコンドリアタンパク質翻訳におけるs2修飾の重要さがが示されている.特筆すべき点として,Mtu1欠損によりs2修飾がmt-tRNAに存在しない場合でもτm5修飾は正常に施されるため,Mtu1欠損細胞でみられるミトコンドリアタンパク質翻訳の低下はs2修飾欠損のみに起因するといえる18).
興味深いことに,ShoubridgeらはHEK 293細胞を用いてsiRNAでMTU1遺伝子をノックダウンし,ミトコンドリアタンパク質翻訳を解析したところ,MTU1のノックダウンがmt-tRNAのs2修飾を抑制したものの,ミトコンドリアタンパク質翻訳に影響を及さなかったと報告している19).著者らは,s2修飾がミトコンドリアタンパク質翻訳に“dispensable”であると結論づけたが,siRNAによるノックダウンは遺伝子機能を完全に抑制することが困難であり,s2修飾を含むmt-tRNAの残存量によっては直ちに影響が出ないことが考えられる.これまで示してきたように,Mtu1を完全に欠損した酵母,マウス,ゼブラフィッシュではミトコンドリアタンパク質の翻訳量が明らかに低下しており,少なくとも正常細胞ではs2修飾がミトコンドリアタンパク質翻訳に不可欠であると結論づけるのが妥当である.しかしながら,HEK 293のような不死化細胞では何らかの機序によりs2修飾非依存的にミトコンドリアタンパク質翻訳が進む場合も考えうるので,今後はさまざまな細胞種でさらに検討する必要がある.
5)Mtu1欠損動物の表現型
Mtu1の機能欠損はミトコンドリア機能,さらに生体機能に多大な影響を及ぼす.全身性のMtu1欠損マウスは発生の早い段階で胎生致死となり,Mtu1欠損胎仔のサイズが野生型と比べて非常小さく,Mtu1によるs2修飾がマウスの胚発生に不可欠であることを示している17)(図4B).一方,Mtu1を肝臓で特異的に欠損させたマウスは野生型マウスと同様に成長し,外見上の異常は認められなかったが,ミトコンドリアでのタンパク質翻訳の低下により,呼吸鎖複合体の活性が顕著に低下していた.さらにMtu1を欠損した肝細胞では,ミトコンドリアの異常な膨張や内膜の消失が観察され,ミトコンドリアでの翻訳異常がミトコンドリアの形態異常を引き起こした17)(図4C).
肝臓特異的Mtu1欠損マウスは著しい肝障害を呈する.欠損マウスでは肝障害を示すマーカーであるASTやALTが野生型マウスと比べて著しく上昇し,また,血中の乳酸レベルも野生型マウスより有意に上昇しており,ミトコンドリア障害を伴う肝障害であることを示している.さらに,欠損マウスの肝臓ではマクロファージの浸潤が認められ,炎症が亢進していた.一方,Mtu1を全身で欠損したゼブラフィッシュは正常に生まれるが,感覚器(内耳)の形態・機能障害により異常な泳ぎ方を呈するといった表現型が示されている18).電子顕微鏡観察により,Mtu1を欠損したゼブラフィッシュの内耳有毛細胞においてミトコンドリアの形態異常が認められた.
6)MTU1遺伝子異常を伴うミトコンドリア関連疾患の病態
ヒトにおいてMTU1遺伝子は22番染色体上に位置し,ミトコンドリア病関連疾患である小児急性肝障害の原因遺伝子の一つとして知られている20–25)(図4D).MTU1変異に起因する小児急性肝障害は希少疾患であるが,症例は世界各地で報告されている.小児患者は出生直後から1年以内に発症し,肝機能が急激に低下し重症化する.患者ではASTやALTといった肝障害マーカーの上昇やミトコンドリア呼吸鎖複合体の活性低下が認められ,肝臓特異的Mtu1欠損マウスの表現型と一部類似する.小児急性肝障害患者に対する治療法は対症療法のみであり,病態の悪化により患者が亡くなるケースが報告されている(図4D).一方,急性期の肝障害を乗り越えると,MTU1遺伝子変異を保有したの状態で完全に回復し,再発症もしない(図4D).
小児急性肝障害患者ではMTU1遺伝子のアミノ酸置換変異,フレームシフト変異,部分欠損変異が確認されており,変異部位がMTU1 mRNAに散在している24)(図4D).また,一つの変異をホモで保有する患者と,他の変異とヘテロで保有する患者が確認されている.いくつかの変異はMTU1のLoss-of-Tunctionを引き起こす。たとえば,M1Kは開始コドンの変異であり,全長のMTU1が翻訳されなくなると推察される.また,G14SはATP結合部位の変異であり,MTU1の酵素活性が障害されると考えられる.一方,その他の変異(A10S, Y77H, L233F, G272D, V279M)については,MTU1の構造や酵素活性に与える具体的な影響が不明である.しかし,変異箇所や種類にかかわらず,肝障害という共通の病態や,Mtu1欠損マウスの表現型との類似性を鑑み,現在見つかっているMTU1の遺伝子変異はいずれもMTU1の機能低下を引き起こし,その結果ミトコンドリアでのタンパク質翻訳が障害され,最終的に肝障害の発症につながると考えられる.一方,なぜ遺伝的に病原性変異を保有した状態でも病態が回復し,さらに再発もしないのかについては,合理的に説明できるモデルがない.
MTU1の遺伝子変異は肝障害以外に難聴患者にも見つかっている26).これらの患者では核DNAのMTU1 A10S変異とともに,mt-DNAのA1555G変異も存在する.mt-DNAのA1555G変異はmt-rRNAのうち,mt-tRNAと結合する部位の近辺に位置することから,この変異がmt-rRNAに構造的な変化を引き起こすことで,mt-tRNAとmt-mRNAとの結合に影響を与えると考えられる26).
7)ミトコンドリア病とs2修飾
ミトコンドリア病は,ミトコンドリア機能不全によってエネルギー需要の多い神経,心筋および骨格筋の機能が障害される難治性遺伝疾患であり,mt-DNAの変異に起因する症例と,核DNAのうち,ミトコンドリア機能に関わる遺伝子の変異に起因する症例が知られている.ミトコンドリア病患者のうち,mt-tRNALysをコードするmt-DNA領域のA8344G変異が,MERRF(myoclonus epilepsy associated with ragged-red fibers)と呼ばれる患者で見つかっている27).A8344G変異を有する患者は,ミトコンドリアでのタンパク質翻訳が障害されており,その結果,エネルギー代謝が低下し,ミオクローヌスてんかんや小脳症状を特徴とする症状を発症する27).安川らは,MERRF患者由来のmt-tRNAを解析し,A8344G変異を有するmt-tRNALysにおいてτm5修飾とs2修飾がU34で消失することを発見している28, 29).ミトコンドリアタンパク質翻訳におけるs2修飾の重要性を鑑み,MERRF患者におけるミトコンドリアタンパク質翻訳障害の一部はs2修飾の欠損に由来すると考えられる.
以上のように,酵母からヒトに至るさまざまな生物種での解析から,s2修飾がミトコンドリアタンパク質翻訳に不可欠であることは明らかである.s2修飾がtRNAのアンチコドンループの構造に与える変化はわずかであるが,その小さな変化がミトコンドリアタンパク質翻訳そしてミトコンドリア機能に大きな影響を及ぼす.一方,分子機序において,s2修飾反応は超硫黄リレーというきわめて複雑でエレガントなシステムによって制御されていることが細菌で明らかになっているが,ヒトをはじめ哺乳動物のミトコンドリアでもそのような硫黄リレーが行われているかは不明であり,今後の重要な研究課題である.
3. ミトコンドリアtRNA硫黄修飾:2-methylthio修飾(ms2修飾,チオメチル化修飾)
1)ミトコンドリアtRNAの2-methylthio修飾
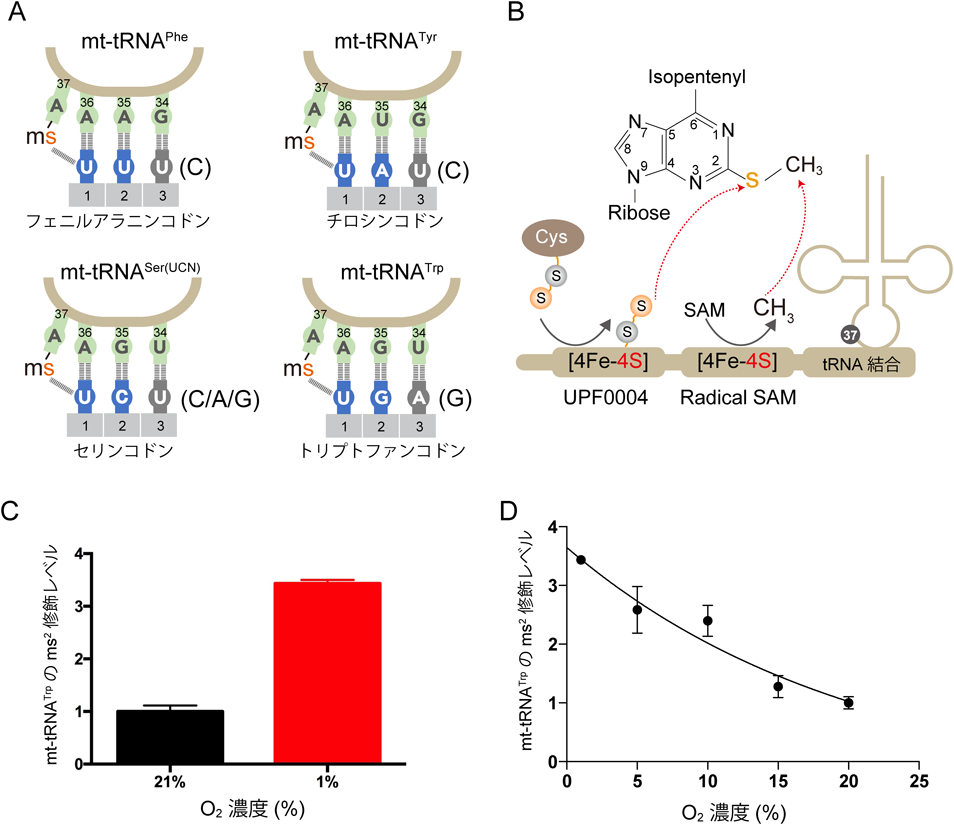
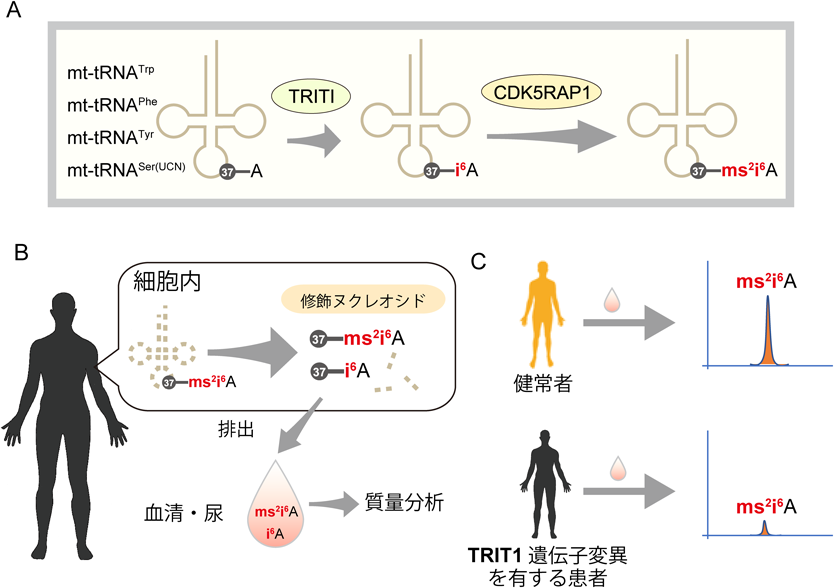
mt-tRNAの硫黄修飾のうち,他の修飾も付加されている修飾として,チオメチル化修飾(ms2修飾)が知られている2).ミトコンドリアでは4種類のmt-tRNA(mt-tRNAPhe, mt-tRNATyr, mt-tRNASer(UCN), mt-tRNATrp)がms2修飾を有しており,アンチコドンすぐ近傍の37位アデノシン(A37)に存在する2)(図1).この4種類のtRNAでは,ms2修飾が単独で存在せず,A37のN6位にisopentenyl修飾(i6)も有しており,ms2i6Aが最終形態である(図1).ms2i6A修飾は進化的に保存されており,細菌ではtRNACysを加えた5種類のtRNA(tRNAPhe, tRNATyr, tRNASer(UCN), tRNATrp, tRNACys)のA37に存在する2).一方,真核生物である酵母ではms2修飾を行う酵素が存在しないため,i6A修飾のみである2).
ms2修飾が存在するtRNAならびにtRNAが解読するコドンには共通する特徴がある.すなわち,tRNAアンチコドンの第3字目(36位)がAであり,これらのtRNAが結合するコドンの第1字目がUである(図5A).細菌由来のリボソーム,tRNAPhe,とmRNAを用いた結晶解析により,A37のms2修飾の硫黄原子がコドン第1字目のUの上に配置し,Uのピリミジン環と分子間相互作用を形成しうることが明らかになった31).tRNAのA36はコドン第1字目のUと結合(A:U結合)を形成するが,A37のms2修飾からの作用が新に加わることで,A:U結合がさらに強化される(図5A).このように,ms2修飾はコドン・アンチコドン結合を補強する作用を有しており,また,その作用に直接関わっているのが硫黄原子であることが構造解析から明らかになった.
2)ミトコンドリアtRNA ms2修飾と超硫黄
哺乳動物においてmt-tRNAのms2修飾酵素はCdk5rap1(Cdk5 regulatory subunit associated protein 1)である32).
Cdk5rap1はミトコンドリア局在ドメイン,UPF0004ドメインとRadical SAMドメイン,さらにtRNA結合ドメインを有する(図5B).UPF0004ドメインとRadical SAMは硫黄・鉄クラスター[4Fe-4S]と結合するドメインであり,活性中心に特徴的なシステイン(C)モチーフ(CxxCxC)が存在する33).Cdk5rap1によるms2修飾のうち,メチル基はS-アデノシルメチオニン(S-adenosyl methionine:SAM)のメチル基に由来することは以前から知られていたが,硫黄原子の由来が不明であった.
近年,FontecaveらのグループがCdk5rap1の細菌ホモログであるMiaBを低酸素下で精製し,硫黄・鉄クラスターと再構築した後,構造解析を行った34).その結果,MiaBの硫黄・鉄クラスターには超硫黄分子が余分に存在しており,ms2修飾の硫黄源として機能するという興味深いモデルが示された(図5B).MiaBあるいはCdk5rap1はATPと結合しないため,Mtu1とは異なり,C2位へのアタックはATPを介さずに超硫黄が直接行うと予想される.筆者らのグループは,超硫黄原子を安定同位体でラベルしたシステインパースルフィドを細胞に投与し,質量分析でmt-tRNAのms2修飾を検討した結果,実際に超硫黄がms2修飾に取り込まれていることを見いだしている35).この結果は,哺乳動物細胞において超硫黄分子がms2修飾の硫黄源の一つであることを示唆する.
3)Cdk5rap1の活性制御
上記のように,Cdk5rap1は硫黄・鉄クラスターを利用して硫黄原子とメチル基をtRNAに付加する酵素であり,修飾酵素の活性測定は非常に厳しい低酸素状態で行う必要があるように,Cdk5rap1はきわめて酸素に脆弱である.実際,培養細胞に低濃度の過酸化水素を加え酸化ストレスを与えると,ms2修飾レベルが速やかに低下した32).さらに興味深いことに,細胞を低酸素で培養するとmt-tRNAのms2修飾レベルは酸素濃度に応じて上昇していた36)(図5C, D).このように,ms2修飾は酸素濃度や酸化ストレスによって大きく変動するユニークな性質を有しており,このような酸素濃度に依存したダイナミックな変動は他のtRNA修飾にみられない性質である.また,これらの結果はタンパク質のみならず,RNAにも酸素応答性が存在することを意味する.一方,硫黄・鉄クラスターがCdk5rap1の酵素活性に不可欠であることは明らかであるが,Cdk5rap1がどのような機構で硫黄・鉄クラスターを獲得するかは不明である.硫黄・鉄クラスターの組み立てや受け渡しの機構は非常に複雑であり,多くの調節タンパク質が介在しており,今後詳細な分子機構の解明が必要である.
4)Cdk5rap1欠損によるミトコンドリア機能低下と疾患
個体におけるms2修飾の生理意義はCdk5rap1欠損マウスの表現型解析で明らかになった32).Cdk5rap1欠損マウスに由来する線維芽細胞におけるミトコンドリアタンパク質翻訳は,野生型線維芽細胞と比べて有意に低下していた.また,マウス個体においても,骨格筋や心筋といったミトコンドリアを豊富に含む組織ではmt-DNAに由来するミトコンドリアタンパク質の量が低下していた32).その結果,Cdk5rap1欠損マウスの骨格筋と心筋における呼吸鎖複合体(複合体I, IIIとIV)の活性が顕著に障害され,ミトコンドリアの酸素消費量が低下した.加えて,ミトコンドリアの異常な膨張や内膜構造の崩壊といったミトコンドリア形態異常も観察された.
Cdk5rap1欠損マウスは外見上において明らな異常が認められず,通常飼育下では骨格筋や心筋,脳,といった主要臓器の機能は正常であったが,高脂肪食といった代謝ストレスや大動脈結紮によるメカニカルストレスを与えると,欠損マウスのミトコンドリア機能が急激に悪化した.その結果,トレッドミルにおける持久力の低下や心肥大といった骨格筋や心筋の機能低下が認められた.このように,マウス個体においてCdk5rap1によるms2修飾はミトコンドリアでの効率的なタンパク質翻訳に必要であり,骨格筋や心筋の機能維持に寄与することが示された.
5)ms2修飾とミトコンドリア病
ms2修飾がミトコンドリア病の発症に関わることは臨床検体の解析で示唆されている32).mt-DNA変異に起因するミトコンドリア病において,mt-tRNALeu(UUR)をコードする領域に位置するA3243G変異が特に頻度が高く,mitochondrial myopathy, encephalopathy, lactic acidosis and stroke-like episodes(MELAS)と呼ばれる病型の原因として知られている.MELAS患者は,脳卒中様症状,けいれんや心筋症といった重篤な症状を呈する.安川らはA3243G変異を有するmt-tRNALeu(UUR)の34Uにおいて,正常型のmt-tRNALeu(UUR)に存在するτm5修飾が消失することを明らかにした29).また最近,筆者らはτm5修飾酵素であるMto1の欠損マウスの解析を行い,mt-tRNAのτm5修飾がミトコンドリア内のタンパク質翻訳に不可欠であることを明らかにした37).さらに,筆者らはA3243Gを有するMELASの患者に由来する血球RNAサンプルを用いてmt-tRNAのms2修飾を解析した結果,A3243G変異率が高いほど,mt-tRNAのms2修飾が低下することを見いだした32).mt-A3243Gが位置するtRNALeu(UUR)にはms2修飾が存在しないため,なぜMELAS患者でms2が低下するかは不明である.興味深いことに,先行研究においてA3243G変異は二次的な酸化ストレスの亢進を惹起すると報告されている38).Cdk5rap1によるms2修飾は酸化ストレスに脆弱であることから,MELAS患者におけるmt-tRNAのms2修飾の低下は酸化ストレスの亢進による副次作用である可能性がある.
最近,筆者らは核DNAの変異を起因とするミトコンドリア病の発症にもmt-tRNAのms2修飾が関わることを見いだした39).ms2修飾は前修飾としてi6A修飾が必須であり,i6A修飾の責任酵素はTRIT1である40)(図6A).筆者らはTRIT1遺伝子に変異を有するミトコンドリア病患者の血球RNAを解析し,i6A修飾とms2修飾が顕著に低下することを明らかにした39).この結果は,TRIT1の遺伝子変異がloss-of-function変異であり,i6A修飾ならびにms2i6A修飾欠損がこの患者で認められるミトコンドリア機能障害の原因であることを強く示唆する.
また最近,筆者らはRNA修飾の多くはRNAが1塩基まで分解された後でも脱修飾されずに,修飾が存在したままの状態(修飾ヌクレオシド)で血液や尿といった細胞外液に排出され,細胞外修飾ヌクレオシドの一部は液性因子として機能しうる現象を見いだした41, 42)(図6B).このことから着想し,筆者らは患者の尿検体を質量分析装置で解析した結果,mt-tRNAの代謝産物であるms2i6Aを患者尿で検出することに成功し,さらに患者尿でのms2i6A存在量は健常者と比べて顕著に低下することを見いだした(図6C)39).このように,尿中修飾ヌクレオシドは生体内における修飾状態を反映しており,また尿中修飾ヌクレオシドを用いた診断法は完全に非侵襲であり患者への身体的な負担がないため,今後さらなる応用が期待できる.
以上の一連の研究結果から,ms2修飾はヒトにおいてもミトコンドリア内のタンパク質翻訳に必要であり,修飾の破綻がミトコンドリア病の発症に寄与することが示された.