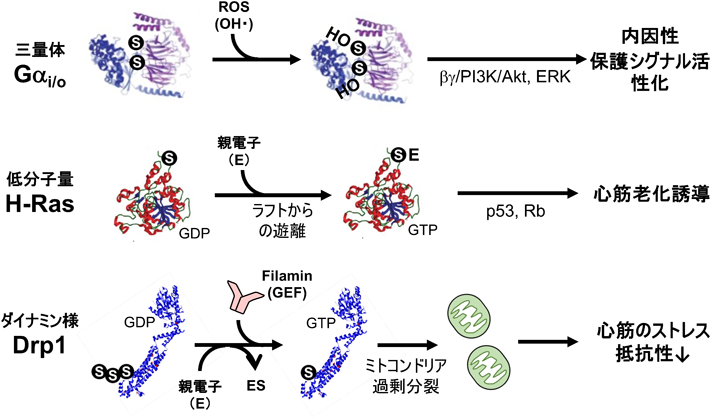
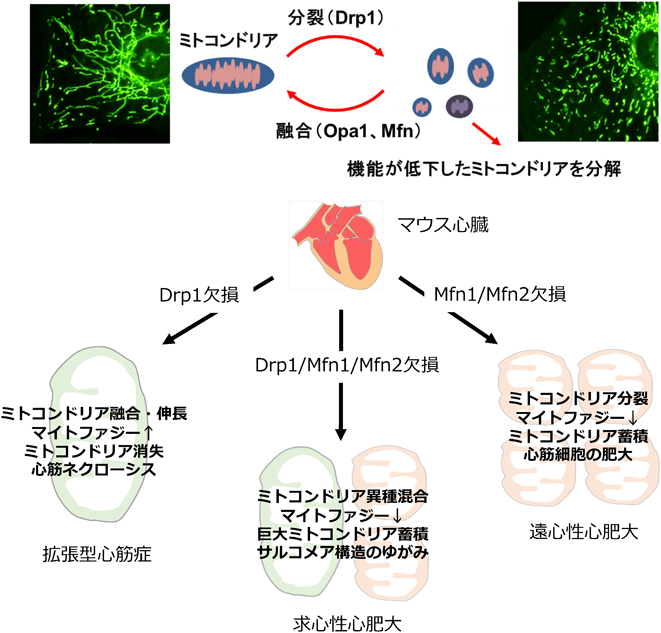
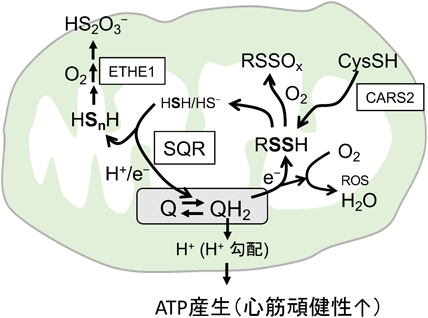
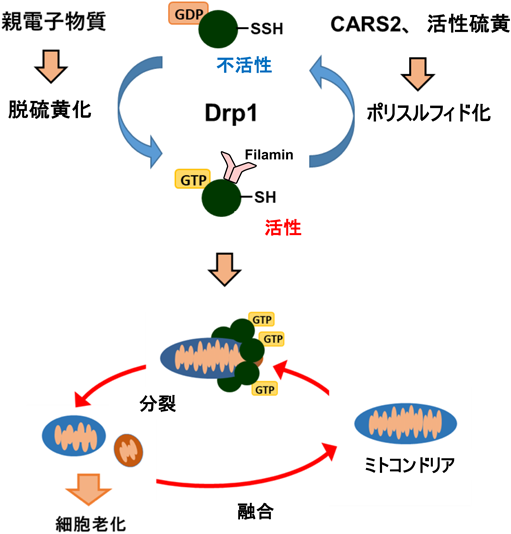
心筋の頑健性と超硫黄分子代謝Myocardial robustness and supersulfide metabolism
1 九州大学大学院薬学研究院生理学分野Department of Physiology, Graduate School of Pharmaceutical Sciences, Kyushu University ◇ 〒812–8582 福岡県福岡市東区馬出3–1–1 ◇ 3–1–1 Maidashi, Higashi-ku, Fukuoka 812–8582, Japan
2 自然科学研究機構生命創成探究センター(生理学研究所)心循環シグナル研究部門Division of Cardiocirculatory Signaling, National Institute for Physiological Sciences & Exploratory Research Center on Life and Living Systems, National Institutes of Natural Sciences ◇ 〒444–8787 愛知県岡崎市明大寺町字東山5–1 ◇ 5–1 Higashiyama Myodaiji, Okazaki, Aichi 444–8787, Japan