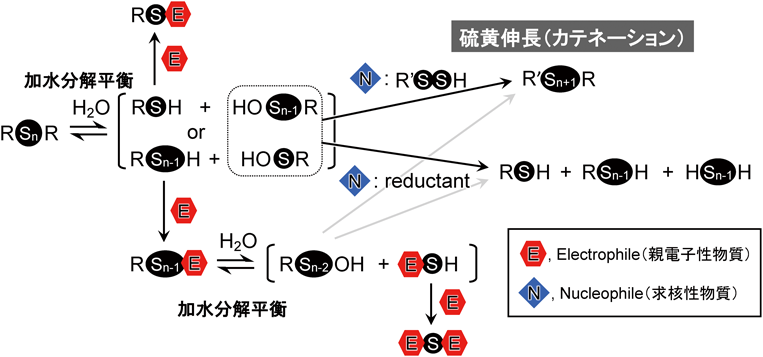
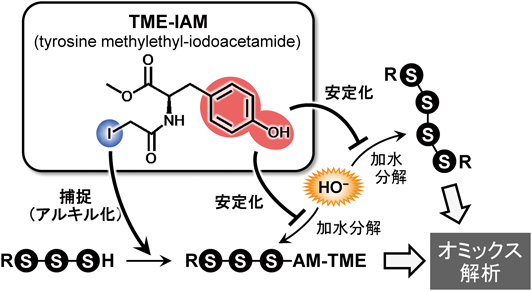
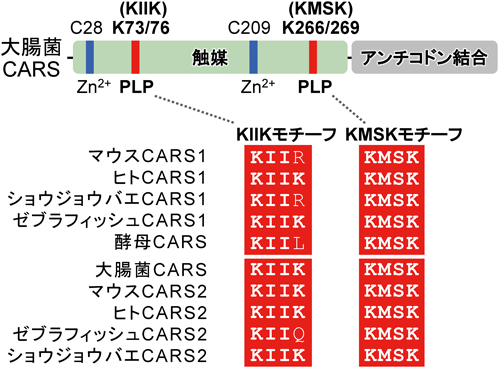
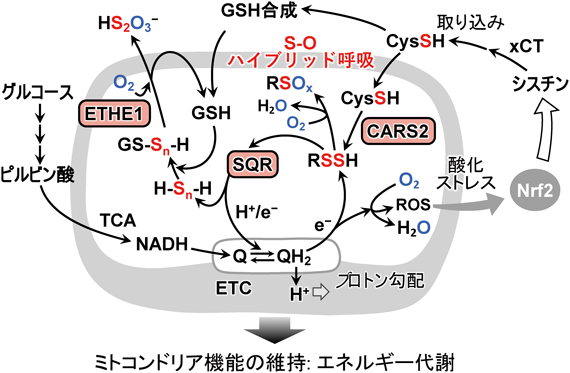
超硫黄分子の化学と代謝:超硫黄生物学の創成とオミックス先制医療への展望Chemistry and metabolism of supersulfides: Perspective for supersulfide biology and omics medicine
東北大学大学院医学系研究科環境医学分野Department of Environmental Medicine and Molecular Toxicology, Tohoku University Graduate School of Medicine ◇ 〒980–8575 仙台市青葉区星陵町2–1 ◇ 2–1 Seiryo-machi, Aobaku, Sendai, Miyagi 980–8575, Japan