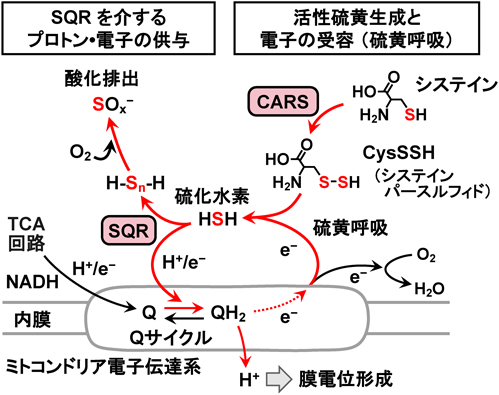
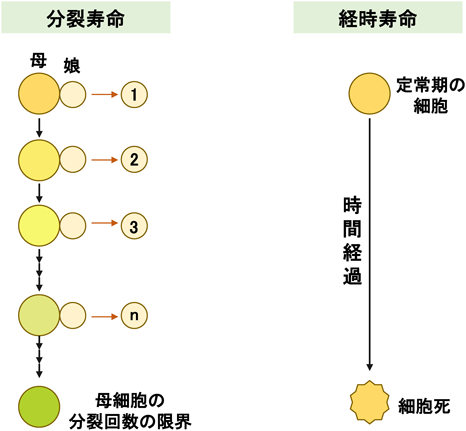
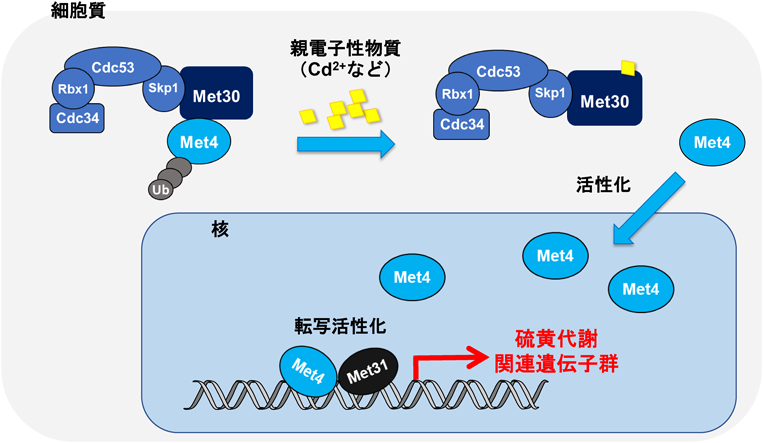
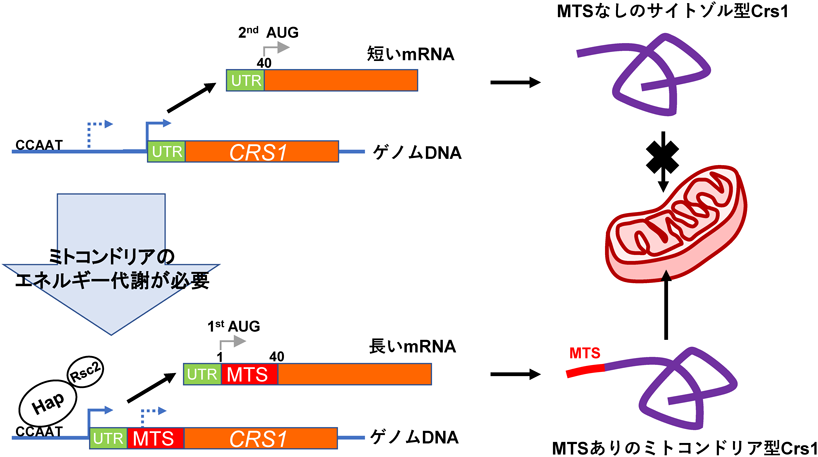
寿命・老化における超硫黄分子の役割Longevity regulation by reactive persulfides
奈良先端科学技術大学院大学先端科学技術研究科バイオサイエンス領域Division of Biological Science, Graduate School of Science and Technology, Nara Institute of Science and Technology ◇ 〒630–0192 奈良県生駒市高山町8916–5 ◇ 8916–5 Takayama, Ikoma, Nara 630–0192, Japan