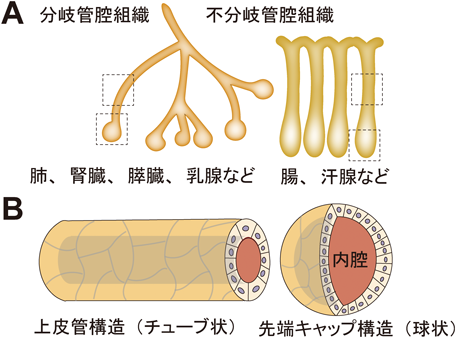
上皮管腔組織は唾液腺や肺,消化管,肝臓,膵臓,腎臓,乳腺等多くの主要臓器が有する極性化した上皮細胞からなる中空かつ管状の構造である(図1A).上皮管腔組織は,生命活動を維持するために生体内外の物質の吸収,輸送,排出や分泌を行うために発達した器官である1).上皮管腔組織は,頂底(アピコベーサル)極性を確立することで中空構造を形成し,さらに表面積を広くするために管(チューブ)状に伸長して時に分岐し,先端部は球状のキャップ構造で終わっている(図1B)2, 3).このキャップ構造は組織やその機能によってacinus(腺房),end bud(終蕾),alveolus(肺胞),cyst(嚢胞),follicle(濾胞)などと呼ばれる.筆者らはこれまで,上皮管腔組織が特有の機能と複雑な形態をいかに獲得していくのか,そのプロセスに興味を持ち研究を行ってきた.これまで個々の細胞における増殖や運動,接着,また神経細胞や細胞運動時の前後軸等の極性決定の分子機構は明らかになってきた.しかし,上皮細胞が集団として極性化しながら,連続した内腔を有する複雑な管腔構造を形成する分子機構の理解はこれまでほとんど進んでいない.管腔形態形成の理解を困難にしていた要因として,in vivoでは生体の深部であるため解析のためのアクセスが困難であること,またin vitroの古典的な平面培養では立体的な組織化を再現できないことがあげられる.この未解決の問題を解決するためには,上皮細胞にとって生体内に類似した3次元的な細胞環境をin vitroで再現する,3次元培養モデルが必要である.昨今のオルガノイド研究の進歩によって,ES細胞やiPS細胞,組織特異的幹細胞から3次元培養で立体的な管腔組織構造を誘導し,維持することが可能な段階になってきた4, 5).しかし,いまだ多くのオルガノイドは構造的にも機能的にも未成熟なものが多く,今後はこれらの幹細胞をin vitroで機能的あるいは構造的に成熟した管腔組織へと誘導する機構を明らかにすることが重要である.上皮管腔組織の形成,維持には多細胞生物が有する二つの重要な細胞外シグナルである「液性因子」と「細胞外基質」が必須である.なかでも,これまでのノックアウトマウスを用いた発生学的研究や,近年のオルガノイドを用いた幹細胞研究から,液性因子であるWntが多くの上皮管腔組織の形成,維持に共通して重要であることが明らかになってきた6–8).しかし,Wntシグナルが管腔組織形成におけるどのプロセスにどのように関わるのか,具体的な分子メカニズムはこれまでほとんど知られていない.
一方で,悪性腫瘍,いわゆる“がん”の発生母地のおよそ90%は上皮組織であり,がん細胞が間質内で増殖しながら進展する過程は,上皮細胞の集団移動を伴う上皮管腔組織の形成過程と類似する点も多い9, 10).正常な管腔形態形成の過程で機能するシグナル経路の多くが,上皮性のがんで異常を来していることからも,がんとは異常な上皮の形態形成とみなせるのかもしれない.そのため,上皮管腔組織の形成・維持と破綻の分子機構を明らかにすることは,がん研究の進展につながると期待される.本稿ではまず,3次元培養モデルを用いて明らかにされてきた,管腔形態形成に欠かせない上皮の頂底極性と内腔形成の制御シグナルについて概説する.さらに,筆者らが見いだしてきたWntシグナルによる内腔形成制御機構や,ARL4C[ADP ribosylation factor(Arf)like GTPase 4C]を介した上皮管伸長制御の分子機構,またその異常がさまざまなヒトがんの悪性化に関与することを示す最近の知見についても紹介したい.
2. in vitroでの上皮管腔組織形成のための3次元培養モデルと細胞外基質
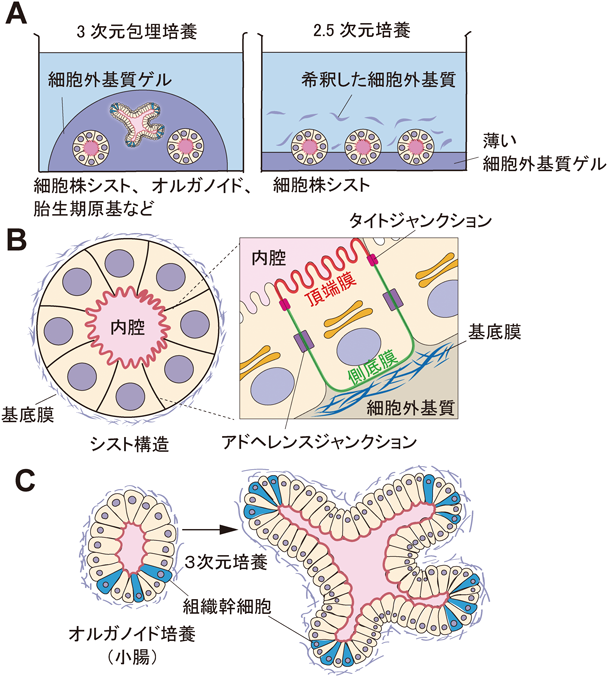
3次元の細胞培養モデルには,生体臓器の一部や間質から剥ぎ取られた上皮組織の断片,または単離した上皮細胞を用いる方法や,樹立された上皮細胞株を用いた方法がある.細胞株を用いた実験系は,生体由来の細胞と比較して比較的均質な性質(分化状態)の細胞を安定して実験に用いることで,詳細な制御メカニズムの解析を行うことが可能となる.細胞株を用いたin vitroの上皮管腔形成モデルとして最も古くから用いられてきたのが,イヌ腎臓尿細管上皮由来のMDCK(Madin-Darby canine kidney)細胞を細胞外基質内で3次元培養する方法である.3次元培養は,生体外に取り出した上皮細胞をできるだけ生体内に近い細胞外基質のゲル内(3次元包埋培養),または薄いゲル上(2.5次元培養)の環境で培養する方法として一般的に用いられてきた(図2A).MDCK細胞は血清を含む培地中で,I型コラーゲンゲル内で3次元培養すると,内腔を有する球状の“シスト”と呼ばれる細胞塊を形成する.シストを構成する上皮細胞は内腔側に頂端膜(アピカル膜),基底側に側底膜(バソラテラル膜)を形成し,極性化することでいわゆる腺管様構造を形成している(図2B)11).シストは球形ではあるものの,上皮管腔組織を最もシンプルに反映したモデルとされ,頂底極性や内腔形成制御に関する研究に応用されてきた12, 13).しかし,I型コラーゲンは,主として間充織を構成する細胞外基質であり,I型コラーゲンゲル内で頂底極性を確立し,内腔を形成できる細胞株は限られており,上皮細胞はしばしば極性状態を失い,ばらばらに分散してしまう14).その後,上皮細胞をより効率よく極性化させて内腔形成を誘導するために,EHS(Engelbreth-Holm-Swarm)マウス肉腫から精製した可溶性の基底膜抽出物(basement membrane extract:BME)であるマトリゲル®(商品名)が培養担体として利用されるようになった15).BMEは,上皮細胞が生理的に利用する細胞外基質である基底膜の構成タンパク質,ラミニン(主成分),IV型コラーゲン,ヘパリン硫酸プロテオグリカン,エンタクチン/ニドゲンから構成されている.BMEを用いた3次元培養でMDCK細胞は,I型コラーゲンと比較してより速やかに頂底極性を確立し,2~3日以内に内腔を有するシストを形成する.またヒト正常乳腺上皮細胞株であるMCF10A細胞や,マウス正常乳腺上皮由来のEph4細胞,NMuMG細胞のようにI型コラーゲンゲル内では頂底極性を確立したシストを形成できないが,BMEを培養担体とすることで初めて内腔を有するシストを形成できる上皮細胞株も複数報告されている16–18).I型コラーゲンとBMEの決定的な違いは,BME中にはラミニンが存在することである.ラミニンは,基底膜の主要な構成タンパク質であり,発達中のシストの表面に細胞自身が基底膜を形成するきっかけとなり,この基底膜が頂端側と基底側の極性化を強く方向づける19).一方で,I型コラーゲンの中では上皮細胞は自身が分泌するラミニンにのみ依存して基底膜を形成する必要があるために,頂底極性化と内腔の形成が遅れると考えられている20).BMEは培地中に希釈して添加することでも上皮細胞の極性化と内腔形成を誘導できることから,薄いBMEのゲル上に細胞を播種し,培地に2%程度のBMEを添加する培養方法が開発され,この方法は2.5次元培養と呼ばれている(図2A参照)16, 21, 22).2.5次元培養によって抗体染色やイメージングが容易になり,MDCKやMCF10Aを用いた解析や血管内皮のネットワーク形成の解析にも応用されている.
一方で最近になり,幹細胞研究に3次元培養法が応用されるようになり,いわゆる“オルガノイド培養”と呼ばれる培養システムが確立された5, 23).オルガノイド培養では,組織幹細胞に対して生体内の幹細胞ニッチを模倣した種々の液性因子や細胞外基質を提供する.組織幹細胞はin vitroで,由来する組織を構成するさまざまな細胞タイプに分化する能力を維持し,また常に自己再生して幹細胞プールを補充することで持続的な増殖,維持が可能となる.このような生体外の環境下で,幹細胞は増殖するだけでなく,しばしば自己組織化してもとの組織に類似した管腔組織構造を形成する(図2C).これまでに,腸,胃,腎臓,肝臓,乳腺,肺・気道や前立腺など実に多様な組織のオルガノイド培養法が確立している.組織幹細胞の多くは,オルガノイドを形成する際の細胞外基質としてBMEを必要とすることから,上皮細胞が組織化する際の足場としての基底膜の重要性が示唆される24).さらに,胚性幹細胞(embryonic stem cells:ESC)や人工多能性幹細胞(induced pluripotent stem cells:iPSC)を多段階的に分化誘導し,3次元培養によって腸管や肝臓,膵臓,腎臓といった組織のオルガノイドを誘導可能なことが示されている4).
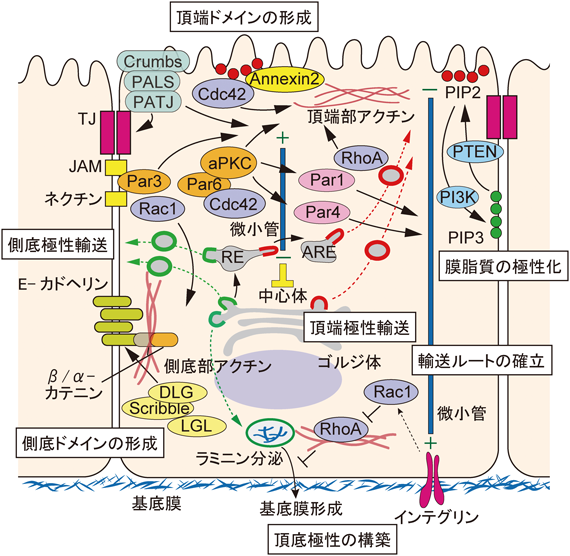
頂底極性の確立は上皮の管腔形態形成における重要なイベントであり,上皮細胞は頂底極性を獲得できなければ内腔を作ることができず,その機能を発揮できない.上皮細胞の極性化と内腔形成を制御する上皮極性プログラムは,以下の三つの細胞機構,すなわち1)極性軸構築機構,2)膜ドメイン識別機構,3)極性輸送機構の連携によって緻密に制御・維持されている(図3)25, 26).極性軸構築機構は,細胞間および細胞–基質間の接着分子によって頂底極性の軸を方向づけ,膜ドメイン識別機構と極性輸送機構を駆動する役割を持つ.膜ドメイン識別機構は,上皮細胞の頂端膜ドメインと側底膜ドメインを形成・維持するために,組織や種を超えて高度に保存された極性タンパク質複合体と脂質のセットを細胞膜へ動員する.これら膜ドメイン識別機構は,上皮の極性と機能を安定に維持するのに必要な物理的障壁であるタイトジャンクション(tight junction:TJ)の形成と,極性輸送ルートの確立に貢献する.Par複合体[Par(partitioning defective)3/Par6/aPKC(atypical protein kinase C)]とCrumbs複合体(Crumbs1/PATJ/PALS),またPTEN(phosphatase and tensin homolog)によって形成されるPIP2(phosphatidylinositol 4,5-bisphosphate)が頂端膜ドメインの確立を制御する.一方で,Scribble複合体(Scribble, DLG, LGL)とPI3K(phosphoinositide 3-kinase)によって合成されるPIP3(phosphatidylinositol 3,4,5-trisphosphate)は側底膜ドメインの形成を担っている.また,Par1とPar4/LKB1は,細胞骨格の極性化した配向と極性輸送ルートの確立に貢献するキナーゼである.極性輸送機構は,頂底軸に沿って極性化したアクチンと微小管からなる細胞骨格と協調しており,新たに合成されたタンパク質の分泌ルートと細胞膜からのリサイクルルートで構成される.頂端側と側底側の選別シグナルを有するカーゴ分子を正確に認識し,異なる輸送小胞に選別する.これらの小胞を細胞膜に輸送する際には,低分子量GTP(guanosine triphosphate)結合タンパク質であるRab,エクソシスト,SNARE(soluble N-ethylmaleimide-sensitive fusion protein attachment protein receptor)等が重要な役割を果たしている.ここではこのうち,頂底極性確立のトリガーとなる「極性軸構築機構」について概説する.
頂底極性軸の配向とその確立には,上皮細胞と細胞外基質との接着(細胞–基質間接着)および上皮細胞間の接着(細胞間接着)が中心的な役割を果たす.上皮細胞は,さまざまな膜貫通型の受容体を介して,周囲の細胞外基質を感知する.主な受容体はインテグリンファミリーに属し,コラーゲン,ラミニン,フィブロネクチンに結合する.なかでもβ1インテグリンは,ケラチノサイト,腎臓,膵臓,腺上皮などの上皮細胞に広く発現しており,ノックアウトマウス表現型解析により,内皮細胞などの他の細胞種と同様に,上皮細胞の極性の確立に中心的な役割を果たしていることが明らかになっている27).細胞外基質の存在しない環境で浮遊した上皮細胞をI型コラーゲンゲル,すなわち間質型の細胞外基質に接触させると,β1インテグリン(α2β1)によるRaclの活性化に依存して頂底極性化と内腔形成が誘導される.このとき基底部への細胞自身によるラミニンの分泌によって周囲に基底膜が形成される19).Rac1の不活性化やβ1インテグリンの機能を阻害する抗体は,基底膜へのラミニンの沈着を阻害し,頂部と底部の極性が逆転して細胞外基質側に頂端膜を向けたシストが形成される(極性反転表現型)19, 28).これらの表現型は,細胞に過剰なラミニンを添加する,もしくはラミニンを豊富に含むBMEに包埋することで回復する28, 29).これらの研究から,頂底極性軸の配向を決定するためには,インテグリン依存的な細胞と細胞外基質の相互作用と,それに続く上皮細胞自身によるラミニンを含む基底膜の形成が必要であることが示唆された.さらに,MDCK細胞では,ラミニンのリモデリングと極性の正しい方向性には,活性化されたRac1によるRhoA(Ras homolog family member A)–ROCK(Rho associated coiled-coil forming protein kinase)–ミオシンII経路の阻害が必要である.このことは,基底部のアクチン細胞骨格の適切な緊張が細胞外基質受容体にシグナルを送り,基底膜の形成を可能にしていると考えられる(図3)30).では,細胞外基質–β1インテグリンを介した基底膜からのシグナルは,どのように頂底極性軸の配向を制御するのであろうか.詳細なシグナル機序はいまだ明らかになっていないが,これには,頂底軸方向への微小管の配向による極性輸送機構が関与する可能性がある.微小管が頂部の中心体の焦点から頂底軸に平行な垂直方向に配向することは,極性を持った上皮細胞の特徴である.β1インテグリンを介した基底膜への接着とRac1の活性化の両方が,微小管プラス端のインテグリンへのリクルートに関連している31).また,MDCK細胞の3次元培養において,β1インテグリンを機能阻害抗体で阻害すると,Par3とPar6/aPKC複合体との相互作用が阻害され,Par3やaPKCが細胞質内に分散することが明らかになった32).さらに,通常は側底膜に存在するDLGが,反転した頂端膜に局在したことから,形成された基底膜がβ1インテグリンを介して,極性タンパク質複合体の位置や活性に影響を与えているのではないかと推測されている.また,この極性軸の制御メカニズムは,in vivoおよびin vitroの両方の初期胚における頂底極性の獲得にも不可欠であることが示されている33).
上皮細胞の極性軸の構築におけるもう一つの重要なイベントは,カドヘリンやJAM,ネクチンといった多数の接着分子を介した細胞間接着の確立である34).細胞間接着は,頂底極性の形成過程において,その後のタイトジャンクションの形成と細胞骨格の再編成,および極性輸送に必要なステップであると考えられている.代表的なカドヘリン分子であるE-カドヘリンはアドヘレンスジャンクション(adherence junction:AJ)を構成する主要なタンパク質で,β-カテニンと結合することでアクチン細胞骨格と相互作用する.β-カテニンはさらにα-カテニンと相互作用し,フォルミンやVASP(vasodilator-stimulated phosphoproteins)などのアクチン制御因子を側底膜にリクルートし,アクチン細胞骨格の制御に関与する35).また,Scribble複合体のメンバーであるScribbleとDLGは,E-カドヘリンによって側底膜にリクルートされ,E-カドヘリンを介した接着に参加する.JAMとネクチンは極性分子Par3をリクルートし,Par3はRac GEF(guanine nucleotide exchange factor)であるTiam1をリクルートする.Tiam1はRac1を活性化し,接合部でのアクチンダイナミクスを増大させる36–38).このように,上皮の細胞間接着は,側底膜ドメインの細胞骨格と極性分子群の局在と活性を制御することで,頂底極性軸の構築を促進していると考えられている(図3).しかし,極性軸の形成におけるこれらの分子の個々の役割は,複数のファミリーメンバーが機能的に重複しているために複雑であり,実際に生体内の上皮極性や内腔形成を細胞間接着がどのように制御しているのかは,まだほとんど明らかになっていない.
生物が内腔(中心の空洞)を形成する能力は,最も重要な発生プロセスの一つであり,上皮に限らず神経組織や血管組織でも認められ,その結果としてほとんどの種類の器官が形成されている.上皮組織の内腔形成には大きく二つのパターンが存在する.一つ目はすでに頂底極性を有する上皮シートを利用してその屈曲(形態変化)によって内腔を形成する方法と,もう一方は既存の空洞が存在しないところに上皮細胞が新たに内腔を形成する方法である39, 40).ここでは後者,すなわち頂底極性の確立に伴った新たな内腔形成の機構について概説する.
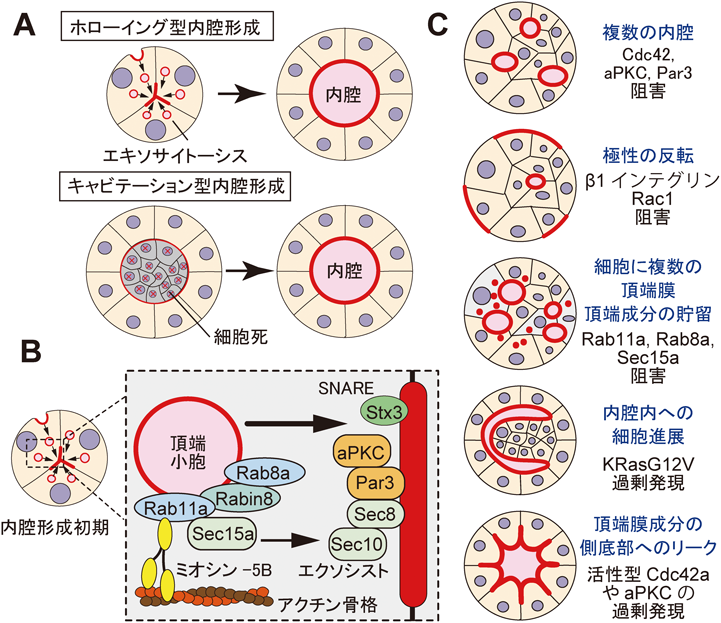
頂底極性化に伴う内腔形成は,内腔スペースの形成機序によって,ホローイング(Hollowing)あるいはキャビテーション(Cavitation)に分類される(図4A).ホローイングは急速に頂底極性を確立する環境で,頂端側への小胞輸送によって細胞外基質との接着面とは反対側の細胞間に頂端膜の構成因子が集積して内腔スペースが形成される.MDCK細胞をBME内で3次元培養する場合はこのプロセスをとり,2~3日以内で極性化して頂端膜で覆われた内腔を形成する.一方でキャビテーションは,極性化傾向が弱い細胞集団が増殖した際に,基質と接着する辺縁部の細胞がやがて頂底極性を形成し,内側の基質と接着していない細胞が選択的にアポトーシス等で死滅することで,中空の空間が形成されるプロセスである(図4A).BME中のMCF10Aや,I型コラーゲンゲル内で培養したMDCK細胞はキャビテーションによって内腔を形成する20, 41).実際,哺乳類の乳腺や唾液腺で内腔が形成される際にもアポトーシスが観察されている42, 43).これら内腔形成メカニズムの選択は細胞の極性化の効率に依存しており,相互に排他的ではない可能性がある.一方のプロセスが阻害されると,他方のプロセスが代償的に誘導されることがある44).
内腔を新たに形成するためには,頂端膜成分を含む細胞内小胞を細胞外基質との接着面とは反対側の細胞膜に運び,融合させる必要がある12, 20).この極性輸送には,上述した上皮極性プログラムの「膜識別化機構」が重要な働きをする.まずリン酸化酵素PTENによって形成されたPIP2が頂端膜に集積する.PIP2はAnnexin2をリクルートし,Annexin2は活性化したCdc42(cell division cycle 42)と相互作用してPar6/aPKC複合体を先端膜に結合・局在化させるとともに,細胞骨格であるアクチンケーブルが組織化され,頂端膜に向けた極性輸送の舞台が整う(図3参照)12).頂端部への小胞輸送の中心を担うのは,低分子量GTP結合タンパク質であるRabファミリーである.頂端膜成分はRab11a陽性の小胞に蓄積し,Rab11aはGTPaseカスケードを活性化してRabのGEFであるRabin8を頂端小胞にリクルートするとともに,Rab8aを活性化する12).このRabカスケードは,おそらくミオシン-5Bなどのモータータンパク質を小胞にリクルートすることで,頂端部のアクチンケーブルを介した小胞の輸送を促進する45).さらに,Rab11aおよびRab8aはエクソシストサブユニットSec15aを小胞にリクルートし,初期の頂端膜に局在するエクソシストサブユニットSec10との結合を促進することで,小胞を細胞膜につなぎとめる12).また,頂端小胞のエクソサイトーシスはSNAREタンパク質を介して行われる可能性が高く,Stx3(Syntaxin3)は重要な制御SNAREの一つとして作用すると考えられる(図4B)46).さらに,小胞の極性輸送と融合によって形成された初期の頂端部の内腔は,ROCKを介したミオシンIIによる収縮力の減弱と,TJの形成後のイオンおよび水チャネルタンパク質の局在による静水圧によって拡張・拡大すると考えられている47).
ここまで概説してきた頂底極性の制御や内腔形成に関わる数々の制御因子を抑制した場合,内腔構造にはどのような影響が表れるのであろうか.3次元培養下のMDCK細胞によるシストは,制御因子に応じてさまざまな内腔形成不全の表現型を呈する(図4C)48).通常は,シストの中心部に単一の内腔を形成するのに対して,頂端部の極性タンパク質複合体の構成因子(Cdc42, aPKC, Par3など)を抑制すると,複数の内腔がシスト内部に形成される(多重内腔).インテグリンとその下流のシグナル分子Rac1などが阻害されると,微小管の組織化が乱れ,頂端膜が基質側に逆転・反転したシストを形成することがある.また,小胞のテザーリングやターゲティングタンパク質(Rab8a, Rab11a,エクソシストタンパク質など)が破壊されると,シストを構成する細胞ごとに一つ以上の頂端膜が存在したり,頂端部タンパク質の細胞質内への滞留や多重内腔の表現型を呈する.また,活性型のKRas変異体の過剰発現は,細胞増殖の促進やアポトーシス抵抗性等によって,内腔が細胞で満たされる表現型を伴う.最後に,aPKCや活性型Cdc42変異体といった頂端部極性タンパク質を過剰発現すると,頂端膜が拡張して頂端部タンパク質が側底部膜にリークすることがある.
5. Wntシグナルによる頂底極性と内腔形成の制御
上述したように,これまでの研究の蓄積から上皮の頂底極性と内腔形成における細胞–基質間接着や細胞間接着といった細胞外シグナルの重要性は明らかにされてきた.一方で,発生学的に多くの液性因子は上皮管腔組織の発生と維持に重要であるが,上皮細胞の基本性質といえる頂底極性軸の確立や内腔形成への液性因子シグナルの関与についてはこれまでほとんど明らかになっていなかった.そんな中,筆者らのグループは,3次元培養下で頂底極性化して内腔を形成したMDCK細胞において,液性因子であるWntリガンドが特定の頂底軸方向に極性をもって分泌され,それらの受容体も特定の細胞膜ドメインに局在することを見いだした49, 50).
Wntは分子量が約4万の分泌性糖タンパク質で,ショウジョウバエから哺乳動物に至るまで種を超えて保存され,初期発生や形態形成,また,出生後の細胞において増殖,分化,細胞運動,極性など多彩な細胞機能を制御する51).Wntシグナル伝達経路には,β-カテニンを介して遺伝子の発現を制御するβ-カテニン経路と,β-カテニン経路とは独立し主として細胞骨格や細胞運動などを制御するβ-カテニン非依存性経路が存在する(図5)52).これまでに,リガンドとしてのWntはヒトおよびマウスにおいて19種類が同定されている51).また,Wntの受容体としては,7回膜貫通型のFrizzled[Fz(Frizzled)1~Fz10の10種類]に加え,共役受容体として1回膜貫通型のLRP(LDL receptor related protein)5, LRP6, Ror(receptor tyrosine kinase like orphan receptor)2, Ryk(receptor like tyrosine kinase)が存在する52).少なくとも,β-カテニン経路の活性化には1種類のFrizzled受容体とLRP5あるいはLRP6が共役受容体として機能する.一方,Wnt5aはFrizzled受容体とRor1あるいはRor2が共役受容体として複合体を形成し,β-カテニン非依存性経路を活性化する53).β-カテニン非依存性経路の一部は,平面内細胞極性(planar cell polarity:PCP)経路とも呼ばれ,頂底極性と直行する平面で細胞の配向や分裂をコントロールし,神経管の伸長や内耳有毛細胞の方向性などを制御することが知られている54, 55).モルフォゲンの一つであるWntの管腔臓器の発生における重要性はこれまでの多くの発生学的研究からも明らかであるが,上皮細胞の頂底極性や内腔形成におけるWntシグナルの役割については,他の液性因子同様にこれまでほとんど知られていない7, 56).
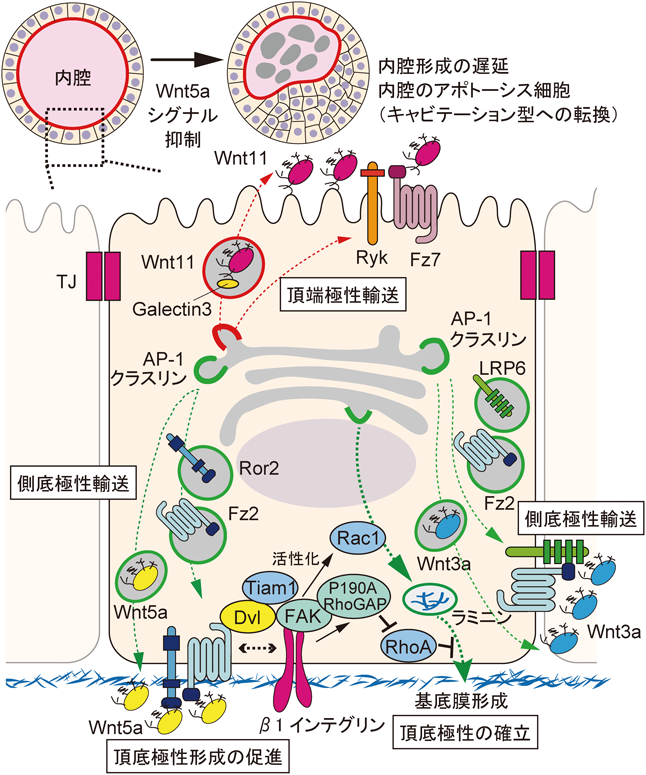
β-カテニン経路の代表的リガンドであるWnt3aとβ-カテニン非依存性経路のリガンドであるWnt5aは,極性化したMDCK細胞において,側底側に分泌された.またそれらの受容体であるFz2(Wnt5aとWnt3aの受容体),LRP6(Wnt3aの共役受容体),Ror2(Wnt5aの共役受容体)も側底膜に局在した.Wnt3a, Wnt5aおよびその受容体の側底側への極性輸送には,クラスリン被覆小胞とアダプタータンパク質AP-1が必要であった25, 49, 50).一方で,β-カテニン非依存性経路の別種のリガンドであるWnt11は頂端側に分泌され,その受容体であるFz7とRykは頂端側と側底側の両方の細胞膜に局在した50).Wnt11の頂端膜からの分泌には,Wnt3aとWnt5aには存在しないWnt11のN末端領域の複合型の糖鎖修飾とGalectin3が必要であった49).このように,Wnt受容体はWntリガンドと同じ極性ドメインに振り分けられるため,Wntシグナル経路の効率的なオートクライン活性化につながる可能性がある(図6).また,マウス胚の中腸の上皮においてRor2は側底膜に局在しており,リガンドであるWnt5aは間質細胞から分泌されることから,組織によってはパラクラインでのシグナル伝達も示唆される57).
では,このようなWntとその受容体の極性分泌は,上皮管腔組織の頂底極性の獲得と内腔形成に関与するのだろうか.MDCK細胞とラット小腸上皮細胞株IEC(intestinal epithelial cell)-6のマトリゲルを用いた3次元培養シスト形成モデルにおいて,Wnt5aはFz2およびRor2受容体を介して頂端部の内腔形成に関与していた50).基底側に分泌されたWnt5aは,側底膜に局在するFz2/Ror2を介して,基底膜との接着依存的なRac1の活性化を誘導し,オートクライン的に内腔形成を促進した.Wnt5aを発現しているMDCK細胞(I型)においてWnt5aシグナルを阻害すると,BMEを用いた3次元培養下での内腔形成が遅延するとともに,BMEを用いたMDCK細胞の内腔形成では本来認められないアポトーシスが誘導された.この表現型は,内腔形成のタイプが本来のホローイング型から細胞死を伴うキャビテーション型にスイッチしたことを意味しており,頂底極性確立の遅延が生じていると考えられた.筆者らはがん細胞において,Fz2受容体がα2インテグリン(β1インテグリンとヘテロ二量体を形成する)と結合してWnt5aシグナルが細胞–基質間接着を促進することを見いだしていた.Wnt5a–Fz2–Ror2複合体がα2/β1インテグリン複合体と同じ側底膜に局在することはシグナルのクロストークにおいて合理的であると思われる58).実際,Ror2ノックアウトマウス胚の腸上皮細胞は異常な集塊を形成して,頂底極性の喪失と細胞のランダムな配向を示す57).
さらに,ユニークな頂底極性解析モデルでもWnt5aシグナルの重要性が示されている.IEC-6細胞をマトリゲル上に播種して2.5次元培養すると,数時間以内に単一細胞レベルで自律的に極性化して,マトリゲルとは反対側に頂端部マーカータンパク質が集積したキャップ様の膜構造を形成する59).このモデルは,細胞間接着が確立する以前の,細胞–基質間接着のみに依存した上皮の頂底軸構築機構を解析可能なモデルと考えられる.この単一細胞頂底極性モデルにおいても,Wnt5aを発現抑制すると頂端部キャップ構造の形成が抑制された.IEC-6においてWnt5aは,細胞内のシグナル構成因子であるDvl(Dishevelled)を介してRac1を活性化し,DvlはFAK(focal adhesion kinase)の活性化とその基質であるp190A RhoGAP(GTPase-activating proteins)を介して側底部においてRhoAシグナルを抑制した.側底部におけるこの相反するRac1とRhoAの活性制御が頂底軸の形成に必要であると考えられた59).興味深いことに,MDCK細胞において明らかになってきた頂底軸形成シグナルすなわち,細胞外基質–β1インテグリンシグナルもまた,FAKの活性化とFAKによるp190A RhoGAPの活性化を介した側底部でのRhoA/ROCKの不活性化につながることがその後明らかになっている60).これらの結果から,Wnt5aとその受容体が,インテグリンと同様に側底膜ドメインに極性輸送され,Rac1の活性化,およびRhoAの抑制を誘導することで上皮極性と内腔形成の確立を促進する分子機構が初めて明らかになった.しかし,今回のin vitroでのBMEを培養担体に用いた解析では,BME中の過剰なラミニンによって,インテグリンシグナルの低下にもとづく基底膜の形成異常(ラミニンの分泌阻害)の表現型がマスクされている可能性がある.ラミニンを含まない担体を用いた場合は,Wnt5aシグナルの阻害によって,より重篤な頂底極性異常の表現型を呈する可能性もある.実際,Wnt5aは胎生期の腎臓の尿管芽に発現し,Wnt5aをノックアウトしたマウスでは,腎臓の無形成や低形成,重複尿管や尿管芽の形成不全といった重篤な表現型を示す61, 62).興味深いことに,発生過程の尿管上皮の基底膜部では,Wnt5aの欠損によって基底膜構成タンパク質であるラミニンとIV型コラーゲンのタンパク質発現が低下しており,基底膜の形成異常が認められる62).Wnt5aシグナルによる頂底極性の制御機構の発見によって,Wnt5aノックアウトマウスが呈する全身の重篤な表現型のいくつかを説明できる可能性がある63, 64).
6. Wntシグナル標的遺伝子ARL4Cによる上皮管腔伸長制御
上皮管腔組織は長く伸長し,最終的には連続した内腔を有する円筒形の構造(チューブ)を形成することで固有の機能を発揮しなければならない.この上皮管の形状は,組織ごとの機能に応じて多様性があり,枝分かれのない単純な管(腸腺/腸クリプトや汗腺など)もあれば,複雑に分岐した管(乳腺,肺,腎臓など)を形成する組織もある(図1A参照).このような上皮管腔構造は,事前の極性化の有無に関わらず上皮塊の一部が出芽(budding/バディング)して伸長することで形成され,側方への出芽と伸長を繰り返すことによって分岐する39).この上皮管の伸長を制御するシグナル伝達経路については,FGF(fibroblast growth factor)などの増殖因子やその受容体についてはよく知られているが,細胞内の標的遺伝子や制御分子についてはほとんど明らかになっていない.生体内の上皮管の伸長過程では,細胞の移動,形態変化,増殖,極性化・内腔形成,分化,アポトーシスといった多様な細胞機能が時空間的にダイナミックに変化する.これらのプロセスは生体の深部で起こるため,in vivoモデルを用いてこのプロセスの基盤となる分子メカニズムを解明することは困難であった.
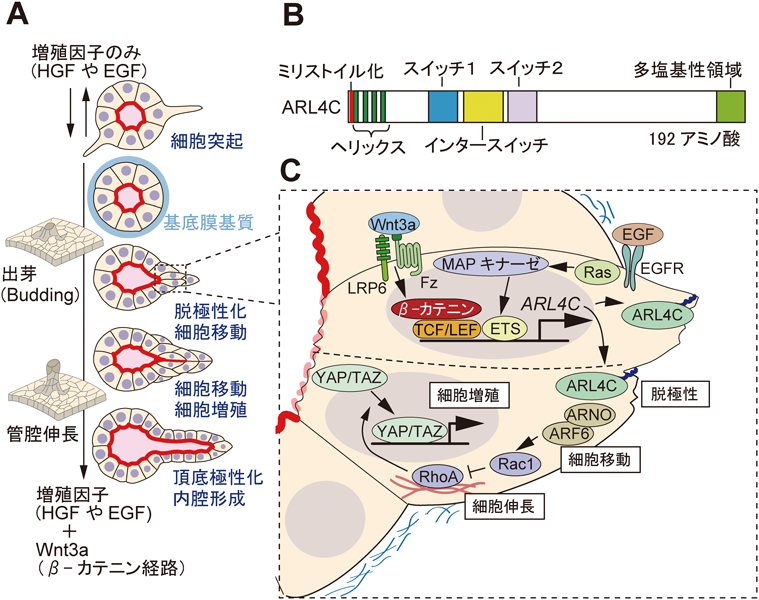
頂底極性や内腔形成と同様に,上皮管腔形成の解析にもin vitroの3次元培養モデルが応用されてきた.MDCK細胞をI型コラーゲンゲル内で培養し,形成されたシストに対してHGF(hepatocyte growth factor)を作用させると,細胞は部分的な上皮間葉転換(epithelial-mesenchymal transition:EMT)によって脱極性化して,基質側に向かって細胞が移動したのちに再度極性化して内腔を形成し,管状に伸長した構造を形成する65).このMDCK細胞に対するI型コラーゲンゲル内でのHGF誘導性管腔形成は単一の上皮細胞と単一の増殖因子を用いたシンプルなin vitroの管腔伸長モデルとして,増殖因子シグナルや細胞骨格制御等の研究が行われてきた66, 67).MDCK細胞以外でも,MCF10A,マウス腎臓由来上皮細胞株mIMCD3,マウス乳腺由来上皮細胞株Eph4などが,I型コラーゲンゲル内でHGF, TGFα(transforming growth factor α),EGF(epidermal growth factor),FGF2といった単一の増殖因子によって伸長した管腔構造を形成する68).しかし,上述したように,I型コラーゲンは間充織を構成する線維芽細胞が産生する細胞外基質であり,頂底極性化と内腔形成を誘導する活性に乏しく,形成される伸長構造はしばしば単なる細胞の突起であったり,細胞が鎖状に連なって内腔を有さない不完全なものが多かった.一方で,BME内では,MDCK細胞のHGF依存的な管腔形成が阻害されることから,基底膜タンパク質には頂底極性化を強く誘導する一方で,増殖因子依存的な上皮管伸長を抑制する作用がある69).しかし,腸管などのオルガノイドモデルではBME内で多数の液性因子の存在下,未熟ではあるものの管腔伸長が誘導される(図2C参照).では,3次元の基底膜基質環境で,強固に頂底極性化して内腔を形成している球状の上皮塊に対して,どのような細胞外シグナルが出芽と管腔伸長を誘導することができるのであろうか.
筆者らはBME内において液性因子シグナルによって誘導される新たなin vitroの上皮管腔伸長モデルを確立した.Wntシグナルによる頂底極性制御の解析に用いていたラット腸管上皮細胞株IEC-6細胞は,BME内で頂底極性化して,内腔を有する球状のシストを形成する59).当初,IEC-6に対してHGFやEGF, FGFといったさまざまな増殖因子を作用させたものの,他の細胞株と同様に,BME内では管腔の伸長は誘導されなかった(図7A).そこで,管腔伸長を誘導しうる増殖因子+αとなる第二の液性因子を探索した.その結果,増殖因子であるEGFまたはHGFに加えて,β-カテニン依存性経路の代表的リガンドであるWnt3aを同時に作用させたところ,シスト上皮の一部が急速に周囲のBMEに向かって出芽し,集団で移動・増殖しながら伸長して,内腔を有するチューブ構造を形成した(図7A)70).この現象は,Wnt3a単独での刺激や,β-カテニン非依存性経路を活性化するWnt5aと増殖因子との組み合わせでは誘導されなかった.Wnt3aによるβ-カテニン経路の活性化は主として標的遺伝子の発現を誘導することで細胞機能を制御する(図5参照).そこで,Wnt3aやEGF,またその組み合わせで細胞を刺激した際の遺伝子発現変化をマイクロアレイで解析したところ,興味深いことにWnt3aとEGFを組み合わせて作用させた場合にのみ,特異的に発現が上昇する複数の標的遺伝子が存在することが判明した70).Wnt3aとEGFシグナルの同時活性化によって誘導された標的遺伝子の中で,上皮の管腔伸長に必要な遺伝子としてARL4C[ADP-ribosylation factor(ARF)-like 4c]を同定した.
ARL4Cを含むARLファミリータンパク質(ARLs)は,低分子量GTP結合タンパク質ファミリーに属し,哺乳類に20以上のメンバーが存在するARFファミリータンパク質のサブグループの一つである.ARFファミリータンパク質は,アクチン骨格の制御や,分泌,エンドサイトーシス,ファゴサイトーシスなどの膜輸送経路を制御する重要なタンパク質であるが71),多くのARLタンパク質の機能はいまだ明らかになっていない72).ARL4遺伝子には,脊椎動物ではARL4A, ARL4C, ARL4Dという三つのアイソフォームが存在するが,ショウジョウバエには一つのオルソログしかない73, 74).ヒトのARL4C(ARL7とも呼ばれる)は,ARL4Aと69%,ARL4Dと59%のアミノ酸の同一性があり,他のARL4タンパク質と同様に細胞膜に局在する74, 75).ARL4Cの細胞膜への局在には,N末端のミリストイル化とC末端の9個のリシン残基またはアルギニン残基を含む多塩基性領域が必要である(図7B)75).また,C末端の多塩基性領域は,PIP2やPIP3との結合を介して,ARL4タンパク質の細胞膜局在化に重要な役割を果たす76).ARL4Cについては,これまで,HeLa細胞においてコレステロールの流出を促進することや77),ヒト腎細胞がん細胞においてα-チューブリンと相互作用して,トランスフェリンの初期エンドソームからリサイクリングエンドソームへの輸送に関与することが知られていた78).詳細な説明は割愛するが,ARL4AやARL4Dにもいくつか相互作用するタンパク質が同定されている79).なかでもARL4A, ARL4D, ARL4Cは共通して,ArfファミリーメンバーのGEFであるCytohesin 2/ARNO(Arf nucleotide-binding site opener)と直接相互作用してこれを細胞表面にリクルートする.ARL4Cは,ARNOを介してARF6(ADP-ribosylation factor 6)を活性化し,アクチン骨格のリモデリングを誘導することが報告されている75, 80).しかし,ARL4Cと上皮の形態形成やがんとの関連についてはこれまで明らかになっていなかった.
WntとEGFシグナルの同時活性化の下流では,β-カテニンと共役転写因子であるTCF4(T cell factor 4)が,Ras–MAPキナーゼの下流転写因子であるETSと相互作用することでARL4Cが発現した(図7C).ARL4Cは,IEC-6細胞においてARNO-ARF6経路を介してRac1を活性化し,RhoA-ROCKシグナルを抑制した.その結果,アクトミオシン細胞骨格が再編成され,円柱状に極性化している上皮細胞形態が伸長するとともに,一部脱極性化して基底膜側への細胞集団の移動が引き起こされた(図7C)70).野生型のARL4CをIEC-6に発現させると,EGF存在下で上皮管の伸長が誘導されるが,GDP(guanosine diphosphate)結合型変異体(27番目のトレオニンをアスパラギンに置換:T27N)は不活性であったことから,管腔の伸長を誘導するためには,GTP結合型のARL4Cが機能的な状態であることが示された.また,ARL4Cのユニークな特徴は,野生型の状態で活性を有する点である.これはARL4Cの通常より長いインタースイッチ領域によって,GDP結合型による不活性な構造変化が妨げられている可能性があり,ARL4Cは発現によって活性が制御されているのかもしれない(図7B)72, 81).さらに,BME内では増殖因子依存的な管腔伸長が認めれないMDCK細胞において,ARL4Cを発現させるとHGF依存性に内腔を有するチューブ状の上皮管構造が形成された70).これらの結果から,基底膜基質によって強い頂底極性化と内腔形成が誘導される環境下で,ARL4Cは管腔形態の伸長を誘導できることが示された.また,上皮の管腔伸長において,細胞の移動と増殖をどう連動させるかは重要な問題である.細胞増殖を伴わない細胞移動は管構造を破綻させ,細胞移動を伴わない細胞増殖では管状構造は形成できない.ARL4C依存的に細胞形態が伸長して移動を開始した細胞では特異的に細胞増殖の活性化因子であるYAP(Yes-associated protein)およびTAZ(transcriptional coactivator with PDZ-binding motif)が核内に強く蓄積しており,かつその移動細胞が増殖していることが判明した70).YAP/TAZは,ヒッポシグナル伝達経路の転写共役因子であり,その核移行は細胞増殖を強力に促進する82).一方で,YAP/TAZは細胞外基質の硬さや細胞形態のメカノセンサーとしても機能し,硬い基質や細胞形態の伸展によって核移行して細胞増殖を誘導することが明らかになっている83–85).どうやらARL4Cの発現は,コンパクトな円柱状に極性化した上皮細胞の形態変化を引き起こし,その結果YAPとTAZが核移行することで,移動する細胞における局所的な細胞増殖が誘導された(図7C).ARL4Cは成体においては,脳,脾臓,胸腺といった限られた組織で発現するが,胎生期(15日目)のマウス胚では,形成過程の毛包,歯芽,唾液腺,腎臓などの上皮原基に発現していた.特に,腎臓の尿管芽の遠位先端部では,ARL4Cの高い発現が認められ,腎臓での発現はFGFとWntの両シグナル経路に依存していた.尿管芽のin vitroでの3次元培養モデルにおいて,ARL4Cを発現抑制すると尿管芽の伸長と分岐が抑制されたことから,実際にin vivoでの管腔形態形成にARL4Cが関与していることが強く示唆された70).これらの知見から,Wnt5aによるβ-カテニン非依存性経路を介した頂底極性と内腔形成の制御に加え,Wnt/β-カテニン経路と増殖因子シグナルの協調による管腔伸長制御機構が明らかになり,管腔組織形成におけるWntシグナルの多面的な重要性が明らかになった.
ヒトがんの約90%は上皮組織を発生母地とし,がんを原因とする死亡の多くは,腫瘍の隣接組織への浸潤と引き続く遠隔臓器への転移に起因している86).上皮細胞の周囲間質へ向けた集団移動という点において,管腔組織形成と腫瘍形成は類似しており,がんの発生は,誤った時と場所,あるいは誤った範囲で生じた,上皮の異常かつ破滅的な形態形成と捉えることができるかもしれない.実際,正常な管腔組織の形成過程に関わる多くの細胞機構が,がんにおいて制御異常を来し,過剰な細胞の移動や増殖,頂底極性の消失,管状構造の破綻などが認められる25).
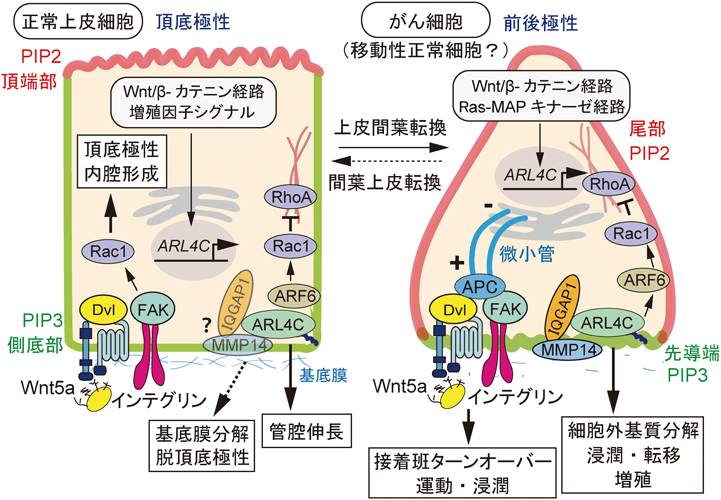
Wnt5aシグナルによる細胞–基質間接着の制御は,がんにどのように関わるのであろうか.上述したように,Wnt5a–Fz2/Ror2シグナルは正常上皮において側底側でインテグリン–FAKシグナルと細胞–基質間接着を制御し,Racの活性化を介して頂底極性化と内腔形成を促進する.この意味でWnt5aシグナルの活性化はがんの浸潤や転移に拮抗する可能性が示唆される.しかし,実際にはWnt5aは胃がん,前立腺がん,膵がんや悪性黒色腫等をはじめとする多くのヒトがんにおいて過剰発現し,細胞運動や浸潤能を促進して腫瘍の悪性化に関与する87–89).このWnt5aシグナルの一見相反する機能は,細胞の極性の状態によって変化する可能性がある.筆者らは,頂底極性を喪失して運動するがん細胞において,Wnt5aと受容体のFz2は細胞の進行方向の先導端に集積し,Fz2は同じく先導端に局在するα2/β1インテグリンと相互作用することを明らかにした.先導端において,Fz2と結合するWntシグナルの構成因子Dvlは,さらにインテグリンと結合しているFAKおよび微小管プラス端タンパク質APC(adenomatous polyposis coli)と相互作用する.Wnt5aはDvlを介して微小管のプラス端を接着班にリクルートして細胞–基質間接着と接着班のターンオーバーを促進し,がん細胞の運動を亢進させた(図8)58).がん細胞はしばしば,EMTを起こすことで「頂底極性」を喪失し,浸潤性と運動性を獲得する際に「前後極性」へと極性状態を転換する90).Wnt5aとFz2が極性輸送される上皮細胞の側底部ドメインは膜脂質PIP3の集積によって規定され,同じく前後極性における先導端もまた,PIP3の集積によって規定されている膜ドメインであることは興味深い91).Wnt5aシグナルがインテグリンシグナルと細胞–基質間接着を促進するメカニズムは共通であっても,がん化によって極性状態がハイジャックされる(転換する)と頂底極性シグナルががんの悪性化につながる機構の一端が明らかになった(図8).
一方で,筆者らが見いだしたWnt/β-カテニンシグナルと増殖因子(Ras–MAPキナーゼ)シグナルの協調によるARL4Cを介した管腔伸長機構は,どのようにがんに関わるのであろうか.β-カテニンやAxinなどのWnt/β-カテニン経路の構成要素の遺伝子変異は,大腸がんや肝がんで頻繁に観察される92),一方,EGFR(epidermal growth factor receptor)やKRas遺伝子の変異,HER2(human epidermal growth factor receptor)の過剰発現は,肺腺がんでしばしば検出される93).実際,ARL4Cは大腸がんや肺がん,肝がん等で高頻度にβ-カテニンまたはRas–MAPキナーゼ依存的に過剰発現し,ARL4Cの発現抑制はこれらのがん細胞の増殖や運動・浸潤能を著しく低下させた94–96).また大腸がんや肺がんにおいても,ARL4Cの発現は管腔伸長形成と同様に,Racの活性化,RhoAの阻害,YAPとTAZの核内局在化を制御していた.その後,別の研究グループから,グリオブラストーマ(膠芽腫),腎細胞がん,胃がん,卵巣がん等において,ARL4Cががんの悪性化に寄与することが相次いで報告されている97–101).これらの研究から,Wntシグナルや増殖因子・Ras–MAPキナーゼシグナルという管腔伸長シグナルの異常活性化によってARL4Cが恒常的に過剰発現し,がんの悪性化につながる共通の分子機構が明らかになった(図8).また筆者らは,ARL4Cを標的とした抗腫瘍薬の開発にも取り組んでいる.ARL4Cのような細胞内の分子を標的とする際には,核酸医薬品は理論的には有効な手法と考えられているが,血中での不安定性や臓器到達性の非効率さの点から臨床応用はいまだ進んでいない102).筆者らは,これらの欠点を克服したARL4Cに対する修飾型アンチセンス核酸(antisense oligonucleotide:ASO)を合成して,肝臓や肺に腫瘍細胞を同所移植したマウスモデルにARL4C ASOを皮下投与したところ,抗腫瘍効果があることを確認した.したがって,ARL4Cはがん治療の新たな分子標的になる可能性がある95, 96).
筆者らはARL4C以外にも,3次元培養下で胎生期マウスの尿管芽形成を誘導する実験系において,Wnt依存的に発現して尿管伸長を制御する因子としてGREB1(growth regulation by estrogen in breast cancer 1)を見いだした.GREB1はエストロゲン受容体(estrogen receptor:ER)の核内共役因子であり,乳がん細胞のホルモン依存的増殖を促進する103).Wntシグナルに異常のあるがんとGREB1の関連をデータベースで解析したところ,ホルモン感受性のない肝芽腫においてGREB1が高発現していた104).肝芽腫は小児の肝臓に発症するまれな悪性腫瘍で,その80%近くの症例にβ-カテニンの活性型変異を認めるが,その下流シグナルは明らかになっておらず,また分子標的治療薬の開発も進んでいない105).肝芽腫細胞においてGREB1はWntシグナルの直接の標的遺伝子であり,肝芽腫の90%の症例でGREB1は腫瘍特異的に高発現していた.GREB1はSmad2/3と結合することにより,TGFβ(transforming growth factor β)シグナルを抑制する結果,肝芽腫細胞の増殖を促進した.さらに,GREB1を標的としたASOは肝芽腫の同所移植マウスモデルにおける腫瘍形成を強く阻害した104).このように,Wntシグナルによる上皮管腔形成機構を基盤にして見いだした複数の分子が,がんにおける創薬の新規標的となる可能性が示された.
本稿で紹介してきたように,上皮の管腔組織形成における細胞自律的な頂底極性化や内腔形成の分子機序に関する膨大な知見の多くが3次元細胞培養モデルを用いた研究から明らかになってきた.これらの研究では,細胞間および細胞外基質との相互作用が,単一の管腔の形成と拡大に先立って起こる頂底極性の確立にきわめて重要であることが示されてきた.さらに,液性因子であるWnt5aとその受容体が基底側に極性輸送され,頂底極性の確立と内腔形成を促進する機構が明らかになった.Wnt5aはβ-カテニン非依存性経路を活性化するリガンドであり,頂底極性と垂直な平面の細胞極性PCPを制御することが知られているが,その制御機構の詳細は未解明である106).少なくとも腎臓と腸管における管腔の伸長形成にはPCPによる細胞の配列の制御が重要であることが明らかになっており,これらの臓器はWnt5aの欠損によって重篤な組織形成の異常が認められる107–109).大部分のPCP経路の構成因子や,PCPによって制御される繊毛構造は頂端側に局在することから110),Wntシグナルによる頂底極性とPCPの制御が互いにどのようにクロストークして組織形成に関わるのか,さらなる研究が期待される.
今後の上皮管腔組織形成に関わる大きな課題は,筆者らも取り組んできた管腔伸長と分岐の形態形成機構を,単一細胞かつ分子レベルで解明することだろう.Wnt/Ras–ARL4C軸の発見は管腔伸長メカニズムの一端を明らかにしたが,まだ未解明の問題もある.ARL4Cが制御する細胞内シグナルはRacの活性化とRhoAの抑制による細胞移動と,YAP/TAZによる増殖制御であった.しかし,頂底極性を確立している正常上皮において,Racの活性化とRhoの抑制はむしろ頂底極性軸の構築を促し,細胞の移動を抑制する可能性がある.ARL4Cが正常上皮の極性状態を変化させる機構ははっきりしていないが,最近筆者らがARL4Cによる膵がんの浸潤制御機構を解析する過程で,一つの可能性が示唆されている.ARL4Cは正常またはがん細胞において,IQGAP1(IQ motif containing GTPase activating protein 1)と結合し,IQGAP1とともにMMP14(matrix metalloproteinase-14,別名MT1-MMP)を移動方向のPIP3陽性の細胞膜へリクルートし,細胞外基質の分解と浸潤・転移を誘導する(投稿中)111).MMP14はラミニンを含む基底膜の構成タンパク質を分解する112).ARL4Cが正常上皮において,PIP3陽性の側底膜にMMP14をリクルートして基底膜を分解するであれば,局所的に頂底軸が変化する可能性があり,非腫瘍細胞の形態形成機構としては合理的かもしれない(図8参照).また,今後は細胞株では再現できない管腔組織における個々の細胞の分化状態と組織化の関連性を理解することも重要だろう.組織幹細胞を含む生体と類似した細胞種からなるオルガノイドは未成熟な構造ではあるものの,今後組織化の研究領域においても強力な解析ツールになると思われる.筆者らも,胎生期マウスの唾液腺上皮を用いた器官培養モデルで,Wnt/β-カテニンシグナルの一時的な活性化が,伸長末端部のキャップ上皮の腺細胞分化と頂底極性化を強く抑制することで分岐伸長形態形成を維持する機構を明らかにしている113).さらに,オルガノイドモデルに上皮以外の細胞ファクターを加えることも生理的な組織化プロセスの理解には欠かせないだろう.今後は,ゲノム編集技術,組織透明化技術やライトシート顕微鏡イメージング,1細胞シークエンスやVisiumなどの空間的トランスクリプトーム解析など,次々と登場する新しい技術を取り入れながら,生体内でブラックボックスであった臓器ごとの管腔形成と臓器成熟のプロセスを分子レベルで解明していきたい.
最後に,管腔組織形成とがんとの関係についても,腫瘍細胞が巧みに管腔形態形成の制御シグナルを乗っ取り,悪用する共通の分子機構が明らかになってきた.しかし,がん種によっては遺伝子変異の蓄積や細胞選択によって,正常の組織形成過程では起こりえないプロセスで腫瘍化することもあるだろう.その意味で,成人がんと比べて遺伝子異常の頻度が大幅に少ない上皮性の小児固形がんは,正常の組織形成の制御プログラムを共有している可能性が高い114).また,小児固形がんは発症頻度が少なく,分子標的薬が開発されていない分野でもあり,今後は臨床医学研究者と連携して,発生や組織形成の解析モデルから得られた知見を,小児がんの新たな分子標的や治療法の開発につなげていくような研究も展開していきたいと考えている.
謝辞Acknowledgments
本稿で紹介いたしました研究は,大阪大学大学院医学系研究科・菊池章教授に多大なご指導・ご助言を賜りました.この場をかりて深くお礼申し上げます.また,ともに研究を行い,サポートしていただいた多くの先生方,同僚,学生,技術員や秘書の皆様にも深く感謝申し上げます.
引用文献References
1) Gumbiner, B.M. (1992) Epithelial morphogenesis. Cell, 69, 385–387.
2) Andrew, D.J. & Ewald, A.J. (2010) Morphogenesis of epithelial tubes: Insights into tube formation, elongation, and elaboration. Dev. Biol., 341, 34–55.
3) Spurlin, J.W. 3rd. & Nelson, C.M. (2017) Building branched tissue structures: From single cell guidance to coordinated construction. Philos. Trans. R. Soc. Lond. B Biol. Sci., 372, 20150527.
4) Hofer, M. & Lutolf, M.P. (2021) Engineering organoids. Nat. Rev. Mater., 6, 402–420.
5) Kim, J., Koo, B.K., & Knoblich, J.A. (2020) Human organoids: Model systems for human biology and medicine. Nat. Rev. Mol. Cell Biol., 21, 571–584.
6) van Amerongen, R. & Berns, A. (2006) Knockout mouse models to study Wnt signal transduction. Trends Genet., 22, 678–689.
7) Miller, R.K. & McCrea, P.D. (2010) Wnt to build a tube: Contributions of Wnt signaling to epithelial tubulogenesis. Dev. Dyn., 239, 77–93.
8) Merenda, A., Fenderico, N., & Maurice, M.M. (2020) Wnt signaling in 3D: Recent advances in the applications of intestinal organoids. Trends Cell Biol., 30, 60–73.
9) Gray, R.S., Cheung, K.J., & Ewald, A.J. (2010) Cellular mechanisms regulating epithelial morphogenesis and cancer invasion. Curr. Opin. Cell Biol., 22, 640–650.
10) Plygawko, A.T., Kan, S., & Campbell, K. (2020) Epithelial-mesenchymal plasticity: Emerging parallels between tissue morphogenesis and cancer metastasis. Philos. Trans. R. Soc. Lond. B Biol. Sci., 375, 20200087.
11) O’Brien, L.E., Zegers, M.M., & Mostov, K.E. (2002) Opinion: Building epithelial architecture: Insights from three-dimensional culture models. Nat. Rev. Mol. Cell Biol., 3, 531–537.
12) Bryant, D.M., Datta, A., Rodríguez-Fraticelli, A.E., Peränen, J., Martín-Belmonte, F., & Mostov, K.E. (2010) A molecular network for de novo generation of the apical surface and lumen. Nat. Cell Biol., 12, 1035–1045.
13) Martin-Belmonte, F., Gassama, A., Datta, A., Yu, W., Rescher, U., Gerke, V., & Mostov, K. (2007) PTEN-mediated apical segregation of phosphoinositides controls epithelial morphogenesis through Cdc42. Cell, 128, 383–397.
14) Greenburg, G. & Hay, E.D. (1982) Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells. J. Cell Biol., 95, 333–339.
15) Kleinman, H.K., McGarvey, M.L., Hassell, J.R., Star, V.L., Cannon, F.B., Laurie, G.W., & Martin, G.R. (1986) Basement membrane complexes with biological activity. Biochemistry, 25, 312–318.
16) Debnath, J., Muthuswamy, S.K., & Brugge, J.S. (2003) Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods, 30, 256–268.
17) Campbell, J.J. & Watson, C.J. (2009) Three-dimensional culture models of mammary gland. Organogenesis, 5, 43–49.
18) Berglund, F.M., Weerasinghe, N.R., Davidson, L., Lim, J.C., Eickholt, B.J., & Leslie, N.R. (2013) Disruption of epithelial architecture caused by loss of PTEN or by oncogenic mutant p110α/PIK3CA but not by HER2 or mutant AKT1. Oncogene, 32, 4417–4426.
19) O’Brien, L.E., Jou, T.S., Pollack, A.L., Zhang, Q., Hansen, S.H., Yurchenco, P., & Mostov, K.E. (2001) Rac1 orientates epithelial apical polarity through effects on basolateral laminin assembly. Nat. Cell Biol., 3, 831–838.
20) Martín-Belmonte, F., Yu, W., Rodríguez-Fraticelli, A.E., Ewald, A.J., Werb, Z., Alonso, M.A., & Mostov, K. (2008) Cell-polarity dynamics controls the mechanism of lumen formation in epithelial morphogenesis. Curr. Biol., 18, 507–513.
21) Streuli, C.H., Bailey, N., & Bissell, M.J. (1991) Control of mammary epithelial differentiation: Basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. J. Cell Biol., 115, 1383–1395.
22) Yu, W., Fang, X., Ewald, A., Wong, K., Hunt, C.A., Werb, Z., Matthay, M.A., & Mostov, K. (2007) Formation of cysts by alveolar type II cells in three-dimensional culture reveals a novel mechanism for epithelial morphogenesis. Mol. Biol. Cell, 18, 1693–1700.
23) Clevers, H. (2016) Modeling development and disease with organoids. Cell, 165, 1586–1597.
24) Kaushik, G., Ponnusamy, M.P., & Batra, S.K. (2018) Concise review: Current status of three-dimensional organoids as preclinical models. Stem Cells, 36, 1329–1340.
25) Tanos, B. & Rodriguez-Boulan, E. (2008) The epithelial polarity program: Machineries involved and their hijacking by cancer. Oncogene, 27, 6939–6957.
26) Rodriguez-Boulan, E. & Macara, I.G. (2014) Organization and execution of the epithelial polarity programme. Nat. Rev. Mol. Cell Biol., 15, 225–242.
27) Lee, J.L. & Streuli, C.H. (2014) Integrins and epithelial cell polarity. J. Cell Sci., 127, 3217–3225.
28) Yu, W., Datta, A., Leroy, P., O’Brien, L.E., Mak, G., Jou, T.S., Matlin, K.S., Mostov, K.E., & Zegers, M.M. (2005) B1-integrin orients epithelial polarity via Rac1 and laminin. Mol. Biol. Cell, 16, 433–445.
29) Myllymäki, S.M., Teräväinen, T.P., & Manninen, A. (2011) Two distinct integrin-mediated mechanisms contribute to apical lumen formation in epithelial cells. PLoS One, 6, e19453.
30) Yu, W., Shewan, A.M., Brakeman, P., Eastburn, D.J., Datta, A., Bryant, D.M., Fan, Q.W., Weiss, W.A., Zegers, M.M., & Mostov, K.E. (2008) Involvement of RhoA, ROCK I and myosin II in inverted orientation of epithelial polarity. EMBO Rep., 9, 923–929.
31) Akhtar, N. & Streuli, C.H. (2013) An integrin-ILK-microtubule network orients cell polarity and lumen formation in glandular epithelium. Nat. Cell Biol., 15, 17–27.
32) Li, R. & Pendergast, A.M. (2011) Arg kinase regulates epithelial cell polarity by targeting β1-integrin and small GTPase pathways. Curr. Biol., 21, 1534–1542.
33) Bedzhov, I. & Zernicka-Goetz, M. (2014) Self-organizing properties of mouse pluripotent cells initiate morphogenesis upon implantation. Cell, 156, 1032–1044.
34) Harris, T.J. & Tepass, U. (2010) Adherens junctions: From molecules to morphogenesis. Nat. Rev. Mol. Cell Biol., 11, 502–514.
35) Navarro, C., Nola, S., Audebert, S., Santoni, M.J., Arsanto, J.P., Ginestier, C., Marchetto, S., Jacquemier, J., Isnardon, D., Le Bivic, A., et al. (2005) Junctional recruitment of mammalian Scribble relies on E-cadherin engagement. Oncogene, 24, 4330–4339.
36) Ebnet, K., Suzuki, A., Horikoshi, Y., Hirose, T., Meyer Zu Brickwedde, M.K., Ohno, S., & Vestweber, D. (2001) The cell polarity protein ASIP/PAR-3 directly associates with junctional adhesion molecule (JAM). EMBO J., 20, 3738–3748.
37) Ooshio, T., Fujita, N., Yamada, A., Sato, T., Kitagawa, Y., Okamoto, R., Nakata, S., Miki, A., Irie, K., & Takai, Y. (2007) Cooperative roles of Par-3 and afadin in the formation of adherens and tight junctions. J. Cell Sci., 120, 2352–2365.
38) Chen, X. & Macara, I.G. (2005) Par-3 controls tight junction assembly through the Rac exchange factor Tiam1. Nat. Cell Biol., 7, 262–269.
39) Lubarsky, B. & Krasnow, M.A. (2003) Tube morphogenesis: Making and shaping biological tubes. Cell, 112, 19–28.
40) Datta, A., Bryant, D.M., & Mostov, K.E. (2011) Molecular regulation of lumen morphogenesis. Curr. Biol., 21, R126–R136.
41) Debnath, J., Mills, K.R., Collins, N.L., Reginato, M.J., Muthuswamy, S.K., & Brugge, J.S. (2002) The role of apoptosis in creating and maintaining luminal space within normal and oncogene-expressing mammary acini. Cell, 111, 29–40.
42) Humphreys, R.C., Krajewska, M., Krnacik, S., Jaeger, R., Weiher, H., Krajewski, S., Reed, J.C., & Rosen, J.M. (1996) Apoptosis in the terminal endbud of the murine mammary gland: A mechanism of ductal morphogenesis. Development, 122, 4013–4022.
43) Jaskoll, T. & Melnick, M. (1999) Submandibular gland morphogenesis: Stage-specific expression of TGF-α/EGF, IGF, TGF-β, TNF, and IL-6 signal transduction in normal embryonic mice and the phenotypic effects of TGF-β2, TGF-β3, and EGF-r null mutations. Anat. Rec., 256, 252–268.
44) Davis, G.E. & Camarillo, C.W. (1996) An α2β1 integrin-dependent pinocytic mechanism involving intracellular vacuole formation and coalescence regulates capillary lumen and tube formation in three-dimensional collagen matrix. Exp. Cell Res., 224, 39–51.
45) Roland, J.T., Bryant, D.M., Datta, A., Itzen, A., Mostov, K.E., & Goldenring, J.R. (2011) Rab GTPase-Myo5B complexes control membrane recycling and epithelial polarization. Proc. Natl. Acad. Sci. USA, 108, 2789–2794.
46) Sharma, N., Low, S.H., Misra, S., Pallavi, B., & Weimbs, T. (2006) Apical targeting of syntaxin 3 is essential for epithelial cell polarity. J. Cell Biol., 173, 937–948.
47) Ferrari, A., Veligodskiy, A., Berge, U., Lucas, M.S., & Kroschewski, R. (2008) ROCK-mediated contractility, tight junctions and channels contribute to the conversion of a preapical patch into apical surface during isochoric lumen initiation. J. Cell Sci., 121, 3649–3663.
48) Rodríguez-Fraticelli, A.E. & Martín-Belmonte, F. (2013) Methods for analysis of apical lumen trafficking using micropatterned 3D systems. Methods Cell Biol., 118, 105–123.
49) Yamamoto, H., Awada, C., Hanaki, H., Sakane, H., Tsujimoto, I., Takahashi, Y., Takao, T., & Kikuchi, A. (2013) The apical and basolateral secretion of Wnt11 and Wnt3a in polarized epithelial cells is regulated by different mechanisms. J. Cell Sci., 126, 2931–2943.
50) Yamamoto, H., Awada, C., Matsumoto, S., Kaneiwa, T., Sugimoto, T., Takao, T., & Kikuchi, A. (2015) Basolateral secretion of Wnt5a in polarized epithelial cells is required for apical lumen formation. J. Cell Sci., 128, 1051–1063.
51) Steinhart, Z. & Angers, S. (2018) Wnt signaling in development and tissue homeostasis. Development, 145, dev146589.
52) Kikuchi, A., Yamamoto, H., & Sato, A. (2009) Selective activation mechanisms of Wnt signaling pathways. Trends Cell Biol., 19, 119–129.
53) Nishita, M., Enomoto, M., Yamagata, K., & Minami, Y. (2010) Cell/tissue-tropic functions of Wnt5a signaling in normal and cancer cells. Trends Cell Biol., 20, 346–354.
54) Oh, E.C. & Katsanis, N. (2013) Context-dependent regulation of Wnt signaling through the primary cilium. J. Am. Soc. Nephrol., 24, 10–18.
55) Wang, M., Marco, P., Capra, V., & Kibar, Z. (2019) Update on the role of the non-canonical Wnt/planar cell polarity pathway in neural tube defects. Cells, 8, 1198.
56) Karner, C., Wharton, K.A., & Carroll, T.J. (2006) Apical-basal polarity, Wnt signaling and vertebrate organogenesis. Semin. Cell Dev. Biol., 17, 214–222.
57) Yamada, M., Udagawa, J., Matsumoto, A., Hashimoto, R., Hatta, T., Nishita, M., Minami, Y., & Otani, H. (2010) Ror2 is required for midgut elongation during mouse development. Dev. Dyn., 239, 941–953.
58) Matsumoto, S., Fumoto, K., Okamoto, T., Kaibuchi, K., & Kikuchi, A. (2010) Binding of APC and dishevelled mediates Wnt5a-regulated focal adhesion dynamics in migrating cells. EMBO J., 29, 1192–1204.
59) Gon, H., Fumoto, K., Ku, Y., Matsumoto, S., & Kikuchi, A. (2013) Wnt5a signaling promotes apical and basolateral polarization of single epithelial cells. Mol. Biol. Cell, 24, 3764–3774.
60) Bryant, D.M., Roignot, J., Datta, A., Overeem, A.W., Kim, M., Yu, W., Peng, X., Eastburn, D.J., Ewald, A.J., Werb, Z., et al. (2014) A molecular switch for the orientation of epithelial cell polarization. Dev. Cell, 31, 171–187.
61) Huang, L., Xiao, A., Choi, S.Y., Kan, Q., Zhou, W., Chacon-Heszele, M.F., Ryu, Y.K., McKenna, S., Zuo, X., Kuruvilla, R., et al. (2014) Wnt5a is necessary for normal kidney development in zebrafish and mice. Nephron Exp. Nephrol., 128, 80–88.
62) Pietilä, I., Prunskaite-Hyyryläinen, R., Kaisto, S., Tika, E., van Eerde, A.M., Salo, A.M., Garma, L., Miinalainen, I., Feitz, W.F., Bongers, E.M., et al. (2016) Wnt5a deficiency leads to anomalies in ureteric tree development, tubular epithelial cell organization and basement membrane integrity pointing to a role in kidney collecting duct patterning. PLoS One, 11, e0147171.
63) Li, C., Xiao, J., Hormi, K., Borok, Z., & Minoo, P. (2002) Wnt5a participates in distal lung morphogenesis. Dev. Biol., 248, 68–81.
64) Cervantes, S., Yamaguchi, T.P., & Hebrok, M. (2009) Wnt5a is essential for intestinal elongation in mice. Dev. Biol., 326, 285–294.
65) Pollack, A.L., Runyan, R.B., & Mostov, K.E. (1998) Morphogenetic mechanisms of epithelial tubulogenesis: MDCK cell polarity is transiently rearranged without loss of cell-cell contact during scatter factor/hepatocyte growth factor-induced tubulogenesis. Dev. Biol., 204, 64–79.
66) Tushir, J.S. & D’Souza-Schorey, C. (2007) ARF6-dependent activation of ERK and Rac1 modulates epithelial tubule development. EMBO J., 26, 1806–1819.
67) Gierke, S. & Wittmann, T. (2012) EB1-recruited microtubule +TIP complexes coordinate protrusion dynamics during 3D epithelial remodeling. Curr. Biol., 22, 753–762.
68) Zegers, M.M. (2014) 3D in vitro cell culture models of tube formation. Semin. Cell Dev. Biol., 31, 132–140.
69) Santos, O.F. & Nigam, S.K. (1993) HGF-induced tubulogenesis and branching of epithelial cells is modulated by extracellular matrix and TGF-β. Dev. Biol., 160, 293–302.
70) Matsumoto, S., Fujii, S., Sato, A., Ibuka, S., Kagawa, Y., Ishii, M., & Kikuchi, A. (2014) A combination of Wnt and growth factor signaling induces Arl4c expression to form epithelial tubular structures. EMBO J., 33, 702–718.
71) D’Souza-Schorey, C. & Chavrier, P. (2006) ARF proteins: Roles in membrane traffic and beyond. Nat. Rev. Mol. Cell Biol., 7, 347–358.
72) Burd, C.G., Strochlic, T.I., & Setty, S.R. (2004) Arf-like GTPases: Not so Arf-like after all. Trends Cell Biol., 14, 687–694.
73) Li, Y., Kelly, W.G., Logsdon, J.M. Jr., Schurko, A.M., Harfe, B.D., Hill-Harfe, K.L., & Kahn, R.A. (2004) Functional genomic analysis of the ADP-ribosylation factor family of GTPases: Phylogeny among diverse eukaryotes and function in C. elegans. FASEB J., 18, 1834–1850.
74) Jacobs, S., Schilf, C., Fliegert, F., Koling, S., Weber, Y., Schürmann, A., & Joost, H.G. (1999) ADP-ribosylation factor (ARF)-like 4, 6, and 7 represent a subgroup of the ARF family characterization by rapid nucleotide exchange and a nuclear localization signal. FEBS Lett., 456, 384–388.
75) Hofmann, I., Thompson, A., Sanderson, C.M., & Munro, S. (2007) The Arl4 family of small G proteins can recruit the cytohesin Arf6 exchange factors to the plasma membrane. Curr. Biol., 17, 711–716.
76) Heo, W.D., Inoue, T., Park, W.S., Kim, M.L., Park, B.O., Wandless, T.J., & Meyer, T. (2006) PI(3,4,5)P3 and PI(4,5)P2 lipids target proteins with polybasic clusters to the plasma membrane. Science, 314, 1458–1461.
77) Engel, T., Lueken, A., Bode, G., Hobohm, U., Lorkowski, S., Schlueter, B., Rust, S., Cullen, P., Pech, M., Assmann, G., et al. (2004) ADP-ribosylation factor (ARF)-like 7 (ARL7) is induced by cholesterol loading and participates in apolipoprotein AI-dependent cholesterol export. FEBS Lett., 566, 241–246.
78) Wei, S.M., Xie, C.G., Abe, Y., & Cai, J.T. (2009) ADP-ribosylation factor like 7 (ARL7) interacts with α-tubulin and modulates intracellular vesicular transport. Biochem. Biophys. Res. Commun., 384, 352–356.
79) Gillingham, A.K. & Munro, S. (2007) The small G proteins of the Arf family and their regulators. Annu. Rev. Cell Dev. Biol., 23, 579–611.
80) Li, C.C., Chiang, T.C., Wu, T.S., Pacheco-Rodriguez, G., Moss, J., & Lee, F.J. (2007) ARL4D recruits cytohesin-2/ARNO to modulate actin remodeling. Mol. Biol. Cell, 18, 4420–4437.
81) Pasqualato, S., Renault, L., & Cherfils, J. (2002) Arf, Arl, Arp and Sar proteins: a family of GTP-binding proteins with a structural device for ‘front-back’ communication. EMBO Rep., 3, 1035–1041.
82) Saucedo, L.J. & Edgar, B.A. (2007) Filling out the Hippo pathway. Nat. Rev. Mol. Cell Biol., 8, 613–621.
83) Aragona, M., Panciera, T., Manfrin, A., Giulitti, S., Michielin, F., Elvassore, N., Dupont, S., & Piccolo, S. (2013) A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell, 154, 1047–1059.
84) Dupont, S., Morsut, L., Aragona, M., Enzo, E., Giulitti, S., Cordenonsi, M., Zanconato, F., Le Digabel, J., Forcato, M., Bicciato, S., et al. (2011) Role of YAP/TAZ in mechanotransduction. Nature, 474, 179–183.
85) Wada, K., Itoga, K., Okano, T., Yonemura, S., & Sasaki, H. (2011) Hippo pathway regulation by cell morphology and stress fibers. Development, 138, 3907–3914.
86) Nguyen, D.X., Bos, P.D., & Massagué, J. (2009) Metastasis: From dissemination to organ-specific colonization. Nat. Rev. Cancer, 9, 274–284.
87) Kurayoshi, M., Oue, N., Yamamoto, H., Kishida, M., Inoue, A., Asahara, T., Yasui, W., & Kikuchi, A. (2006) Expression of Wnt-5a is correlated with aggressiveness of gastric cancer by stimulating cell migration and invasion. Cancer Res., 66, 10439–10448.
88) Kikuchi, A. & Yamamoto, H. (2008) Tumor formation due to abnormalities in the β-catenin-independent pathway of Wnt signaling. Cancer Sci., 99, 202–208.
89) Yamamoto, H., Oue, N., Sato, A., Hasegawa, Y., Yamamoto, H., Matsubara, A., Yasui, W., & Kikuchi, A. (2010) Wnt5a signaling is involved in the aggressiveness of prostate cancer and expression of metalloproteinase. Oncogene, 29, 2036–2046.
90) Muthuswamy, S.K. & Xue, B. (2012) Cell polarity as a regulator of cancer cell behavior plasticity. Annu. Rev. Cell Dev. Biol., 28, 599–625.
91) Krahn, M.P. (2020) Phospholipids of the plasma membrane—Regulators or consequence of cell polarity? Front. Cell Dev. Biol., 8, 277.
92) Polakis, P. (2007) The many ways of Wnt in cancer. Curr. Opin. Genet. Dev., 17, 45–51.
93) Sekido, Y., Fong, K.M., & Minna, J.D. (2003) Molecular genetics of lung cancer. Annu. Rev. Med., 54, 73–87.
94) Fujii, S., Matsumoto, S., Nojima, S., Morii, E., & Kikuchi, A. (2015) Arl4c expression in colorectal and lung cancers promotes tumorigenesis and may represent a novel therapeutic target. Oncogene, 34, 4834–4844.
95) Harada, T., Matsumoto, S., Hirota, S., Kimura, H., Fujii, S., Kasahara, Y., Gon, H., Yoshida, T., Itoh, T., Haraguchi, N., et al. (2019) Chemically modified antisense oligonucleotide against ARL4C inhibits primary and metastatic liver tumor growth. Mol. Cancer Ther., 18, 602–612.
96) Kimura, K., Matsumoto, S., Harada, T., Morii, E., Nagatomo, I., Shintani, Y., & Kikuchi, A. (2020) ARL4C is associated with initiation and progression of lung adenocarcinoma and represents a therapeutic target. Cancer Sci., 111, 951–961.
97) Isono, T., Chano, T., Yoshida, T., Makino, A., Ishida, S., Suzaki, M., Kageyama, S., Kawauchi, A., Yonese, J., & Yuasa, T. (2019) ADP-ribosylation factor-like 4C is a predictive biomarker of poor prognosis in patients with renal cell carcinoma. Am. J. Cancer Res., 9, 415–423.
98) Chen, Q., Weng, H.Y., Tang, X.P., Lin, Y., Yuan, Y., Li, Q., Tang, Z., Wu, H.B., Yang, S., Li, Y., et al. (2019) ARL4C stabilized by AKT/mTOR pathway promotes the invasion of PTEN-deficient primary human glioblastoma. J. Pathol., 247, 266–278.
99) Hu, Q., Masuda, T., Sato, K., Tobo, T., Nambara, S., Kidogami, S., Hayashi, N., Kuroda, Y., Ito, S., Eguchi, H., et al. (2018) Identification of ARL4C as a peritoneal dissemination-associated gene and its clinical significance in gastric cancer. Ann. Surg. Oncol., 25, 745–753.
100) Wakinoue, S., Chano, T., Amano, T., Isono, T., Kimura, F., Kushima, R., & Murakami, T. (2019) ADP-ribosylation factor-like 4C predicts worse prognosis in endometriosis-associated ovarian cancers. Cancer Biomark., 24, 223–229.
101) Chen, X., Su, Z., Wang, S., & Xu, H. (2016) Clinical and prognostic significance of Arl4c expression in colorectal cancer. Cancer Biomark., 16, 253–257.
102) Yahara, A., Shrestha, A.R., Yamamoto, T., Hari, Y., Osawa, T., Yamaguchi, M., Nishida, M., Kodama, T., & Obika, S. (2012) Amido-bridged nucleic acids (AmNAs): Synthesis, duplex stability, nuclease resistance, and in vitro antisense potency. ChemBioChem, 13, 2513–2516.
103) Ghosh, M.G., Thompson, D.A., & Weigel, R.J. (2000) PDZK1 and GREB1 are estrogen-regulated genes expressed in hormone-responsive breast cancer. Cancer Res., 60, 6367–6375.
104) Matsumoto, S., Yamamichi, T., Shinzawa, K., Kasahara, Y., Nojima, S., Kodama, T., Obika, S., Takehara, T., Morii, E., Okuyama, H., et al. (2019) GREB1 induced by Wnt signaling promotes development of hepatoblastoma by suppressing TGFβ signaling. Nat. Commun., 10, 3882.
105) Koch, A., Denkhaus, D., Albrecht, S., Leuschner, I., von Schweinitz, D., & Pietsch, T. (1999) Childhood hepatoblastomas frequently carry a mutated degradation targeting box of the β-catenin gene. Cancer Res., 59, 269–273.
106) Qian, D., Jones, C., Rzadzinska, A., Mark, S., Zhang, X., Steel, K.P., Dai, X., & Chen, P. (2007) Wnt5a functions in planar cell polarity regulation in mice. Dev. Biol., 306, 121–133.
107) Saburi, S., Hester, I., Fischer, E., Pontoglio, M., Eremina, V., Gessler, M., Quaggin, S.E., Harrison, R., Mount, R., & McNeill, H. (2008) Loss of Fat4 disrupts PCP signaling and oriented cell division and leads to cystic kidney disease. Nat. Genet., 40, 1010–1015.
108) Karner, C.M., Chirumamilla, R., Aoki, S., Igarashi, P., Wallingford, J.B., & Carroll, T.J. (2009) Wnt9b signaling regulates planar cell polarity and kidney tubule morphogenesis. Nat. Genet., 41, 793–799.
109) Matsuyama, M., Aizawa, S., & Shimono, A. (2009) Sfrp controls apicobasal polarity and oriented cell division in developing gut epithelium. PLoS Genet., 5, e1000427.
110) Aw, S. & Levin, M. (2009) Is left-right asymmetry a form of planar cell polarity? Development, 136, 355–366.
111) Harada, A., Matsumoto, S., Yasumizu, Y., Akama, T., Eguchi, H., & Kikuchi, A. (2021) Recruitment of KRAS downstream target ARL4C to membrane protrusions accelerates pancreatic cancer cell invasion. bioRxiv, 2021.2002.2023.432112.
112) Itoh, Y. (2015) Membrane-type matrix metalloproteinases: Their functions and regulations. Matrix Biol., 44–46, 207–223.
113) Matsumoto, S., Kurimoto, T., Taketo, M.M., Fujii, S., & Kikuchi, A. (2016) The WNT/MYB pathway suppresses KIT expression to control the timing of salivary proacinar differentiation and duct formation. Development, 143, 2311–2324.
114) Gröbner, S.N., Worst, B.C., Weischenfeldt, J., Buchhalter, I., Kleinheinz, K., Rudneva, V.A., Johann, P.D., Balasubramanian, G.P., Segura-Wang, M., Brabetz, S., et al.; ICGC PedBrain-Seq Project; ICGC MMML-Seq Project (2018) The landscape of genomic alterations across childhood cancers. Nature, 555, 321–327.
著者紹介Author Profile
 松本 真司(まつもと しんじ)
松本 真司(まつもと しんじ)大阪大学大学院医学系研究科分子病態生化学准教授.博士(歯学).
略歴1980年島根県に生る.2005年広島大学歯学部歯学科卒業.09年同大学院医歯薬学総合研究科博士課程修了.同年より大阪大学大学院医学系研究科特任研究員,12年より特任助教,16年より助教を経て,21年より現職.
研究テーマと抱負Wntをはじめとする液性因子シグナルによる組織形成機構と腫瘍形成機構の類似性に着目して,両者に共通する制御シグナルや分子を明らかにすることを目指して研究を行ってきた.今後は,発生過程の前駆細胞から生じる小児固形腫瘍の発がん機序にも迫ってみたい.
ウェブサイトhttp://www.med.osaka-u.ac.jp/pub/molbiobc/index.html
趣味映画鑑賞,釣り.