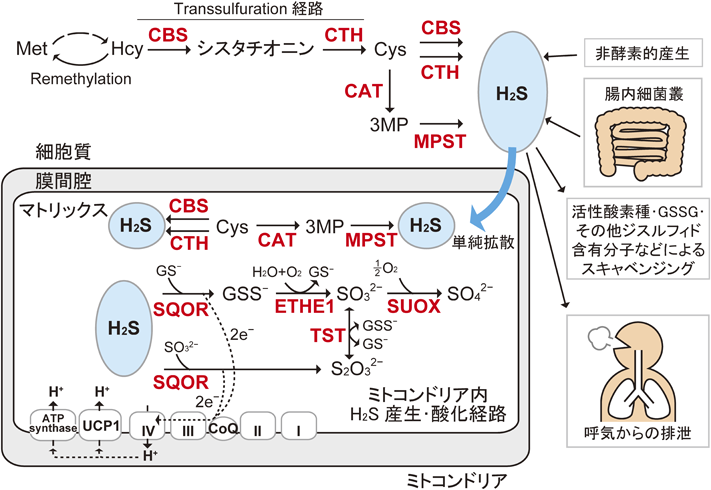
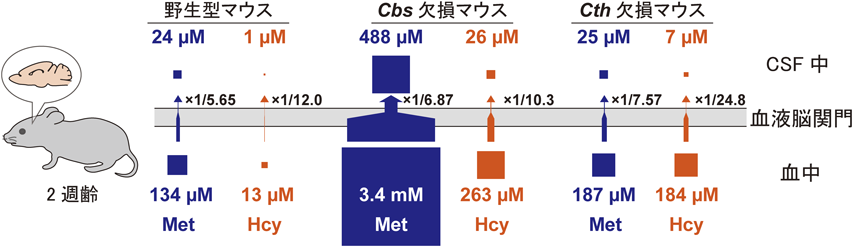
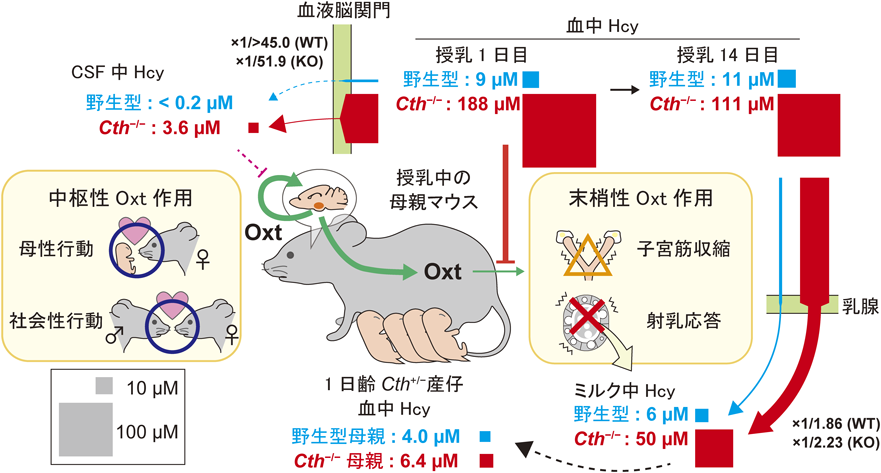
硫化水素産生・代謝酵素の役割:ヒト遺伝病と病態モデルマウスからの知見Role of hydrogen sulfide producing and metabolizing enzymes: Insights from human genetic diseases and their mouse models
昭和薬科大学衛生化学研究室Laboratory of Health Chemistry, Showa Pharmaceutical University ◇ 〒194–8543 東京都町田市東玉川学園3–3165 ◇ 3–3165 Higashi-Tamagawagakuen, Machida, Tokyo 194–8543, Japan